超声波辅助提取苦丁茶多酚及其抗氧化与降糖活性研究
尹国利,赵露,邹成梅,胡婷
(武汉工程大学环境生态与生物工程学院,湖北武汉430205)
大叶冬青苦丁茶(Ilex latifolia Thunb.)是冬青科植物大叶冬青的叶,主要分布在我国西南和华南等地区,其成品茶清香有苦味、而后回味甘凉。苦丁茶内含有多种生物活性物质,具有丰富的次生代谢产物和潜在的生物活性。
现代药理研究表明,天然多酚具有抗氧化、降血糖和降血脂等功效,因其活性强、副作用小,可用于研制抗糖尿病和保肝杀菌药物[1]。Guilherme等[2]发现,膳食多酚可以调节肠道功能,改变食物的表观血糖指数,从而降低代谢综合征引起的血糖和血脂水平。另有研究表明,抑制α-葡萄糖苷酶和α-淀粉酶活性可有效降低血糖和血脂含量,从而起到预防糖尿病及其并发症的作用[3-5]。目前,α-葡萄糖苷酶和α-淀粉酶的合成抑制剂药物如阿卡波糖等已得到广泛的临床应用,但合成药物易产生胃肠道功能紊乱,肝细胞性肝损伤等副作用[4]。苦丁茶作为一种天然资源,其多酚含量相当可观,近年来关于苦丁茶多酚的提取及其药理作用的研究备受关注[6]。
本研究以大叶冬青苦丁茶多酚为原料,利用超声辅助提取法(ultrasound-assisted extraction,UAE)提取苦丁茶多酚,采用响应面法(response surface method,RSM)探究不同工艺参数对苦丁茶多酚得率的影响,并根据Box-Behnken试验设计对工艺条件进行优化,旨在获得最佳的提取工艺条件。然后利用铁氰化钾还原法测定苦丁茶多酚的总还原力,采用分光光度计法测定苦丁茶多酚对α-葡萄糖苷酶和α-淀粉酶的抑制活性,初步评价其抗氧化和降糖活性,以期为降血糖药物的开发提供理论基础,为苦丁茶成为一种新型生物活性物质在食品工业和人体健康方面的应用开辟新的道路。
1 材料与方法
1.1 材料和试剂
大叶冬青苦丁茶原料:广州三香茶叶有限公司,粉碎研磨过80目筛。福林酚:北京索来宝科技有限公司;绿原酸:上海佳和生物科技有限公司;抗坏血酸(VC)、α-葡萄糖苷酶(10 000 U/g)、α-淀粉酶(10 000 U/g)、对硝基苯基-α-D-吡喃葡萄糖(p-nitrophenyl α-D-glucopyranoside,PNPG):广州东聚实验化工仪器有限公司。以上化学试剂均为分析级。
1.2 苦丁茶多酚提取
准确称取2 g苦丁茶粗粉,加入乙醇溶液。分别探讨提取温度、提取时间、料液比、超声功率、乙醇浓度对多酚得率的影响。反应结束后,8000 r/min离心10 min,取上清液浓缩干燥至恒重即得多酚样品。以10 mg多酚样品为原料,制备1.0 mg/mL的苦丁茶多酚溶液。
1.3 多酚得率测定
多酚得率的测定采用福林酚比色法[7]。吸取1.0 mL苦丁茶多酚提取液,加入3.0 mL的福林酚显色剂,充分摇匀后在室温25℃下反应5 min。加入4.5 mL饱和Na2CO3溶液,混匀,加水定容至25 mL。摇匀后在30℃保温箱中避光反应30 min。以去离子水代替样品溶液为空白,在747 nm处测定反应液的吸光值。以绿原酸浓度为横坐标,吸光度值为纵坐标绘制绿原酸的标准曲线。样品溶液中的多酚得率以绿原酸当量计,苦丁茶中多酚得率的计算公式如下:

1.4 苦丁茶多酚提取工艺的优化研究
1.4.1 变量择优
将料液比 [1 ∶10、1 ∶15、1 ∶20、1 ∶25、1 ∶30(g/mL)]、提取时间(30、60、90、120、150 min)、提取温度(20、30、40、50、60℃)、乙醇浓度(0%、25%、50%、75%、100%)和超声功率(40、50、60、70、80 W)作为单一因素的变量选取范围,探究其对苦丁茶多酚得率的影响。
1.4.2 试验设计
以苦丁茶多酚得率为响应值,选取提取时间(A)、超声功率(B)和料液比(C)为自变量,每个变量选择3个水平(-1,0,1),在 Design-expert软件的 Box-Behnken设计中选择5个中心点后自动生成试验设计,将数据拟合为二阶多项式模型,得到回归系数,采用以下方程式进行回归分析:
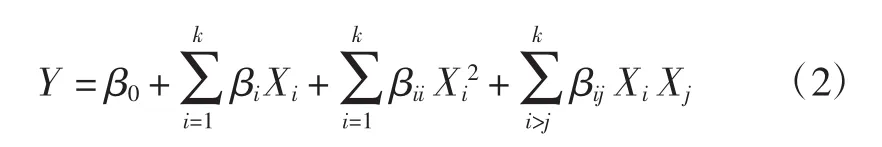
式中:Y 是响应值;β0、βi、βii、βij分别是截距、一次回归系数、二次回归系数和交叉积回归系数;Xi和Xj是自变量的编码值;k是被测变量的个数(k=3)。
1.4.3 响应面优化
通过对过程、响应面和轮廓图的回归拟合,得到各因素水平对应的响应值,据此得到最优预测响应值和相应的试验条件[8-9]。响应面分析主要采用非线性拟合的方法得到拟合方程,根据拟合方程,绘制响应面图,得到最佳试验条件,并进行试验验证。
1.5 抗氧化活性的测定[10]
还原力是表现体外抗氧化能力的一项重要指标。本试验采用铁氰化钾还原法测定了苦丁茶多酚的还原力。依次将不同浓度的样品溶液(1、0.8、0.6、0.4、0.2、0.1、0.08、0.06、0.04、0.02 mg/mL)、0.2 mol/L pH=6.6的磷酸盐缓冲液(phosphate buffer saline,PBS)和 1%K3Fe(CN)6溶液各取0.4 mL加入离心管中,混匀,在50℃保温20 min后,加入0.4 mL 10%的三氯乙酸混合离心10 min。取上清液1.0 mL,依次加入1.0 mL蒸馏水和0.2 mL 0.1%氯化铁溶液,混匀后在室温25℃下反应10 min,在700 nm处测定其吸光度,以VC作阳性对照。计算其相对总还原百分率,计算如下公式:
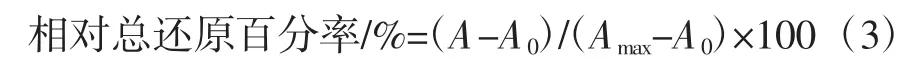
式中:A和A0分别表示测定样品的吸光值和空白样品的吸光值,Amax为在一次测量内最大的吸光值。
1.6 苦丁茶多酚酶活性抑制研究
1.6.1 苦丁茶多酚对α-葡萄糖苷酶的抑制作用[11]
在离心管中依次加入0.05 U/mL 800 μL的α-葡萄糖苷酶溶液(10 000 U/g)和不同浓度(6、5、4、3、2、1.8、1.5、1.2、1、0.8 mg/mL)的待测样品溶液(400 μL),在摇床中(37℃,40 r/min)孵育5 min。在每个离心管中加入 3 mmol/L底物溶液(400 μL),混匀,同条件再次孵育30 min。最后加入0.1 mol/L的Na2CO(31 mL)来终止反应,在405 nm处测定吸光度值。阴性对照试验是用相同体积的PBS代替样品溶液。样品对α-葡萄糖苷酶的抑制率(%)按如下公式计算:

式中:A1表示阴性对照试验的吸光值;A2表示待测样品的吸光值;A3表示只加样品的吸光值。
1.6.2 苦丁茶多酚对α-淀粉酶的抑制作用[12]
取0.25 mL的α-淀粉酶溶液(10 000 U/g)与相同体积不同浓度的样品(6、5、4、3、2、1.8、1.5、1.2、1、0.8 mg/mL)溶液混合,37℃预热10 min。后加入0.5 mL同样已预热的底物溶液,在37℃水浴中反应8 min,然后加入 0.5 mL 3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)显色剂,混合后沸水加热8 min。冷却至室温25℃后加入5 mL去离子水稀释,并在540 nm处测定吸光度值。另取0.25 mL去离子水代替样品溶液,作为无抑制剂的对照组。样品对α-淀粉酶的抑制率(%)按如下公式计算:

式中:A1和A2分别表示无抑制剂和有抑制剂情况下的吸光度。
2 结果与分析
2.1 绿原酸标准曲线的测定
通过测定绿原酸标准品吸光度曲线,得到回归方程为:y=2.404 8x+0.025 9,相关系数 R2=0.999,x 为绿原酸含量,y为吸光度值,绿原酸标准曲线如图1所示。
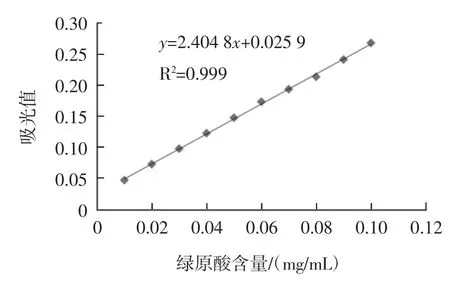
图1 绿原酸标准曲线Fig.1 Standard curve of chlorogenic acid
结果表明,绿原酸含量在0.01 mg/mL~0.1 mg/mL范围内与吸光度值呈良好的线性关系,可作为计算苦丁茶多酚得率的标准曲线。
2.2 单因素试验
多酚得率受到提取时间、溶剂浓度、料液比和提取温度等因素的影响[8]。本研究初步探讨了不同参数对苦丁茶多酚得率的影响,试验结果如图2所示。
由图2A可知,乙醇浓度从0%增加到50%时,多酚得率随着乙醇浓度的增加而上升;当乙醇浓度大于50%时,多酚得率逐渐下降。由此可知,提取苦丁茶多酚的最佳溶剂浓度为50%乙醇。与其它浓度的乙醇溶液作为提取溶剂相比,使用50%乙醇来提取多酚的得率具有绝对优势,故将乙醇浓度这个单因素视为影响苦丁茶多酚得率的非关键因素,不作Box-Benhnken试验设计和响应面优化分析。
由图2B可知,提取苦丁茶多酚的最佳提取温度为40℃。相关文献报道,适当提高多酚的提取温度有利于提取过程中有机溶剂的扩散和传质,但过高的温度也会分解提取物中的多酚物质[13]。因此,选择40℃作为苦丁茶多酚的最佳提取温度,将提取温度这个单因素视为影响苦丁茶多酚得率的非关键因素,不作Box-Benhnken试验设计和响应面优化分析。
图2C与图2D试验结果分别显示出最佳的料液比与提取时间分别为1∶20(g/mL)和90 min。Liu等[14]和Wang等[15]的研究也显示出类似的结果。提取溶剂的体积越大,接触面积越大,浸提过程越充分,多酚的得率也越高,但随着溶剂体积的不断增大,会增加多糖、蛋白质等杂质的溶解,从而阻碍多酚的溶解。因此最佳料液比与提取时间需要通过Box-Benhnken试验设计和响应面分析来确定。
超声功率对苦丁茶多酚得率的影响结果如图2E所示,在超声功率为60 W时多酚得率最高,但与其他功率时的多酚得率差别不大,因此最佳超声功率也需要通过Box-Benhnken试验设计和响应面分析来确定。
2.3 Box-Benhnken试验设计及响应结果
根据Box-Behnken中心组合试验设计原理,在单因素初步结果的基础上,选择超声时间(60、90、120 min)、超声功率(50、60、70 W)和料液比[1 ∶15、1 ∶20、1 ∶25(g/mL)]作为 3 个关键影响因素,比较 3 个自变量的测定值、预测值以及优化条件下苦丁茶多酚的提取率。每组试验重复3次,具体试验结果见表1所示。
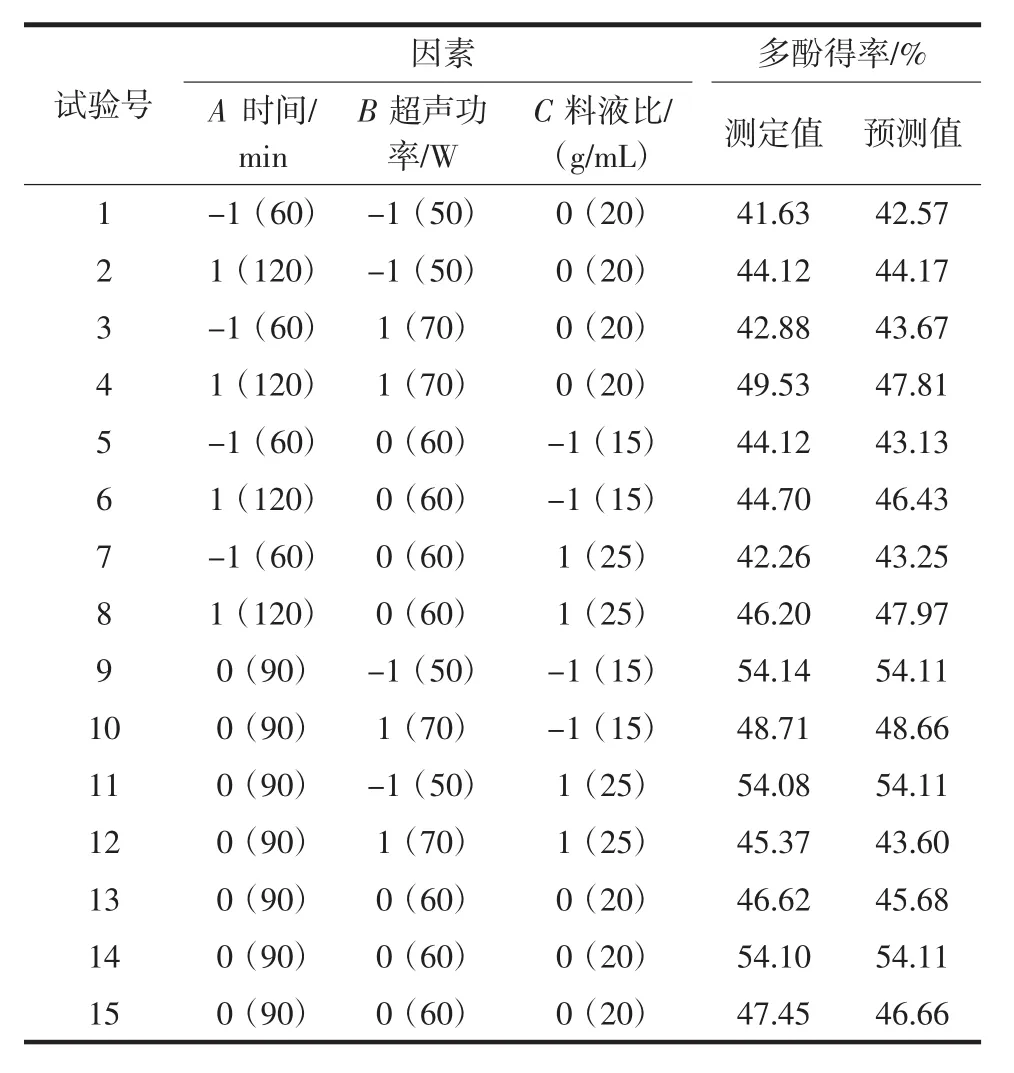
表1 Box-Benhnken设计及多酚含量试验预测值Table 1 Box-Benhnken design and total polyphenol content test prediction value
2.4 模型分析
利用Design-expert软件处理所得的试验数据进行二次方差分析(AVOVA)。回归系数与各因素间的相互作用显著性如表2所示,证明多酚产量模型具有重要意义(R2=0.988 3)。
软件分析得到的回归方程如下:
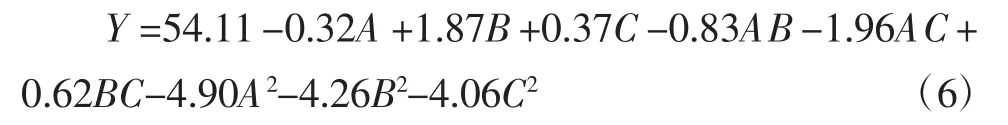
从回归方程变异分析结果可以看出,F值为14.72,P<0.01,说明响应面模型具有很高的显著性。另外,相关系数R2为0.988 3,大于0.900 0,说明方程的模拟相关度很好。回归方程反映了各因素与响应值间的关系,可利用回归方程确定最佳提取工艺。从表中的数据可以得出,一次项B和相互作用项AC对多酚得率有显著影响,A2、B2和C2对多酚得率的影响极为显著。

表2 响应面二次模型方差分析表Table 2 Analysis of variance of response surface quadratic model
2.5 最佳工艺条件的确定
利用二维等高线图和三维响应面图反映不同因素对苦丁茶多酚得率的交互作用,如图3所示。
图3(A)与图3(C)分别表示当料液比为最佳时,提取时间和超声功率对苦丁茶多酚得率的相互作用与超声功率处于最佳水平时,提取时间和料液比对苦丁茶多酚得率的影响。从这两个图可看出,两两因素交互作用的响应面图都较为平缓,因此,两者交互作用并不明显。由图3(B)可知,当超声功率很低时,多酚得率随溶剂体积的增大而显著上升,表现为曲线较陡。当超声功率较高时,随着溶剂体积的增大,多酚的得率略有增加。当溶剂体积很小时,多酚得率随超声功率的增加显著增加。当溶剂体积相对较大时,随着超声功率的增加,多酚的得率略有增加,但不明显。结果表明,料液比与超声功率的交互作用明显。
2.6 模型合理性论证
通过Design-expert对各关键因素分析,确定了最佳提取条件:超声时间106.85 min、超声功率61.88 W、料液比1∶20.67(g/mL)。在优化条件下,用该模型预测最大多酚得率为54.114%。为了验证模型的充分性,并考虑实际操作的可能性,对最佳提取条件进行了修正:提取时间107 min,超声功率62 W,料液比1∶21(g/mL)。同时,将最佳提取温度(40℃)和乙醇浓度(50%)确定为两个非临界因素,并在此条件下进行了验证性试验,通过3次平行试验验证模型的准确性,所得多酚的平均得率为54.13%。与理论值比较,响度偏差为0.016%,说明用响应面法优化苦丁茶多酚的提取工艺是可行的,该模型合理,理论值与实际值基本一致,具有一定的应用价值。
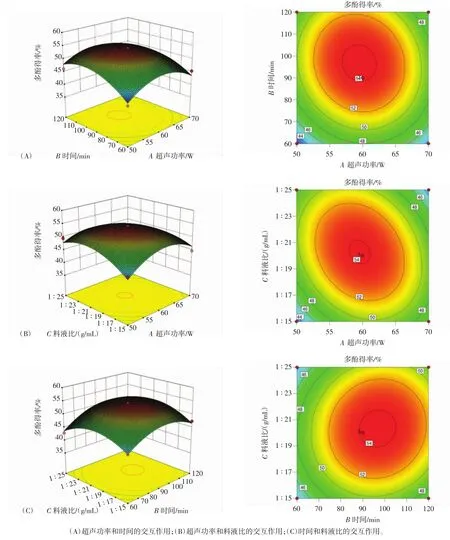
图3 各因素交互作用对苦丁茶多酚得率影响的响应面与等高线图Fig.3 Contour plots and response surface showing the interactive effects of various factors on the extraction yield of polyphenol from Ilex latifolia Thunb
2.7 总还原力的测定
苦丁茶多酚和阳性对照VC的总还原力比较曲线如图4所示。
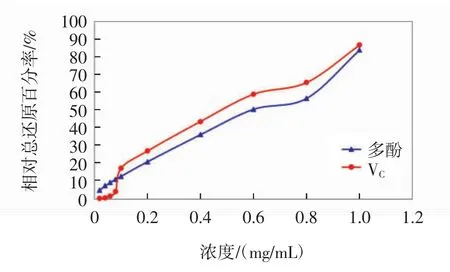
图4 VC和苦丁茶多酚的还原能力Fig.4 Reduction ability of VCand polyphenols from Ilex latifolia Thunb.
由图4可知,苦丁茶多酚和VC在浓度为0.02mg/mL~1.0 mg/mL时,相对总还原百分率均随着样品浓度的增加而增大。经过相关计算得出,苦丁茶多酚的总还原力IC50值为0.584 mg/mL,阳性对照VC的总还原力IC50值为0.476 mg/mL,苦丁茶多酚的IC50值略微低于VC。在低浓度区(0.02 mg/mL~0.1 mg/mL时),苦丁茶多酚的总还原力高于VC;在中浓度区(0.1 mg/mL~0.8 mg/mL时),苦丁茶多酚和VC的总还原力均呈现迅速上升趋势;在高浓度区(0.8 mg/mL~1.0 mg/mL时),苦丁茶多酚和VC的总还原力相差不大,两者的相对总还原百分率非常接近。由此表明,苦丁茶多酚具有很好的抗氧化活性。
2.8 苦丁茶多酚对酶活性的抑制作用
α-葡萄糖苷酶可以水解PNPG生成一定量的对硝基苯酚,因此,以PNPG为底物可以测定样品对α-葡萄糖苷酶活性的抑制作用。Pradeep等[16-18]的研究表明,植物酚类化合物能抑制α-淀粉酶和α-葡萄糖苷酶活性,显著降低淀粉水解速率。苦丁茶多酚对酶活性的抑制作用见图5。

图5 苦丁茶多酚对α-葡萄糖苷酶和α-淀粉酶活性的抑制作用Fig.5 Inhibition of polyphenol from Ilex latifolia Thunb.on α-glucosidase and α-amylase
由图5(A)可知,随着苦丁茶样品浓度的增加,多酚样品溶液对α-葡萄糖苷酶活性的抑制率也随之上升,苦丁茶多酚溶液浓度在0.8 mg/mL~6.0 mg/mL范围内,对α-葡萄糖苷酶活性的抑制率呈剂量依赖关系。在低浓度区域,多酚样品溶液对α-葡萄糖苷酶的抑制率高于40%,当多酚溶液浓度为6.0 mg/mL时,对α-葡萄糖苷酶的抑制率高于80%,抑制作用明显,经过计算得到,苦丁茶多酚对α-葡萄糖苷酶活性抑制的IC50值为1.15 mg/mL。由试验结果可以看出,苦丁茶多酚对α-葡萄糖苷酶的活性有一定的抑制作用。
由图5(B)可知,多酚样品溶液显示出对α-淀粉酶的剂量依赖性抑制,随着多酚浓度的增加,其对α-淀粉酶的抑制率也不断上升,苦丁茶多酚对α-淀粉酶活性抑制的IC50值为1.31 mg/mL。当多酚样品溶液浓度为6.0 mg/mL时,对α-淀粉酶活性的抑制率高于90%,抑制效果显著。由此可以得出,苦丁茶多酚对α-淀粉酶的活性也有很好的抑制作用。
3 结论
超声辅助提取技术是一种快速提取苦丁茶多酚的优良方法,本研究以大叶冬青苦丁茶多酚为原料,用超声辅助提取苦丁茶多酚,采用响应面法探究不同工艺参数对苦丁茶多酚得率的影响,并根据Box-Behnken试验设计对工艺条件进行优化,通过单因素与正交试验确定苦丁茶多酚最佳提取工艺条件为:提取时间107 min、料液比 1 ∶21(g/mL)、超声功率 62 W,苦丁茶多酚的得率为54.13%。利用铁氰化钾还原法测定苦丁茶多酚的总还原力,初步评价其抗氧化活性,试验结果表明,苦丁茶多酚浓度在0.02 mg/mL~1.0 mg/mL时,总还原力随着样品浓度的增加呈迅速上升趋势,IC50值为0.584 mg/mL,略低于阳性对照VC的抗氧化能力,由此表明,苦丁茶多酚具有很好的抗氧化活性,是一种很好的天然抗氧化物质。此外,采用分光光度计法测定苦丁茶多酚对α-葡萄糖苷酶和α-淀粉酶的抑制活性,初步评价其降糖活性,试验结果表明苦丁茶多酚对α-葡萄糖苷酶和α-淀粉酶活性的抑制效果均显著,IC50值分别为1.15 mg/mL和1.31 mg/mL,这提示苦丁茶多酚可能成为治疗2型糖尿病的有效功能成分,以期为降血糖药物的开发提供理论基础,对临床治疗和保健食品的开发具有一定的指导意义。

