复合蛋白酶水解核桃粕制备血管紧张素转化酶抑制肽工艺优化
祝素莹,朱瑜,张银志,孙秀兰,宁德鲁,耿树香,*
(1.江南大学食品学院食品科学与技术国家重点实验室,食品安全与营养协同创新中心,江苏无锡214122;2.汉中市质量技术检验检测中心,陕西汉中723000;3.云南省林业科学院,云南昆明650201)
我国核桃产量居世界首位,但在核桃产品的开发和核桃资源的充分利用上仍有很大的发展空间[1-3]。核桃经榨油后的副产物核桃饼粕中含有高达50%左右的蛋白质,而目前核桃饼粕大部分经简单加工后作为饲料或肥料,产品价值和利用率较低[4]。血管紧张素转化酶(angiotensin converting enzyme,ACE)是一种含锌二羧肽酶,在血压调节过程中具有重要作用。ACE抑制肽,又称降血压肽,能够显著降低血管紧张素转化酶活性,具有降低血压的作用。近年来,植物蛋白源ACE抑制肽的制备及活性分析成为了生物活性肽研究的热点[5-8]。
核桃粕蛋白质含有人体8种必需氨基酸,是制备生物活性多肽的优良原料[9]。本课题以压榨脱油后的核桃饼粕为原料,利用碱溶酸沉法提取核桃蛋白,通过复合酶酶解制备降血压核桃多肽,优化酶解工艺条件并分析了降血压核桃多肽的常温储存稳定性和体外消化稳定性,为进一步提高核桃的附加价值和资源利用率,同时为核桃降血压肽的开发与应用提供思路,为其工业化生产奠定技术基础。
1 材料与方法
1.1 材料与试剂
榨油后核桃饼粕:云南省林业科学院;风味蛋白酶(1.5×104U/g)、中性蛋白酶(5×104U/g)、菠萝蛋白酶(5×104U/g)、木瓜蛋白酶(1×105U/g)、碱性蛋白酶(2×105U/g)、胰蛋白酶(2 000 U/g):南宁庞博生物工程有限公司;ACE、马尿酰-组氨酰-亮氨酸(N-hippuryl-L-histidyl-L-leucine hydrate,HHL)、胃蛋白酶(酶活力≥1 200 U/g):美国Sigma公司;四硼酸钠、硼酸、石油醚(30℃~60℃)等:国药集团化学试剂有限公司。以上化学试剂均为分析纯。
1.2 仪器与设备
ZNCL-GS型恒温磁力搅拌器:河南爱博特科技发展有限公司;DHG-9140型电热鼓风干燥箱:上海一恒科学仪器有限公司;UV-1800型紫外可见分光光度计:日本岛津公司;ST 40R型台式离心机:赛默飞世尔科技(中国)有限公司;RV 8型旋转蒸发仪:艾卡(广州)仪器设备有限公司;SCIENTZ-10N型冷冻干燥机:宁波新芝生物科技股份有限公司;Waters 1525型高效液相色谱仪:沃特世科技(上海)有限公司。
1.3 方法
1.3.1 核桃蛋白提取
基于碱溶酸沉原理,参考姜莉等[10]的方法提取核桃蛋白。将脱油后的核桃饼粕粉碎过40目筛,得核桃粕粉。称取适量的核桃粕粉,按料液比1∶20(g/mL)配成核桃粕粉溶液,用1 mol/L NaOH溶液调节pH值至9.0,超声辅助提取1 h后,4 000 r/min下离心20 min,弃去沉淀。上清液用1 mol/L HCl溶液调节pH值至4.5,25℃室温下静置 2 h,4 000 r/min离心 20 min,取沉淀,水洗至中性后真空冷冻干燥,粉碎过40目筛,得到核桃蛋白粉。
1.3.2 核桃多肽制备
称取适量核桃蛋白粉,配制成一定质量浓度的核桃蛋白液,调节所需的酶解条件(酶解温度、pH值、底物浓度、酶制剂种类与添加量)。恒温磁力加热搅拌器中400 r/min酶解1 h,沸水浴灭酶10 min,冷却至室温(25℃)后10 000 r/min离心15 min,上清液旋转蒸发浓缩后真空冷冻干燥,得到核桃多肽粉,4℃密封冷藏备用。
1.3.3 复合蛋白酶选择
选择碱性蛋白酶、中性蛋白酶、风味蛋白酶、菠萝蛋白酶、木瓜蛋白酶、胰蛋白酶共6种酶,分别在各自最佳作用条件下对核桃蛋白进行酶解。以酶解液的体外ACE抑制活性为指标,筛选出ACE抑制活性较高的两种蛋白酶作为制备核桃蛋白来源ACE抑制肽的复合酶制剂。6种酶的最佳酶解条件见表1。

表1 6种蛋白酶的最佳作用条件Table 1 Optimum conditions for six proteases
1.3.4 单因素试验
以核桃多肽的体外ACE抑制活性为指标,在确定复合酶种类的基础上,进行单因素试验。分别考察复合蛋白酶比例(碱性蛋白酶与中性蛋白酶质量比1∶3、1 ∶2、1 ∶1、2 ∶1、3 ∶1)、复合蛋白酶添加量(4 000、6 000、8 000、10 000、12 000 U/g)、酶解时间(0.5、1、1.5、2、2.5 h)、酶解温度(40、45、50、55、60℃)、酶解 pH 值(6.5、7.0、7.5、8.0、8.5)、底物浓度(1%、2%、3%、4%、5%)等因素对制备核桃蛋白源ACE抑制肽活性的影响,确定适宜的酶解条件。
1.3.5 正交试验
在单因素试验基础上,对4个影响显著的因素进行正交试验优化,建立L9(34)正交表,以ACE抑制活性为指标,进行四因素三水平的正交试验优化,试验因素水平表见表2。

表2 正交试验数据表Table 2 Design of orthogonal test
1.3.6 核桃多肽体外ACE抑制活性的测定
体外ACE抑制活性测定方法见表3。

表3 体外ACE抑制活性测定方法Table 3 Method for the determination of ACE inhibition rate in vitro
采用改进的Cushman等[11]的方法对ACE抑制活性进行测定:依次加入表3中的试剂,然后向各试管加入1.8 mL乙酸乙酯,振荡15 s,4 000 r/min离心15 min,吸取1 mL的乙酸乙酯层,于120℃的恒温干燥箱内干燥约45 min,直至乙酸乙酯完全挥干。取出冷却并加入3 mL去离子水复溶。于波长228 nm处测定吸光值,ACE抑制活性计算公式如下,并计算IC50值(当ACE的活性被抑制到50%时所需的肽浓度):

式中:Aa表示反应中核桃多肽液与ACE同时存在的吸光值;Ab表示反应中不加样品液的吸光值;Ac表示ACE与HHL空白反应的吸光值。
1.3.7 多肽相对分子质量测定
液相色谱法测定酶解得到的核桃多肽相对分子量分布。色谱条件:TSK Gel 2000 SWXL(300 mm×7.8 mm)色谱柱;流动相:乙腈/水/三氟乙酸(体积比为45 ∶55 ∶0.1);紫外波长:220 nm;流速:0.5 mL/min;柱温 30℃,进样体积 20 μL。Empower工作站 gel permeation chromatography软件处理数据。
1.3.8 核桃ACE抑制肽的储存稳定性
考察核桃ACE抑制肽在室温(25℃)储存条件下的吸湿性能及ACE抑制活性的变化情况,评估核桃多肽产品的性状稳定性。称取5 g干燥的多肽样品,平铺于洁净培养皿中,室温25℃放置,半敞口,每小时称重并记录,至恒重,同时测定每小时吸湿后的核桃多肽样品ACE抑制活性。根据质量变化计算吸湿性,根据吸湿前后ACE抑制活性变化计算相对ACE抑制活性。计算公式如下:

1.3.9 核桃ACE抑制肽体外消化稳定性
参考李莹等[12]的方法利用胃蛋白酶和胰蛋白酶进行胃和十二指肠的体外模拟消化,测定消化后的IC50值。
1.4 数据分析
试验均重复3次,试验数据以Means±SD表示。采用Origin 9.0、SPSS 22.0软件进行统计学分析及绘图处理。
2 结果与分析
2.1 复合酶种类筛选
在底物浓度为3%,酶添加量为8 000 U/g的条件下,分别在6种蛋白酶最适酶解温度和pH值条件下酶解反应1 h,测得体外ACE抑制活性见图1。
由图1可知,在一定酶解条件下,中性蛋白酶的酶解产物表现出了最高的体外ACE抑制活性,高达(48.7±0.70)%,与其它5种蛋白酶ACE抑制活性相比差异均显著(p<0.05);其次为碱性蛋白酶(46.56±0.47)%,而胰蛋白酶酶解产物表现出最低的体外ACE抑制活性,仅为(29.97±1.34)%。由于不同种类蛋白酶的作用位点不同,酶解获得的多肽片段也不相同,表现出的体外ACE抑制活性存在差异。综合考虑,选择中性蛋白酶和碱性蛋白酶作为复合酶,进行核桃蛋白制备ACE抑制肽酶解工艺条件的优化。

图1 6种蛋白酶酶解产物的体外ACE抑制活性Fig.1 ACE inhibitory activity of six kinds of enzymatic hydrolysates
2.2 单因素试验结果
2.2.1 复合酶添加比例对核桃多肽ACE抑制活性的影响
调整复合酶添加量8 000 U/g,底物浓度3%,酶解温度50℃,酶解pH 7.5,酶解时间1 h,以酶解液的体外ACE抑制活性为指标,优选碱性蛋白酶和中性蛋白酶复合添加质量比,结果如图2所示。
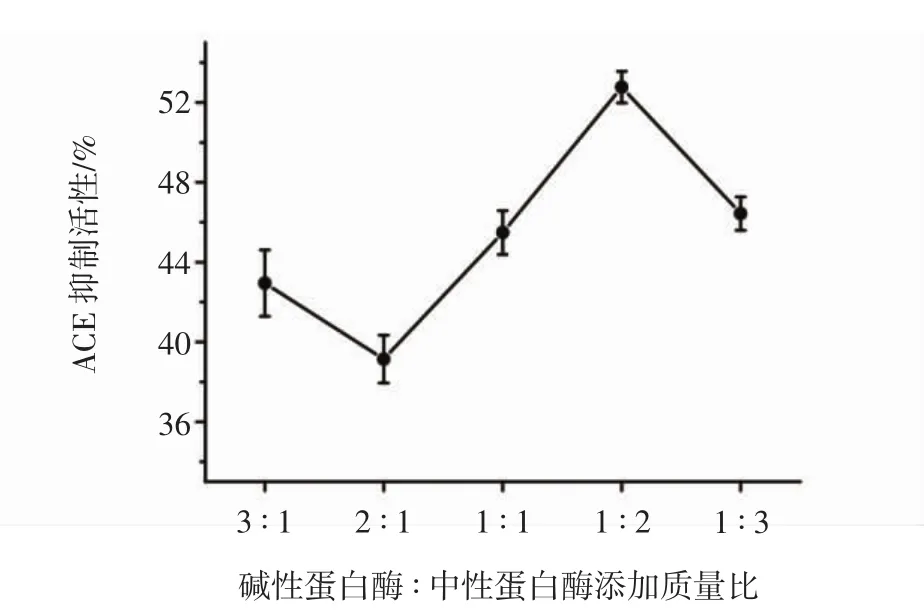
图2 复合酶添加比例对核桃多肽ACE抑制活性的影响Fig.2 Effect of compound enzyme ratio on ACE inhibitory activity of walnut polypeptides
复合酶酶解得到的核桃多肽的体外ACE抑制活性高于单一酶酶解得到的核桃多肽的体外ACE抑制活性,说明复合酶在一定复配比例时,酶解获得的产品活性均优于单一酶。当碱性蛋白酶与中性蛋白酶的添加质量比为1∶2时,制备得到的核桃多肽的体外ACE抑制活性最高,达(52.51±1.21)%;当碱性蛋白酶与中性蛋白酶的添加质量比为2∶1时,制备得到的核桃多肽的体外ACE抑制活性最低,仅为(38.05±1.66)%。由于碱性蛋白酶和中性蛋白酶具有不同的作用位点,利用复合酶酶解得到的多肽相较于单一酶酶解多肽更复杂,酶解获得的多肽分子量大小和生物活性存在差异。综上,选取最适碱性蛋白酶与中性蛋白酶的添加质量比为1∶2进一步优化酶解条件。
2.2.2 复合酶添加量对核桃多肽ACE抑制活性的影响
调整碱性蛋白酶和中性蛋白酶添加质量比为1:2,底物浓度3%,酶解温度50℃,酶解pH 7.5,酶解时间1 h,酶解液体外ACE抑制活性为指标,优化制备核桃ACE抑制肽的复合酶添加量,结果见图3。

图3 复合酶添加量对核桃多肽的ACE抑制活性的影响Fig.3 Effect of compound enzyme addition on ACE inhibitory activity of walnut polypeptides
如图3所示,复合酶添加量从4 000 U/g增至12 000 U/g时,酶解得到的核桃多肽的ACE抑制活性呈先增强后减弱的趋势,并在8 000 U/g时达到最高值,达(52.49±1.05)%。蛋白酶添加量低于8000 U/g时,随添加量的增加,酶与底物反应充分,生成较多的ACE抑制肽;当酶添加量超过8 000 U/g时,ACE抑制活性下降,可能是过量的蛋白酶将具有活性的多肽继续降解为更小的肽或者氨基酸[13]。因此,选取最适酶添加量为8 000 U/g,进一步优化酶解条件。
2.2.3 底物浓度对核桃多肽ACE抑制活性的影响
调整碱性蛋白酶和中性蛋白酶添加质量比为1∶2,复合酶添加量8 000 U/g,酶解温度50℃,酶解pH 7.5,酶解时间1 h,控制底物浓度分别为1%、2%、3%、4%、5%,探讨底物浓度对制备核桃ACE抑制肽的影响,结果如图4所示。
在考察底物浓度范围内,酶解产物ACE抑制活性呈先上升后下降的趋势。当酶解底物浓度为4%时,酶解得到的核桃多肽产物具有最高的ACE抑制活性,为(59.50±0.59)%。当底物浓度过低时,酶与底物反应不完全,得到的产物ACE抑制活性不高。当底物浓度过高时,酶解体系黏度变大,不利于酶的扩散,从而抑制酶解反应[14]。最终选取底物浓度4%为最佳反应条件。

图4 底物浓度对核桃多肽ACE抑制活性的影响Fig.4 Effect of substrate concentrations on ACE inhibitory activity of walnut polypeptides
2.2.4 pH值对核桃多肽ACE抑制活性的影响
调整碱性蛋白酶和中性蛋白酶添加质量比为1∶2,复合酶添加量为8 000 U/g,酶解温度50℃,底物浓度4%,酶解时间 1 h,探讨 pH 值分别为 6.5、7.0、7.5、8.0、8.5时对核桃ACE抑制效果的影响,结果如图5所示。

图5 酶解pH值对核桃多肽的ACE抑制活性的影响Fig.5 Effect of pH on ACE inhibitory activity of walnut polypeptides
pH值对核桃多肽的ACE抑制活性的影响呈先升高后下降的趋势。当pH值为8.0时制备得到的核桃多肽ACE抑制活性达到最高值(61.56±0.65)%。当酶解pH值过高或过低时,酶解产物的ACE抑制活性下降,可能原因是蛋白酶部分失活进而影响酶解作用。因此,最佳酶解pH值为8.0。
2.2.5 温度对核桃多肽ACE抑制活性的影响
调整碱性蛋白酶和中性蛋白酶添加质量比为1∶2,复合酶添加量8 000 U/g,酶解pH 8.0,底物浓度4%,酶解时间 1 h,考察酶解温度分别为 40、45、50、55、60℃时对核桃多肽体外ACE抑制活性的影响,结果如图6所示。
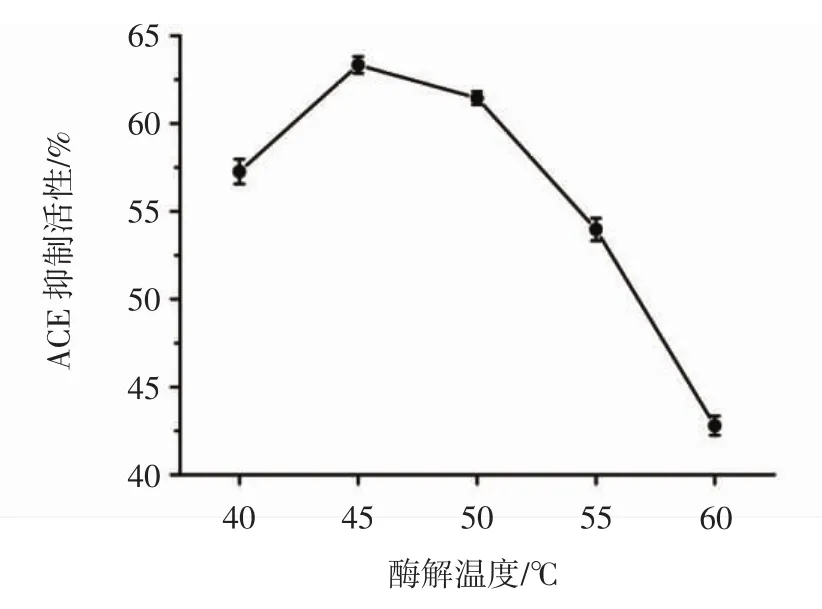
图6 酶解温度对核桃多肽的ACE抑制活性的影响Fig.6 Effect of temperature on ACE inhibitory activity of walnut polypeptides
当酶解温度为45℃时,酶解获得核桃多肽的ACE抑制活性高达(63.33±0.48)%。随着酶解温度的升高,蛋白酶受热结构发生改变,酶活力降低,从而造成ACE抑制活性显著下降。因此,优化试验最佳酶解温度为45℃。
2.2.6 酶解时间对核桃多肽的ACE抑制活性的影响
调整碱性蛋白酶和中性蛋白酶添加质量比为1∶2,复合酶添加量8 000 U/g,酶解温度45℃,酶解pH 8.0,底物浓度 4%,考察酶解时间分别为 0.5、1、1.5、2、2.5 h时对核桃多肽体外ACE抑制活性的影响,结果如图7所示。
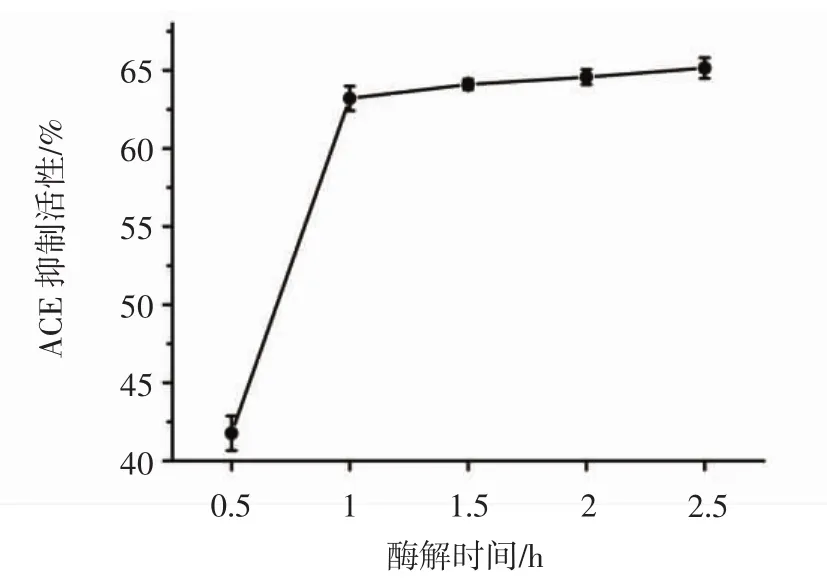
图7 酶解时间对核桃多肽的ACE抑制活性的影响Fig.7 Effect of treatment time on ACE inhibitory activity of walnut polypeptides
当酶解时间低于1 h时,核桃多肽的ACE抑制活性随酶解时间的增加迅速升高,ACE抑制活性达到(63.21±0.55)%;当酶解时间大于1 h时,核桃多肽的ACE抑制活性增长减缓,延长酶解时间也不能显著提高ACE抑制活性。可能由于酶解反应刚开始时,酶解产物主要是ACE抑制活性不高的大分子蛋白质,随着酶解时间的延长,大分子蛋白质继续被酶解成具有较高的ACE抑制活性的小分子短肽,当酶解时间达到一定值时,底物被分解完全,产物ACE抑制活性的增幅就变小。因此选择1 h作为制备核桃ACE抑制肽的最佳酶解时间。
2.3 正交试验结果
在单因素试验结果的基础上,按照表2进行正交试验,试验结果见表4。
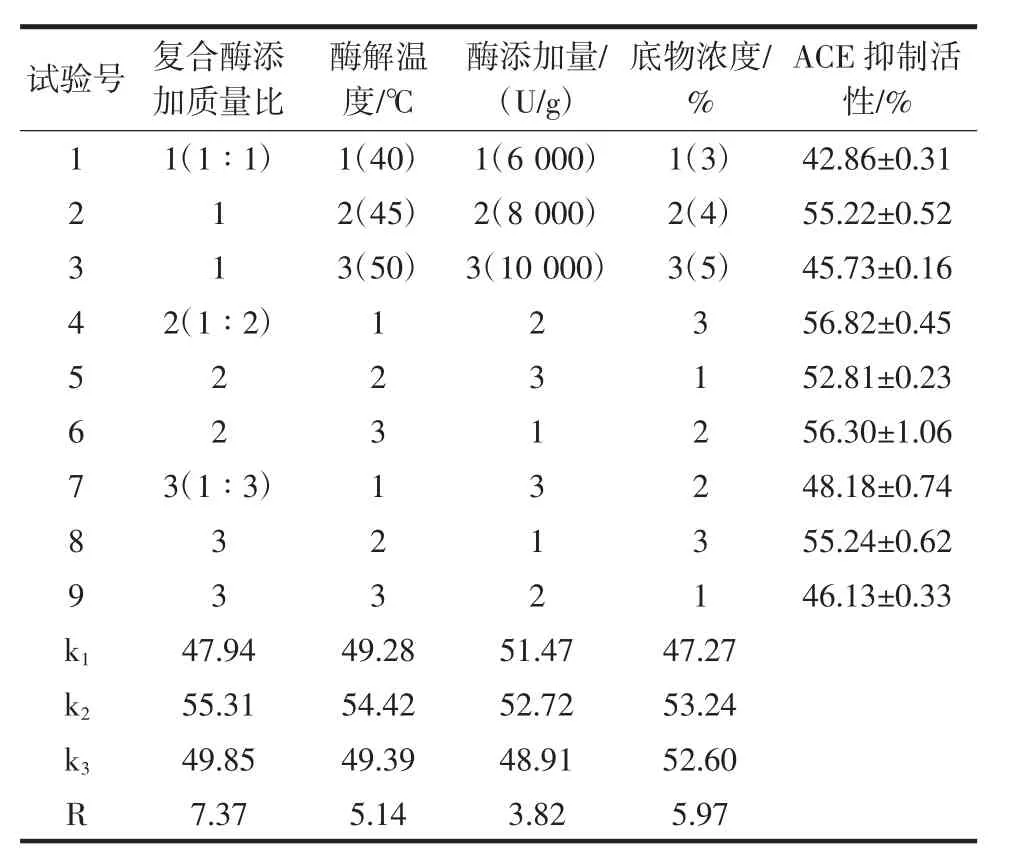
表4 正交试验结果表Table 4 Results of orthogonal test
由表4中极差R值可知,复合酶解核桃蛋白制备ACE抑制肽工艺中各因素影响大小顺序为复合酶添加质量比>底物浓度>酶解温度>酶添加量,且确定最佳工艺条件为复合酶添加质量比1∶2、底物浓度4%、酶解温度45℃、酶添加量8 000U/g。通过软件分析得到预测最佳工艺条件下产品ACE抑制活性结果为62.60%。验证性试验得到3次平行结果为(63.42±0.70)%,与预测结果基本一致,即本正交试验结果可靠。
2.4 核桃降血压肽的性质分析
2.4.1 核桃多肽ACE抑制活性的比较
将最优工艺条件下制备得到的ACE抑制肽与由4种不同工艺参数酶解得到的核桃多肽样品进行比较(样品1、2原料为核桃蛋白,样品3、4原料为核桃乳清),结果见表5。

表5 核桃多肽产品ACE抑制活性的比较Table 5 Comparison of ACE inhibitory activity of five walnut polypeptides
本试验优化参数得到的样品ACE抑制活性[(63.42±0.70)%]高于其余4个样品,但与样品1的ACE抑制活性不存在显著性差异(p>0.05)。与复合酶水解样品以及样品1、2相比,样品3和样品4的ACE抑制活性差异极显著(p<0.05),说明酶解核桃蛋白制备得到的多肽相较于酶解核桃乳清制备得到的多肽具有更高的ACE抑制活性。样品的IC50值也显示了复合酶解制备得到的核桃多肽活性[(0.838±0.015)mg/mL]显著高于和的样品3[(1.189±0.052)mg/mL]、样品4[(2.208±0.061)mg/mL]的ACE抑制活性。
2.4.2 核桃降血压肽相对分子质量测定结果
凝胶渗透色谱法测定核桃多肽产品的相对分子质量分布,结果见表6。

表6 核桃多肽的分子量分布Table 6 Molecular weight distribution of five walnut polypeptides
多肽样品的相对分子质量均小于5 kDa,且主要集中在0~2 kDa范围内。利用SPSS软件将表5的结果与表6的结果进行比较可得,相对分子质量500 Da~1 000 Da范围的产品与ACE抑制活性存在极强正相关性,皮尔森系数为0.979;相对分子质量0~180 Da范围的产品与ACE抑制活性存在极强负相关性,皮尔森系数为-0.985。Oshima等[15]报道分子量小于1 500 Da的小分子肽段表现出高ACE抑制活性。而周慧江等[16]利用超滤膜分离不同分子量的核桃多肽,发现相对分子质量在1 kDa以下的核桃多肽具有较高的降血压活性。本试验结果均与已有报道一致。根据结果还可推测,高活性降血压肽的分子量在500 Da~1 000 Da范围,而相对分子质量在0~180 Da范围的产品对降血压活性贡献作用小或无作用。
2.4.3 核桃降血压肽常温储存稳定性分析
核桃蛋白及其酶解多肽的常温储存吸湿性结果见图8。

图8 吸湿性测定结果Fig.8 Results of hygroscopicity determination
从图8中可以看出,5个多肽样品均具有较强的吸湿性,且显著高于核桃蛋白。5种多肽产品的吸湿性在0~12 h间均呈先迅速上升后缓慢下降至一定值的趋势,并在5 h~6 h达到最高值,均超过14%。除样品1外,其余4种多肽的吸湿性差异不显著。核桃多肽产品的吸湿性显著高于核桃蛋白的吸湿性,其原因为在核桃蛋白酶解后,生成的多肽中含大量亲水基团,易与空气中的水分结合[17]。产品吸湿性在超过6 h后缓慢下降达到稳定的原因可能为多肽吸水饱和后需与大气湿度不断平衡。
5种核桃多肽产品在常温储存过程中体外ACE抑制活性的变化趋势见图9。
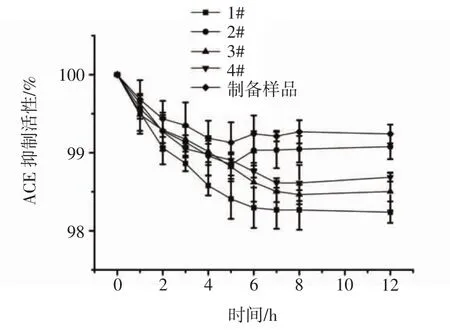
图9 核桃多肽的常温储存稳定性结果Fig.9 Storage stability of walnut polypeptides at room temperature
相对ACE抑制活性整体均呈先下降后保持稳定的趋势,基本在5 h~6 h达到平稳状态,与吸湿性曲线具有一定的相似性。室温25℃储存12h后,产品的ACE抑制活性均有所降低,但降幅不大,仍保留有98%以上的活性,说明产品活性较稳定。其中,自制样品的稳定性较好,整体降幅最小,不到1%;1号样品的稳定性较差,整体降幅最大。可能是多肽产品暴露在空气中发生氧化反应或吸水后发生水解反应,造成核桃多肽的结构发生改变,从而引起活性的降低。
2.4.4 核桃降血压肽体外消化稳定性分析
核桃ACE抑制肽产品经口服或注射后进入体内,可能会被胃蛋白酶、胰蛋白酶等肠道消化酶降解从而结构发生变化,造成活性的改变。本试验利用人工胃液和肠液简单模拟体内消化过程,研究核桃多肽经体外消化前后其ACE抑制活性变化,结果见图10。
各样品消化前后的ACE抑制活性均存在显著性差异(p<0.05),其中试验制备样品和样品3、样品4经体外消化后ACE抑制活性有所提高,而1号样品和2号样品经体外消化后ACE抑制活性有所下降。将该结果与相对分子质量测定结果比较分析,制备样品、样品3、样品4经消化后ACE抑制活性升高,可能是相对分子质量大于1 kDa的多肽被降解,相对分子质量500 Da~1 000 Da范围内的多肽含量增加。样品1和样品2经消化后ACE抑制活性降低,可能是样品被水解后相对分子质量小于180 Da的短肽或游离氨基酸的含量增加。总体上看,各样品经体外消化后ACE抑制活性稳定,可能具有良好的体内降血压活性。
3 结论
试验以核桃粕蛋白为原料,在考察6种单一酶水解效果的基础上,选择中性蛋白酶和碱性蛋白酶作为复合酶,通过单因素试验和正交试验发现各因素对核桃多肽ACE抑制活性的影响大小依次为复合酶添加质量比>底物浓度>酶解温度>酶添加量。酶解核桃蛋白最佳工艺条件为:复合酶添加质量比1∶2(碱性蛋白酶:中性蛋白酶)、底物浓度4%、酶解温度45℃、pH 8.0、酶添加量8000 U/g、酶解时间60 min。该条件下制备获得的降血压肽ACE抑制活性为(63.42±0.70)%,IC50值为(0.838±0.015)mg/mL。多肽样品相对分子质量主要在0~2 kDa范围内,相对分子质量在500 Da~1 000 Da范围的多肽具有高ACE抑制活性,而相对分子质量在0~180 Da范围的产品对降血压活性贡献作用小或无作用。最佳参数制备得到的核桃多肽在室温(25℃)储存过程中活性较稳定,并具有良好的体外消化稳定性,为产品的工业化生产与实际应用提供理论基础。

