多溴联苯醚与人血清白蛋白相互作用的表面等离子体共振及分子对接
张爱芹,王 嫚,申刚义,金 军
(1.中央民族大学生命与环境科学学院,2.中央民族大学药学院,北京100081)
多溴联苯醚(PBDEs)类溴代阻燃剂由于蒸汽压低、亲脂性强,能通过远距离迁移和生物蓄积进入人体产生多种毒副作用及致癌性,已成为威胁生态环境和人类健康的全球性环境污染物[1~3]. PBDEs主要通过皮肤接触、呼吸、饮水和食物等多种途径进入生物体并产生对疾病相关通路的干扰,是其产生健康危害的起点[4]. 目前,对PBDEs与受体蛋白以及遗传物质等生物分子的交互作用机制的认识仍不足,难以揭示其在生物体内导致毒性效应并与特定疾病表型相关联的途径及机制. 探明PBDEs在体内暴露水平、分布及其对毒性作用通路的扰动机制已成为探索环境暴露与健康危害因果联系的关键问题.
人血清白蛋白(HSA)作为血浆中含量最丰富的蛋白质,是污染物在人体血液中的主要转运媒介[5]. 污染物进入人体后与HSA 形成复合物,继而被转运到受体部位或靶器官而产生生理毒理作用.研究PBDEs 与HSA的相互作用对深入了解污染物的致毒机制具有重要意义[6,7]. 研究者们利用光谱和计算机模拟对PBDEs与HSA相互作用的热力学机制进行了研究[8~11]. 然而,在对于揭示污染物体内蓄积、分布、代谢等过程中起关键作用的污染物-蛋白相互作用的动力学速率、强弱等机制方面尚未明确,系统探究不同取代基个数和位置的PBDEs与HSA相互作用的差异及规律,对从分子结构层次理解PBDEs的毒理学机制具有重要意义.
表面等离子体共振技术(SPR)是一种免标记型光学生物传感方法,在研究生物分子相互作用方面具有独特优势[12]. 其具有微量化、高灵敏、通用性好及实时快速等优点,还可同时获得相互作用过程的动力学和热力学信息,便于在模拟生理条件下探究分子相互作用的整个过程[13,14]. 本文以HSA为受体模型,以8 种典型PBDEs 同族体(BDE28,BDE47,BDE99,BDE100,BDE153,BDE154,BDE183,BDE209)为分析对象,利用SPR技术在模拟生理条件下实时动态研究了它们之间的相互作用;结合计算机辅助分子对接模拟,从理论角度探讨了两者的相互作用机制,并与实验结果相互验证. 基于HSA建立的研究方法和模型,将适用于PBDEs与脂蛋白或受体蛋白相互作用的研究.
1 实验部分
1.1 试剂与仪器
GLH传感芯片和偶联试剂盒[N-羟基硫代琥珀酰亚胺(Sulfo-NHS)、N-乙基-N′-(二甲氨基丙基)碳二亚胺(EDC)和1.0 mol/L 盐酸乙醇胺(pH=8.5)均为分析纯]购自美国BioRad 公司;HSA(纯度≥96.0%)购自美国Sigma 公司;8 种PBDEs 标准品(BDE28,BDE47,BDE99,BDE100,BDE153,BDE154,BDE183,BDE209)购自美国Accustandard 公司;二甲基亚砜(DMSO)、吐温20、Na3PO4、NaCl、HCl和醋酸均为分析纯,购自北京化学试剂公司.
ProtenOn XPR36生物分子相互作用系统(美国BioRad公司);PB-10 型pH计(德国Sartorius公司);XP205型分析天平(瑞士Mettler Toledo公司);Milli-Q纯水系统(美国Millipore公司);Mini离心机(北京昊诺斯公司).
1.2 实验过程
1.2.1 样品的配制 固定蛋白运行缓冲液(PBST)为含150 mmol/L NaCl 和0.005%(体积分数)吐温20的10 mmol/L Na3PO4溶液(pH=7.4);相互作用运行缓冲液(PBSTD)为含5%(体积分数)DMSO的PBST.
将各分析物溶于DMSO中形成母液,用PBSTD稀释至20 μmol/L(BDE-209为100 μmol/L),再依次按3倍倍比稀释4次得5组浓度梯度(0.25,0.74,2.22,6.67,20 μmol/L),另设一个PBSTD作空白对照,组成6组梯度浓度. 所有溶液使用前均经0.22 μm微孔滤膜过滤.
1.2.2 HSA芯片的固定 蛋白固定采用氨基偶联法:25 ℃下,将0.1 mol/L Sulfo-NHS和0.4 mol/L EDC 1∶1(体积比)混合并流过芯片通道,流速25 μL/min,时间360 s;将0.68 mg/mL 的HSA 醋酸缓冲溶液(pH=4.5)以相同流速流过芯片通道,与芯片上活化的羧基反应,时间360 s;盐酸乙醇胺以相同流速流过芯片通道,时间360 s;通入PBST去除非特异性吸附. 同时设置第2个通道作为对照通道(只活化封闭而不固定蛋白).
1.2.3 PBDEs与HSA相互作用的动态测试 在25 ℃下,同一分析物的6组梯度浓度以25 μL/min流速垂直流过固定蛋白通道并与HSA作用,实时监测采集信号. 相互作用的结合时间为240 s,解离360 s.
1.2.4 数据处理 采用双参比和体积排除法,扣除空白通道和空白溶液的背景信号和溶剂效应. 利用ProtenOn Manager 2.1.2软件进行数据分析处理.
1.2.5 PBDEs 与HSA 的分子对接模拟 采用AutoDock[15,16]对PBDEs 与HSA 的对接进行模拟,采用AutoDockTools[17]和PyMOL[18,19]进 行 对 接 结 果 展 示 和 分 析. HSA 晶 体 结 构(PDB ID:1AO6)取 自Brookhaven蛋白质数据库[20],PBDEs取自小分子数据库[21]. 每种PBDE与HSA随机100次分子对接,对能量的优化采用拉马克遗传算法(LGA),选取得分权重最高构象作为最终对接结果. 通过结合自由能(ΔG)对PBDEs与HSA的作用进行评价.
2 结果与讨论
2.1 PBDEs与HSA相互作用的动力学分析
将HSA作为受体,其固定量大小对相互作用有直接影响. 图1给出了HSA在芯片表面实时固定的动态过程,其结合速率很快,50 s内即达到平衡,最终标记量为22000 RU(22 kRU),表明HSA在芯片表面的固定量约为22 ng/mm2[22],适合与小分子相互作用研究.
图2为8种PBDEs与HSA实时相互作用的动力学传感图,示出了结合和解离的整个动态过程. 在结合起始阶段,分析物浓度越高则复合物越多,当反应达到平衡时响应值不再增加. 而在解离阶段,复合物分解同时响应值降低,复合物浓度越高解离越多.
依据Langmuir模型,分析物与HSA的作用遵循准一级反应:

Fig.1 Immobilization of HSA on the surface of a sensor chip at 25 ℃

Fig.2 Real⁃time sensorgrams of kinetic analysis of the interactions between PBDEs and HSA at 25 ℃

式中:A为分析物;B为芯片上固定的HSA;A-B为芯片上生成的复合物;ka(L·mol−1·s−1)为结合速率常数;kd(s−1)为解离速率常数.
结合阶段动力学方程为

式中:[A-B](mol/L)为反应时间t(s)时芯片上复合物的浓度,对应于t时的响应值;[A](mol/L)为分析物浓度;[B](mol/L)为反应时间t时芯片表面未被结合蛋白的浓度,定义如下:

式中:[A-B]max为芯片上A与B结合达到饱和时复合物的浓度,对应最大响应值Rmax.
将式(3)带入式(2)得:

对动力学曲线进行平滑拟合(图2平滑曲线)并结合上述公式,可计算相互作用过程的各动力学参数(见表1).ka和kd反映了分析物与HSA 相互作用动力学结合和解离速率的快慢.KD可反映结合力或亲和力的大小,KD越小亲和力越大.
通过比较可见,BDE209与HSA相互作用的动力学过程[图2(H)]与其它PBDEs 有明显差异. 在结合阶段,ka(0.30×103)明显小于其它化合物,生成的复合物量较少. 解离阶段kd(0.98×10−2)也明显减慢,复合物较难解离,解离时间结束时(360 s)尚未完全解离.受动力学结合速率和解离速率共同影响,其亲和力明显小于除BDE28外的其它6种(表1).
实验发现,PBDEs中溴原子个数及取代位置的差异对相互作用有规律性的影响. 首先,随溴原子个数增加(从BDE28,BDE47,BDE 99,BDE 153 到BDE 183,依次为三溴至七溴)相互作用的解离速率逐渐减慢,亲和力依次增大. 表明溴原子个数增加有利于PBDEs 与HSA 的相互作用. 基于动力学分析,显示可能与溴原子个数增加减缓了复合物的解离速率有关.
其次,对溴原子不同取代位置的同分异构体比较发现,间位溴的BDE99与HSA的ka(5.77×103)明显大于邻位溴的BDE100(ka=1.14×103). 前者达到结合平衡所需时间[图2(C),约30 s]远快于后者[图2(D),约100 s]. 在解离阶段,BDE99的kd(3.92×10−2)大于BDE100(kd=1.76×10−2). 由于结合速率差异更大,BDE99 与HSA 的亲和力(KD=0.68×10−5)大于BDE100(KD=1.54×10−5)的. 同样,PBDE153(间位溴)与HSA的亲和力也大于BDE154(邻位溴)的. 表明在PBDEs的同分异构体中,间位溴比邻位溴利于PBDEs与HSA的相互作用. 动力学分析显示这种差异可能源自结合速率快慢的影响.
2.2 PBDEs与HSA相互作用的稳态分析
稳态为结合反应达到平衡时的状态,可根据反应平衡分析PBDEs与HSA相互作用的亲和力.
根据式(1),稳态时复合物形成与解离的速率相等:

其中,[A]eq和[B]eq分别为平衡时分析物浓度和芯片表面未被结合的蛋白浓度;[A-B]eq为平衡时复合物的浓度,对应平衡时的响应值.
将式(7)代入式(5)可得:

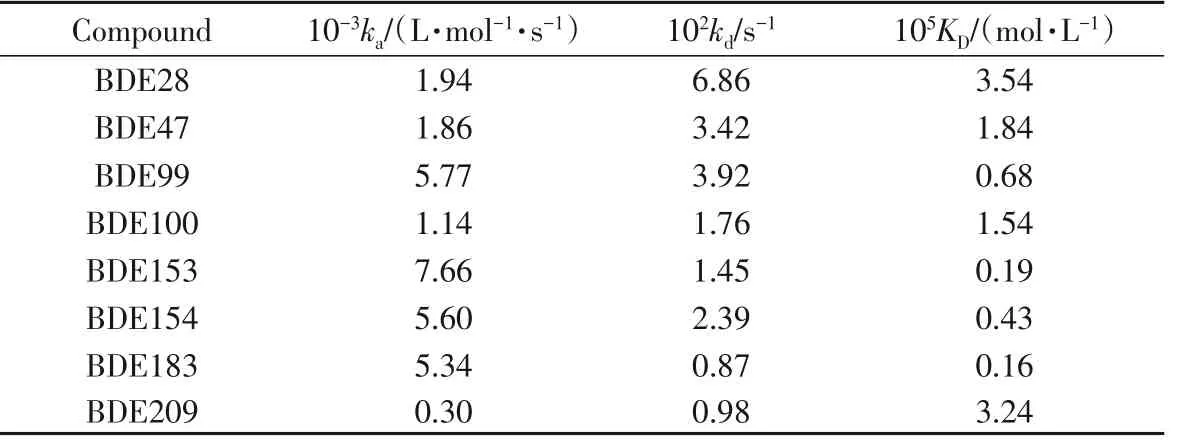
Table 1 Kinetic parameters of interactions between PBDEs and HSA
由于[B]eq=[A-B]max−[A-B]eq,代入式(8)可得:

当[A]eq=KD时:

即KD等于最大复合物浓度一半对应的分析物浓度,等同米氏常数KM. 将每种分析物的6个浓度梯度与平衡时的响应值作图,拟合后计算结果列于表2. 其中,Rmax为最大响应值,Chi2为评估曲线拟合的卡方值. 可见,稳态分析的亲和力数据和动力学数据(表1)基本一致(线性相关系数R2=0.945),验证了该方法的可靠性.

Table 2 Affinity parameters of interactions between PBDEs and HSA based on the steady state analysis
2.3 PBDEs与HSA分子对接模拟
利用分子对接技术从微观角度分析了PBDEs 与HSA 的作用模式和结合位点. 外源性物质与HSA的结合位点主要位于Site I(IIA)和Site II(IIIA)[23,24]. 分子对接结果显示,8 种PBDEs 均结合于HSA 的Site I处,与文献[25]报道一致,并且它们主要位于由Leu,Trp,Ile,Phe,Val和Tyr等多种疏水性氨基酸残基构成的疏水空腔内. 图3 显示了3 种PBDEs(BDE28,BDE154 和BDE183)与HSA 的分子对接三维图. 可见,PBDEs虽然都位于Site I处,但它们的最佳构象不同,其在空腔中存在不同的平动转动等方式,空腔功能区周边的氨基酸活性位点存在差异,因此分子间疏水力、范德华力、氢键以及静电力等相互作用力不同,综合导致它们与HSA结合力不同.
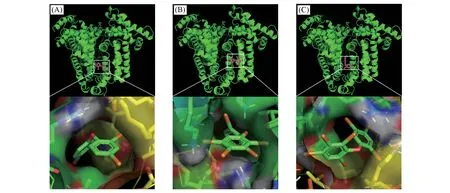
Fig.3 3D molecular docking images of BDE28(A),BDE154(B),BDE183(C)and HSA at 25 ℃
进一步分析了8种PBDEs与HSA分子对接最佳构象的各种热力学参数(表3),发现范德华力和氢键作用力对结合能的贡献远大于静电力. 比较可发现,PBDEs结构中溴原子的个数及取代位置的差异会使其与HSA的结合能有明显差异. 除BDE209外,范德华力和氢键作用力及结合能均随溴原子的增加依次增强,与实验亲和力(表1)和文献[11]趋势相同,这可能是由于溴原子的引入能促进分子间作用力增强. 而对于同分异构体,间位溴取代的BDE99比邻位溴取代的BDE100具有更大的范德华力和氢键作用力,同时静电引力也要略大于邻位,从而使间位溴取代的BDE99 与HSA 的结合能(−ΔG=33.23 kJ/mol)大于邻位溴的BDE100(−ΔG=32.14 kJ/mol). 类似地,间位溴BDE153(−ΔG=35.53 kJ/mol)也大于邻位溴BDE154(−ΔG=34.40 kJ/mol). 与实验结果趋势相同. 这可能是位于醚键的邻位溴取代相比于间位溴取代增强了分子的刚性而降低了其柔性,产生了更大的位阻效应,限制了其结合的最佳结合构象,从而使其与周边氨基酸残基作用力减弱. 而对于BDE209,虽然溴原子的增加有利于与HSA结合,但其分子中围绕着醚键共有4个邻位溴,刚性大柔性小,空间位阻显著增大,大大阻碍了与HSA的结合,致使亲和力变小. 而BDE209与HSA的亲和力大于BDE28可能是溴原子个数和取代位置综合作用的结果. 分子对接结果与利用SPR测定PBDEs与HSA相互作用的实验结论一致.

Table 3 Theoretical and experimental thermodynamic parameters of the interactions between PBDEs and HSA
根据−RTlnKA=ΔG和KA=1/KD,可得实验中PBDEs和HSA相互作用的热力学参数吉布斯自由能ΔG.从表3 可见,无论是实验还是理论计算结果,各PBDEs 和HSA 相互作用的ΔG均小于0,表明它们与HSA的反应可自发进行. 实验ΔG值小于理论值,数据间有较好的相关性(R2=0.784),显示两种方法具有较好的一致性.
3 结 论
采用SPR和分子对接技术分析了8种PBDEs与HSA 的相互作用. 利用SPR技术不仅可通过动态曲线直观揭示不同PBDEs与HSA的相互作用,还可获得相互作用过程的动力学和热力学参数. 实验结果表明,PBDEs中溴原子的个数和取代位置对PBDEs与HSA作用有规律性的影响. 动力学分析显示同分异构体结合力的差异可能主要源自结合速率的快慢. 分子对接结果显示,8种PBDEs在HSA结合位点Site I处周边功能区的氨基酸残基类型存在差异. 范德华力和氢键在结合能的贡献大于静电力. 实验热力学参数和计算模拟相互印证. 本研究基于HSA建立的方法同样适用于PBDEs 与脂蛋白或受体蛋白等,为探索污染物与人体内生物大分子蛋白的相互作用提供了技术途径.

