人附睾蛋白在大肠杆菌中的表达、纯化及鉴定
王 翠,王云龙 ,谢南昌,王梦露,李玉林,明 亮
1)郑州大学第一附属医院检验科 郑州 450052 2)河南省检验医学重点实验室 郑州 450052 3)河南省生物工程技术研究中心 郑州 450046 4)郑州大学第一附属医院神经内科 郑州 450052 5)鹤壁职业技术学院护理学院 河南鹤壁 458030
人附睾蛋白4(human epididymis protein 4,HE4)为WFDC2基因编码产物,由124个氨基酸组成,可以被糖基化修饰成一个相对分子质量25 000的分泌性糖蛋白[1-2]。HE4基因最初从人附睾远端上皮细胞分离获得[1],随后发现在卵巢癌、肺癌、乳腺癌等肿瘤中高表达。HE4可辅助相关疾病的早期诊断、复发转移及预后判断,并有望成为相关肿瘤治疗的新靶点[3-4]。作为一种日益成熟的肿瘤标志物,HE4血清学水平对肿瘤诊断的特异性和敏感性均较高[5-6]。本研究选用pET32a载体,表达并纯化得到HE4蛋白,为HE4相关检测试剂的研发奠定基础。
1 材料与方法
1.1主要试剂DNA Marker、DNA聚合酶(TIANGEN公司),蛋白Marker、T4 DNA连接酶、EcoR Ⅰ、NotⅠ(TaKaRa公司),HE4抗体(Abcam公司),其他试剂均为国产分析纯。
1.2质粒与工程菌大肠杆菌DH5α、BL21(DE3)及质粒pET32a(+)由河南省生物工程技术研究中心提供。
1.3HE4引物上游序列:5’-ATGGAGAAGACGGGTGTATG-3’;下游:5’-TTAAAAATTCGGGGT CACGC-3’。
1.4HE4基因序列优化拟合成编码HE4蛋白第31~124位氨基酸基因序列。参照大肠杆菌遗传密码子频率表,通过密码子优化软件,在不改变拟合成HE4氨基酸序列情况下选择大肠杆菌偏爱密码子,并对拟合成HE4基因的GC含量进行优化以延长mRNA半衰期。优化后基因序列送上海生工生物工程股份有限公司进行基因合成并连接至pMD18-T,标记为pMD18-T-HE4。
1.5重组表达菌BL21-pET32-HE4的构建及鉴定将质粒pMD18-T-HE4和pET32a(+)分别进行EcoRⅠ、NotⅠ双酶切,采用琼脂糖凝胶电泳及胶回收分别获得酶切后的HE4和pET32a片段,并用T4 DNA连接酶连接。将连接产物pET32-HE4转化至BL21(DE3)感受态细胞中,涂布LB(含Amp)培养板上,37 ℃培养约12 h。阳性克隆BL21-pET32-HE4用菌落PCR及EcoRⅠ、NotⅠ双酶切鉴定。选取构建正确的菌样送上海生工生物工程有限公司测序鉴定。
1.6HE4蛋白的表达、抗原性分析及纯化将BL21-pET32-HE4菌、BL21菌及转入pET32a(+)空质粒的BL21-pET32菌同时进行IPTG诱导表达。选择IPTG工作浓度为1 mmol/L,37 ℃条件下180 r/min振荡培养4 h,3 000 r/min离心4 min,收集诱导后菌体,SDS-PAGE检测HE4蛋白表达情况。将诱导离心后收集的BL21-pET32-HE4菌用200 μL 的PBS ( 0.02 mol/L,pH 7.4 ) 重悬并超声破碎,12 000 r/min离心5 min,分别收集菌体沉淀及上清,200 μL的PBS(0.02 mol/L,pH 7.4)重悬菌体沉淀,SDS-PAGE检测HE4蛋白在菌液上清和沉淀中表达情况,Western blot 检测HE4蛋白的抗原性。另外,选择工作浓度0.1 mmol/L、0.2 mmol/L、0.5 mmol/L的IPTG,分别在37 ℃诱导3、4、5 、6和7 h时取样,SDS-PAGE确定HE4蛋白最佳的诱导条件,应用镍离子亲和层析法[6]纯化HE4蛋白。
2 结果
2.1HE4基因序列优化合成通过GenBank及DNAMAN6.0查询比对分析,最终确定合成编码人HE4蛋白第31~124位氨基酸基因序列,该序列包含两个WAP结构域。参照大肠杆菌遗传密码子频率表对HE4基因密码子及GC含量进行了优化,最终合成HE4基因序列长大小为288 bp,编码96个氨基酸,密码子适应度值(CAI)从0.59上升到0.84,GC含量从60%降至54%。测序结果显示质粒pMD18-T-HE4构建成功。
2.2重组菌BL21-pET32-HE4的构建及鉴定将pET32a(+)和HE4基因进行连接并转化BL21(DE3)菌,阳性克隆鉴定结果见图1、2。菌落PCR扩增出约288 bp的目的片段。质粒pET32-HE4双酶切后可见一条约288 bp的目的片段和一条载体片段。经测序,重组菌BL21-pET32-HE4中HE4基因序列大小为288 bp,读码框正确。
2.3HE4蛋白的表达及抗原性分析BL21-pET32-HE4菌在约30 000左右有特异表达的蛋白,与目的蛋白的相对分子质量一致(图3)。蛋白大部分为可溶性表达(图4)。该蛋白能够与HE4抗体特异结合,表明其具有HE4抗原性(图5)。
2.4HE4蛋白表达条件的优化SDS-PAGE结果(图6)显示:IPTG的工作浓度为0.1 mmol/L,诱导时间延长HE4蛋白的表达量没有明显改变;IPTG的工作浓度分别为0.2、0.5 mmol/L时HE4蛋白的表达量较大,按照节约成本原则,最终选择HE4蛋白的诱导条件是工作浓度为0.2 mmol/L的IPTG,诱导温度37 ℃,诱导时间3 h。

1:HE4基因;2:DNA Marker

1:pET32-HE4双酶切;2:DNA Marker

1:BL21菌;2~3:BL21-pET32-HE4重组菌;4:蛋白质Marker;5:BL21-pET32菌
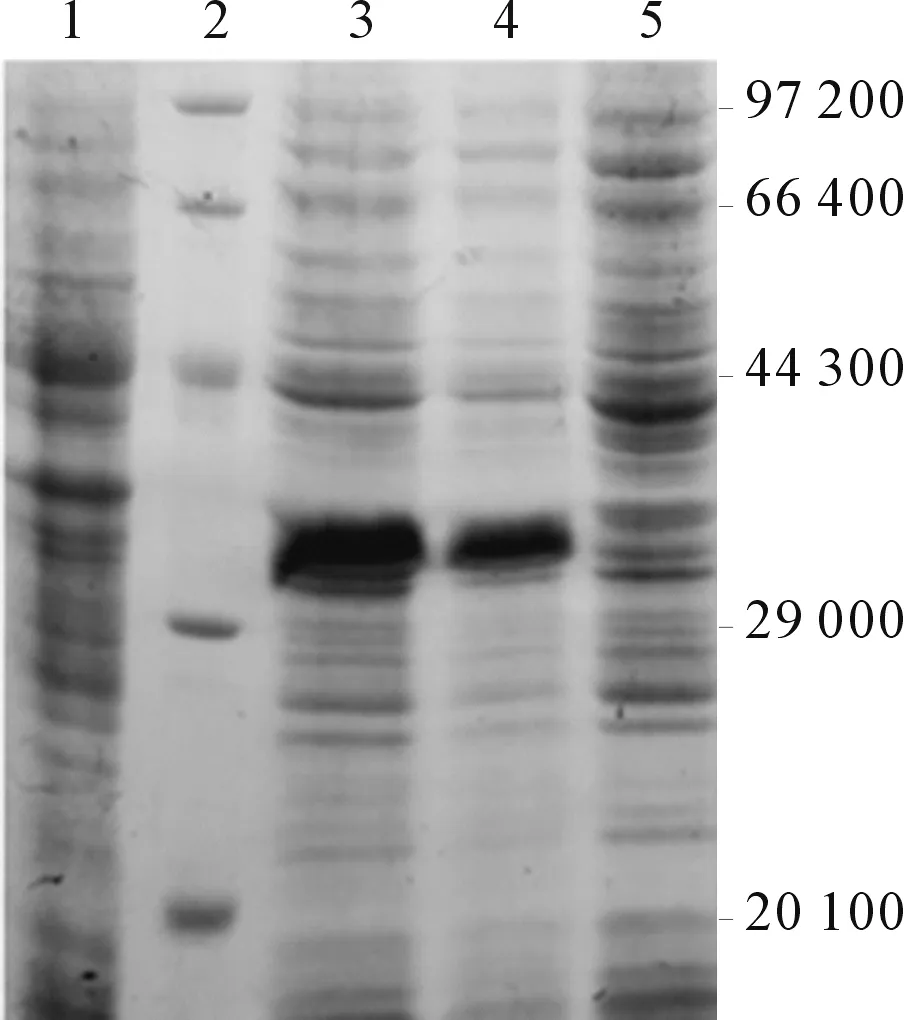
1:BL21菌;2:蛋白质Marker;3~4:BL21-pET32-HE4重组菌上清;5:BL21-pET32-HE4重组菌沉淀

1:BL21-pET32菌;2:BL21-pET32-HE4重组菌上清

上图示1:蛋白质Marker;2:BL21菌;3:BL21-pET32菌;4~8:IPTG 0.1 mmol/L,3~7 h ;9~10:IPTG 0.2 mmol/L,3~4 h;下图示1:蛋白质Marker;2~4:IPTG 0.2 mmol/L,5~7 h;5~9:IPTG 0.5 mmol/L,3~7 h
2.5HE4表达蛋白纯化HE4蛋白的纯化结果(图7)显示:20 mmol/L咪唑下洗脱的主要为杂蛋白,50 mmol/L咪唑下洗脱的蛋白相比纯度较高且量大,80 mmol/L及100 mmol/L咪唑下洗脱的蛋白纯度较高,但含量相对较少。
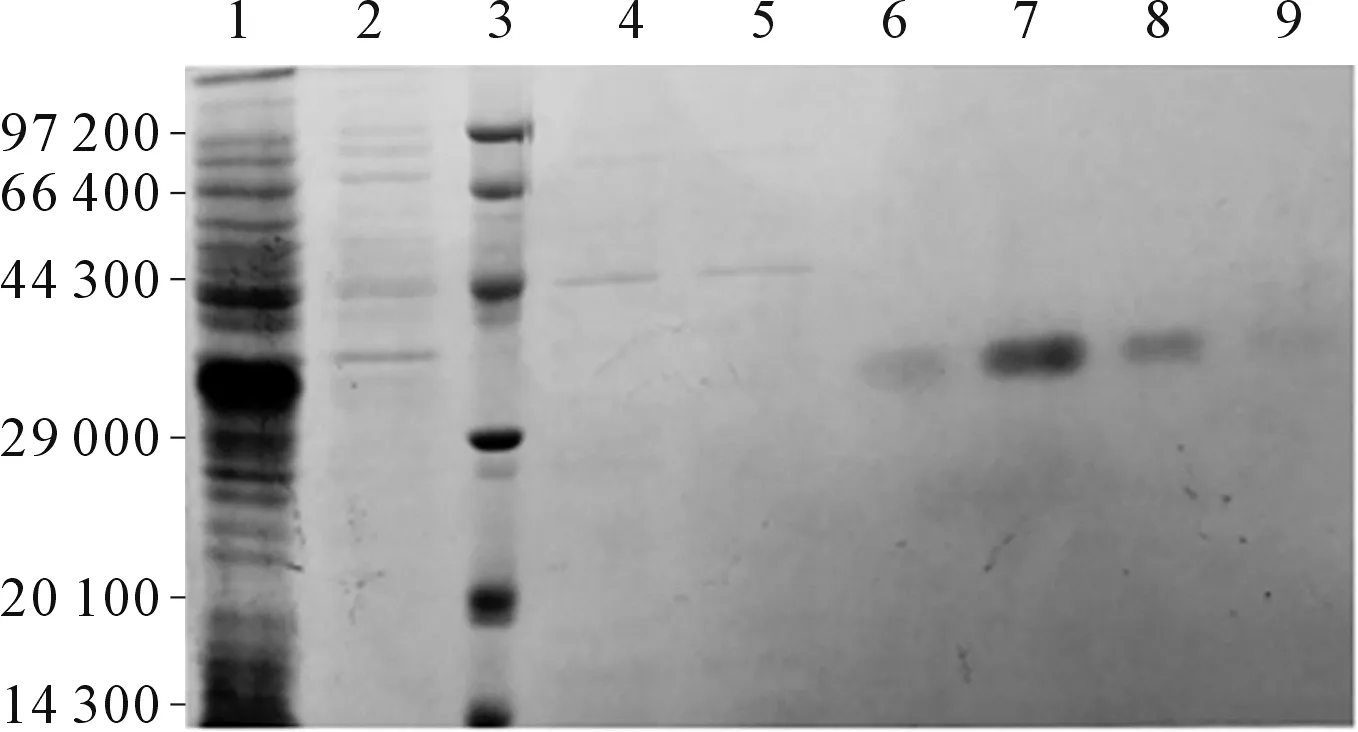
1:BL21-pET32-HE4重组菌上清;2:上样流出液;3:蛋白质Marker;4~5:20 mmol/L咪唑洗脱;6~7:50 mmol/L咪唑洗脱; 8:80 mmol/L咪唑洗脱;9:100 mmol/L咪唑洗脱
3 讨论
HE4蛋白是HE4诊断试剂中一种重要的原材料,其大量制备将为HE4诊断产品的研发奠定基础。目前国内商品化的HE4试剂种类较少,成本相对较高,成为阻碍HE4用于临床相关疾病筛查的重要原因。
许多外源的蛋白都采用大肠杆菌原核表达系统来进行表达,因其具有遗传图谱清晰、对许多蛋白质的耐受力强、培养条件简单并且费用低等优点[7],通过有效诱导可使目的蛋白表达量占总蛋白量的60%~70%[8]。本实验亦选择大肠杆菌原核表达系统来表达HE4蛋白。密码子的选择优化会影响外源蛋白在大肠杆菌中的表达情况,表达外源的蛋白需要考虑密码子的偏爱性[9-11]。在进行HE4蛋白表达时,我们曾尝试直接从人细胞株中调取HE4基因全长进行蛋白表达,但是由于一些编码HE4基因的密码子不属于大肠杆菌的优选密码子,在完成载体构建后没有正常诱导目的蛋白的表达。因此,后期我们通过密码子优化软件对HE4基因密码子进行了优化,最终合成HE4基因序列长288 bp,编码96个氨基酸,CAI从0.59上升到0.84,GC含量从60%降至54%,优化后的序列能够被大肠杆菌识别翻译,蛋白得以顺利表达,且产量较高,这为下步实验的顺利开展打下了基础。
本研究优化获得了HE4蛋白表达条件:IPTG 的工作浓度为0.2 mmol/L,诱导温度为37 ℃,诱导时间为3 h。本研究实现了HE4蛋白的可溶性高表达并采用镍离子亲和层析法纯化获得了HE4蛋白。本研究表达获得的HE4蛋白相对分子质量约为11 000,而在血清样本中天然存在的HE4分子量约为25 000,这主要是因为人体内的HE4蛋白在合成后经过了糖基化修饰[2]。HE4蛋白在相关肿瘤的诊断上具有较好的前景,本研究为HE4相关检测试剂盒的建立奠定了良好的基础。
——一道江苏高考题的奥秘解读和拓展

