HPLC和UV法对比测定蚊不叮霜中VB1的含量
朱家航,李 艳,朱金芳,梁嘉培,巴饿江·努哈依甫
(1.新疆农业大学,乌鲁木齐 830052;2.新疆银朵兰维药股份有限公司,乌鲁木齐 830000)
0 引 言
【研究意义】维生素B1又称硫胺素,分子式为C12H17ClN4OS·HCl,属于水溶性维生素B族中的一种,是维持机体正常代谢及功能不可或缺的一类低分子化合物,对神经系统起到保护作用。其在酸性溶液中很稳定,在碱性溶液中不稳定,易被氧化而分解变质,光、热对其影响较大,故应置于遮光、凉处保存[1-2]。建立UV和HPLC法测定蚊不叮霜中维生素B1含量的方法,对蚊不叮霜中维生素B1含量测定有实际意义。【前人研究进展】由于分子中存在共轭双键结构,因此,在紫外区有吸收峰,最大吸收波长为246 nm,对应的百分吸收系数为421。李艳霞等[3]研究发现在NaOH介质中,维生素B1可将 K3[Fe(CN)4]定量还原为K4[Fe(CN)4]与 Fe3+发生反应生成可溶性普鲁士蓝,由此建立了铁氰化钾分光光度法间接测定维生素B1的含量。王瑞勇等[4]基于在酸性条件下,柠檬酸钠将氯金酸还原成纳米金后可与维生素B1发生相互作用,纳米金发生凝聚,其最大吸收峰产生了红移,建立了比色测定法测定维生素B1的含量,成功定量分析了片剂和注射液中的维生素B1。李丹凤[5]采用 HLPC 法同时测定了三维葡磷钙咀嚼片中VB1和VB2的含量。吕惠卿[6]建立了高效液相色谱-荧光检测法测定了复合维B片中VB1的含量,简便、快速、准确。韩宇等[7]以二极列管检测器(DAD)进行检测同时测定了复方氨基丁酸维E胶囊中VB1和盐酸的含量。维生素B1的含量测定方法主要有UV法[8]、HPLC法[9-14]、核磁共振法[15]、荧光分析法[16]、化学发光法[17]及毛细管电泳法[18]等。《中国药典》2015版(二部)[19]中采用UV法测定其测定维生素B1片剂及注射液中维生素B1的含量,简单、可靠。采用HPLC法检查其有关物质。【本研究切入点】近年来,针对于维生素B1的测定多集中于UV法和HPLC 法,就2种方法测定蚊不叮霜中维生素B1的含量进行对比,【拟解决的关键问题】研究对比UV法和HPLC法测定蚊不叮霜中维生素B1的含量,为蚊不叮霜中维生素B1含量测定方法的确定提供依据。
1 材料与方法
1.1 材 料
1.1.1 仪 器
高效液相色谱仪(LC-20,日本岛津公司);紫外分光光度仪(UV2550,日本岛津公司);紫外-可见分光光度计(T6新世纪,北京普析通用仪器有限责任公司);电子天平(AL204-IC,梅特勒-托利多仪器(上海)有限公司);pH计(pHS-3C,上海仪电科学仪器股份有限公司);电热恒温水浴锅(W201,上海申生科技有限公司);高速冷冻离心机(SF-GL-16A,上海非恰尔分析仪器有限公司);真空抽滤泵(VP50,武汉集思仪器设备有限公司)。
1.1.2 试 剂
蚊不叮霜(自制,规格10 g : 80 mg,批号20181225-1,20181225-2,20181225-3);维生素B1对照品(购于中国食品药品检定研究院,纯度97.9%);甲醇、乙腈、庚烷磺酸钠、磷酸、三乙胺为色谱纯,盐酸为分析纯,水为超纯水。
1.2 方 法
1.2.1 UV法测定VB1含量
1.2.1.1 溶液的配制
(1)供试品溶液
精密称取蚊不叮霜1 g(约相当于维生素B18 mg)于50 mL碘量瓶中,加入盐酸溶液约40 mL,70℃水浴加热并不断振摇10 min后,再置冰水浴(0℃)中冷却20 min,过滤至100 mL容量瓶中,按上述步骤用盐酸溶液重复提取膏体部分2次,每次约30 mL,将3次提取液合并至100 mL容量瓶中定容,摇匀。精密吸取1 mL,置于10 mL容量瓶中,用盐酸溶液稀释至刻度,即得。
(2)阴性对照溶液
精密称取不含维生素B1的蚊不叮霜阴性对照样品1 g,按“1.2.1.1”项下,供试品溶液的配制方法制备。
(3)对照品储备液
精密称取适量干燥至恒重的维生素B1对照品25 mg,置于100 mL容量瓶中,加入盐酸溶液约70 mL摇匀溶解维生素B1,加入盐酸溶液稀释至刻度,摇匀,制成0.25 mg/mL的对照品储备液,并将其放入冰箱中冷藏。
(4)对照品溶液
精密吸取对照品储备液5 mL,置于100 mL容量瓶中,用盐酸溶液稀释至刻度,摇匀,制成12.45 μg/mL的对照品溶液。
(5)盐酸溶液
盐酸溶液(0.1 mol/L):量取浓盐酸溶液9 mL,用水稀释并定容至1 000 mL,摇匀。
1.2.1.2 检测波长
取适量的对照品溶液和阴性对照溶液,在200~800 nm波长范围内进行波长扫描。
1.2.1.3 线性关系
精密吸取对照品储备液0.30、0.35、0.40、0.45、0.50、0.55、0.60 mL,分别用盐酸溶液配置成7.47、8.72、9.96、11.21、12.45、13.70、14.94 μg/mL系列浓度后,测定。
1.2.1.4 精密度
取对照品溶液适量,以溶剂为空白,在246 nm处测定吸光度值,连续测定6次,记录吸光度值。
1.2.1.5 重复性
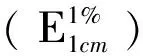
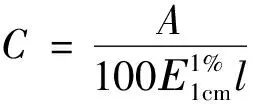
C—供试品溶液的浓度(g/mL);A—吸光度值;E:吸收系数;l—比色皿液层厚度(cm);D—稀释倍数;W—供试品的取样量(g)。
1.2.1.6 加标回收率
分别精密称取6份已知含量的供试品(批号20181225-1),每份约0.5 g,分别精密加入维生素B1对照品储备溶液17 mL,按“1.2.1.1”项下,供试品溶液配制方法配制,测定。
1.2.1.7 稳定性
取同一供试品溶液,室温条件下放置,分别于0、5、10、20、30 min测定。
1.2.2 HPLC法测定VB1含量
1.2.2.1 溶液的制备
(1)供试品溶液
精密称取蚊不叮霜1 g(约相当于维生素B18 mg)于50 mL碘量瓶中,加入盐酸溶液约40 mL,水浴加热并不断振摇10 min后,再置冰水浴中冷却20 min,过滤至100 mL容量瓶中,按上述步骤用盐酸溶液重复提取膏体部分2次,每次约30 mL,将3次提取液合并至100 mL容量瓶中定容,摇匀。精密吸取1 mL,置于10 mL容量瓶中,用流动相稀释至刻度。
(2)对照品储备液
精密称取适量干燥至恒重的维生素B1对照品10.1 mg,置于25 mL容量瓶中,用流动相稀释至刻度,摇匀,配制成0.404 mg/mL的储备液。
(3)对照品溶液
精密吸取对照品储备液1 mL,置于50 mL容量瓶中,用流动相稀释至刻度,摇匀,制成8.08 μg/mL的对照品溶液。
1.2.2.2 检测波长
取适量的对照品溶液,在200~800 nm波长范围内进行扫描。
1.2.2.3 色谱条件
色谱柱:Diamonsil C18柱(150×4.6 mm,5 μm);
流动相:甲醇-乙腈-0.02 mol/L庚烷磺酸钠溶液(含1%三乙胺,用磷酸调pH值至5.5)=9∶9∶82;
流速:1.0 mL/min;
检测波长:267 nm;
进样量:20 μL;
柱温:室温;
采用外标法峰面积定量。
1.2.2.4 系统适用性
在上述色谱条件下,取空白溶剂、维生素B1对照品溶液、供试品溶液和阴性对照溶液进样。
1.2.2.5 线性关系
精密吸取对照品储备液0.6、0.8、1.0、1.2、1.4 mL,用流动相分别配置成4.85、6.46 μg/mL、8.08、9.70、11.31 μg/mL系列浓度测定。
1.2.2.6 精密度
取对照品溶液适量,按上述色谱条件连续测定6次,记录峰面积。
1.2.2.7 重复性
分别精密称取同一批号的蚊不叮霜(批号20181225-1)6份,按“1.2.2.1”项下,供试品溶液制备方法配制,按上述色谱条件测定维生素B1的峰面积,按外标一点法计算含量。
1.2.2.8 加标回收率
精密称取6份已知含量的供试品(批号20181215-1),每份约0.5 g,分别精密加入维生素B1对照品储备液10 mL,按“1.2.2.1”项下配制方法,按上述色谱条件测定。
1.2.2.9 稳定性
取同一供试品溶液,于室温下放置0、2、4、6、8、12 h,按上述色谱条件测定。
1.2.3 三批样品含量
三批样品(批号20181225-1、20181225-2、20181225-3)分别进行HPLC法和UV法的测定。
2 结果与分析
2.1 UV法测定维生素B1含量
2.1.1 检测波长的选择
研究表明,在246 nm处有最大吸收,维生素B1阴性对照溶液200~800 nm结果为在246 nm处无吸收,表明在246 nm处测定维生素B1有最大吸收且其他成分无干扰。选定246 nm为测定波长。图1,图2
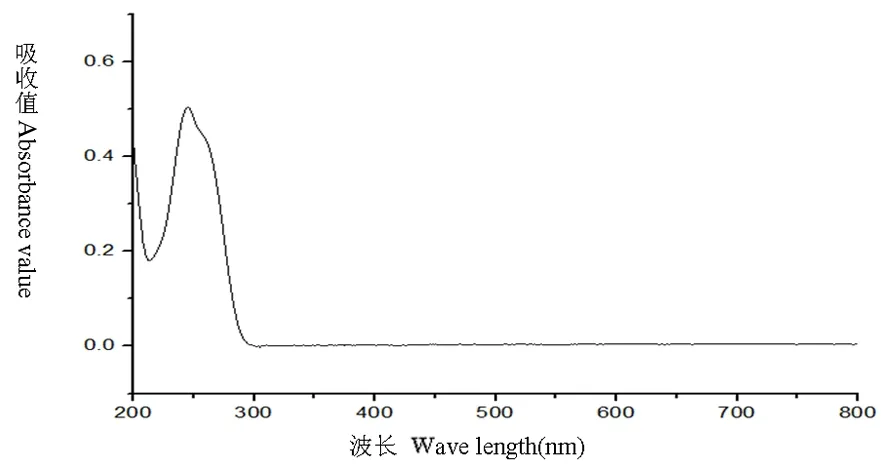
图1 维生素B1对照品溶液全波
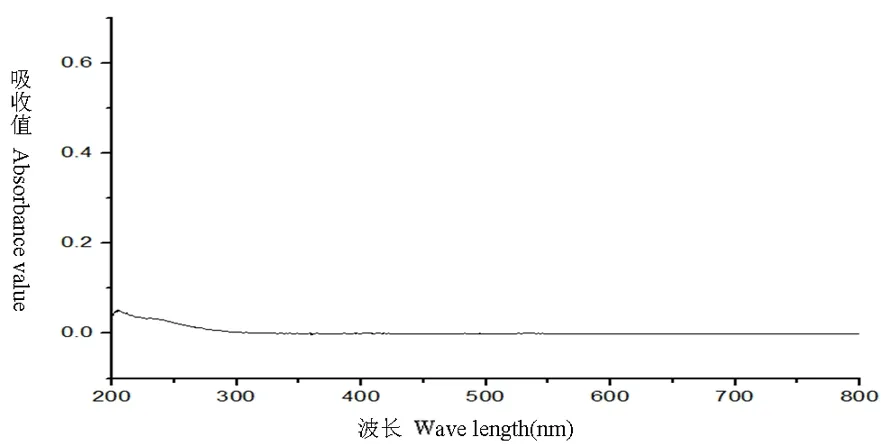
图2 阴性对照溶液全波
2.1.2 线性关系
以浓度(C)为横坐标,吸光度值(A)为纵坐标,进行线性回归。维生素B1对照品线性回归方程为A=0.045 9C-0.063 4,r=0.999 3。说明维生素B1在 7.47~14.94 μg/mL范围内,线性关系良好。图3
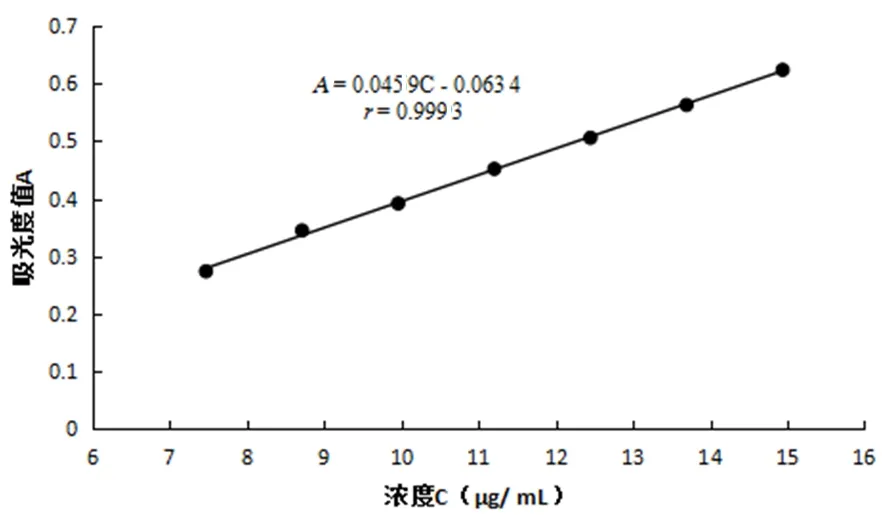
图3 维生素B1标准曲线
2.1.3 精密度
维生素B1含量RSD=0.30%,仪器精密度良好。表1
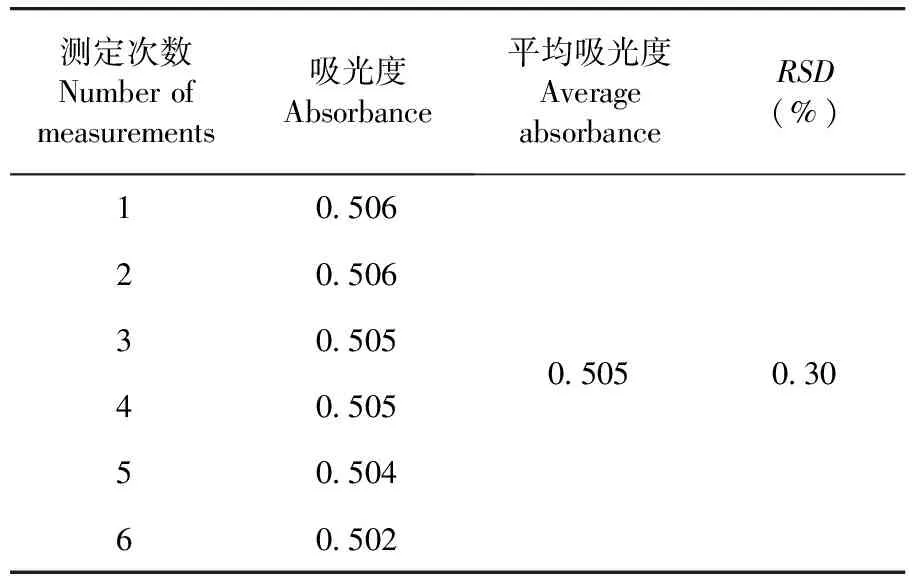
表1 精密度(n=6)
2.1.4 重复性试验
通过计算得出平均含量为8.72 mg/g,RSD=1.04%(n=6),表明该方法重复性较好。表2
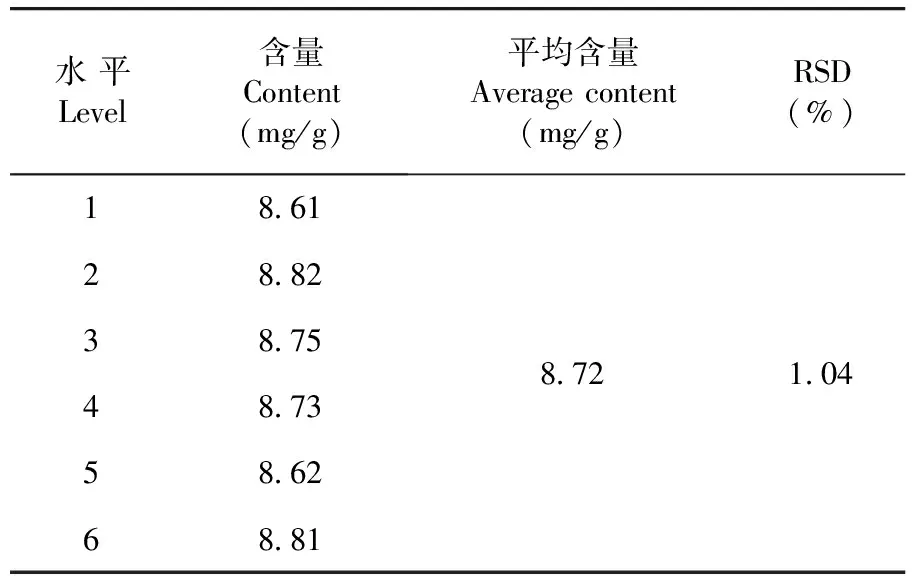
表2 重复性
2.1.5 加标回收率试验
测得平均回收率为105.13%,RSD=1.72%,表明回收率良好,准确度高。表3
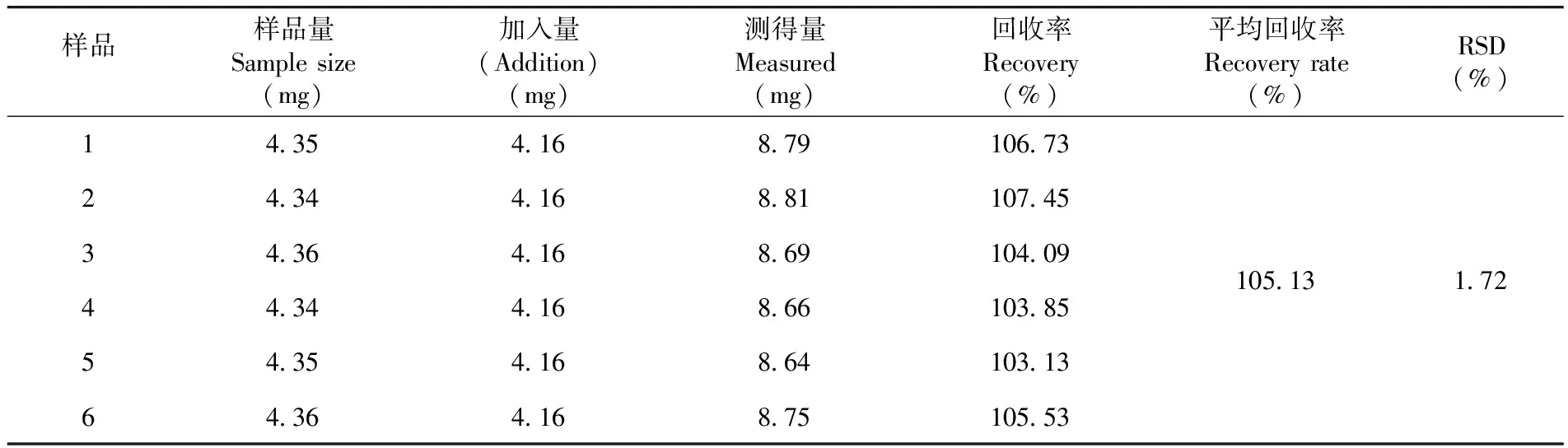
表3 加标回收率
2.1.6 稳定性
稳定性试验结果RSD=0.91%,供试品溶液在室温放置30 min稳定性良好。表4
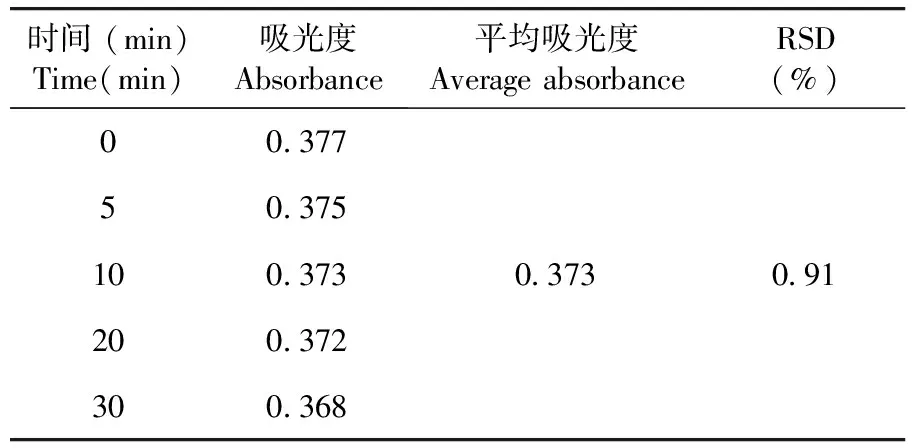
表4 稳定性
2.2 HPLC法测定维生素B1含量
2.2.1 检测波长的选择
研究表明,在267 nm处有最大吸收,表明在267 nm处测定维生素B1有最大吸收。选定267 nm为测定波长。图4
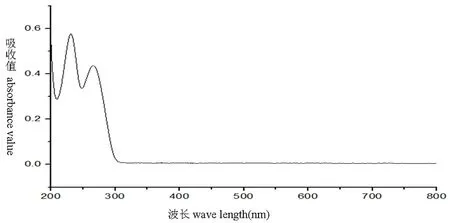
图4 维生素B1对照品溶液全波
2.2.2 线性关系
样品中维生素B1与其他组分能够分离,理论塔板数(n>3 000),该方法专属性好,其他成分对测定无干扰。图5~8
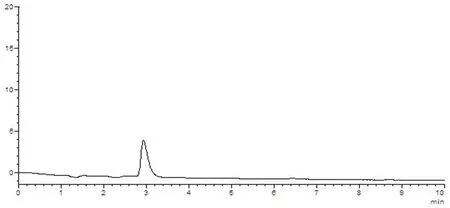
图5 溶剂空白HPLC图谱
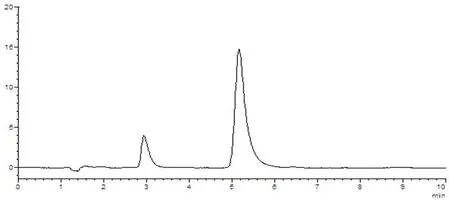
图6 维生素B1对照品溶液HPLC图谱
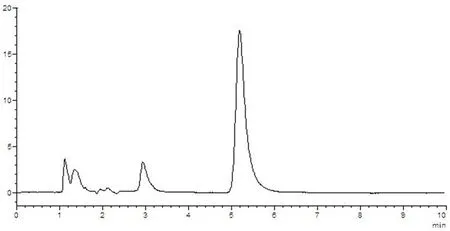
图7 供试品溶液HPLC图谱
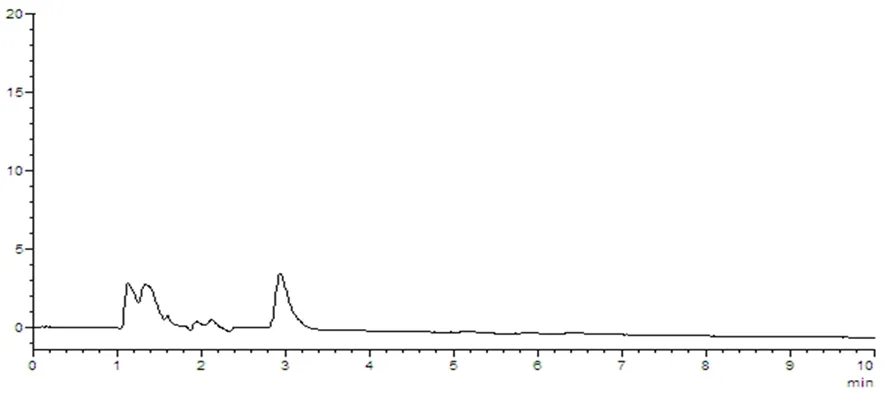
图8 阴性对照样品溶液HPLC图谱
2.2.3 线性关系考察
以浓度(C)为横坐标,峰面积(Are)为纵坐标,进行线性回归,回归方程为A=31 146C+4 562,r=0.999 9。表明维生素B1在4.85~11.31 μg/mL线性关系良好。图9
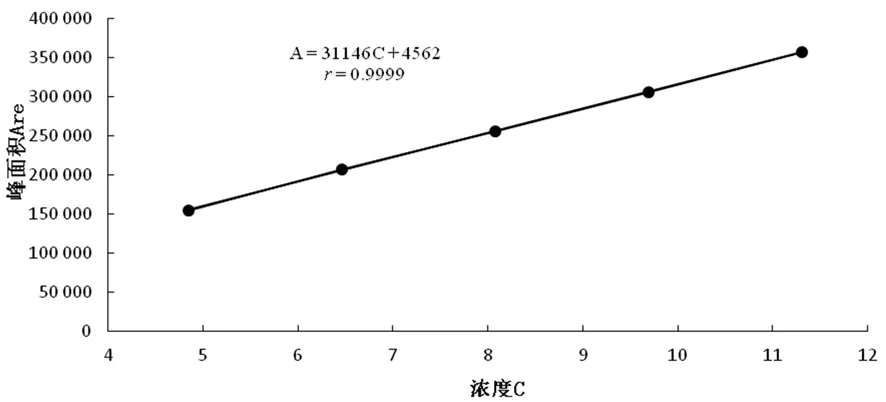
图9 维生素B1标准曲线
2.2.4 精密度
维生素B1峰面积RSD=0.28%,仪器精密度良好。表5
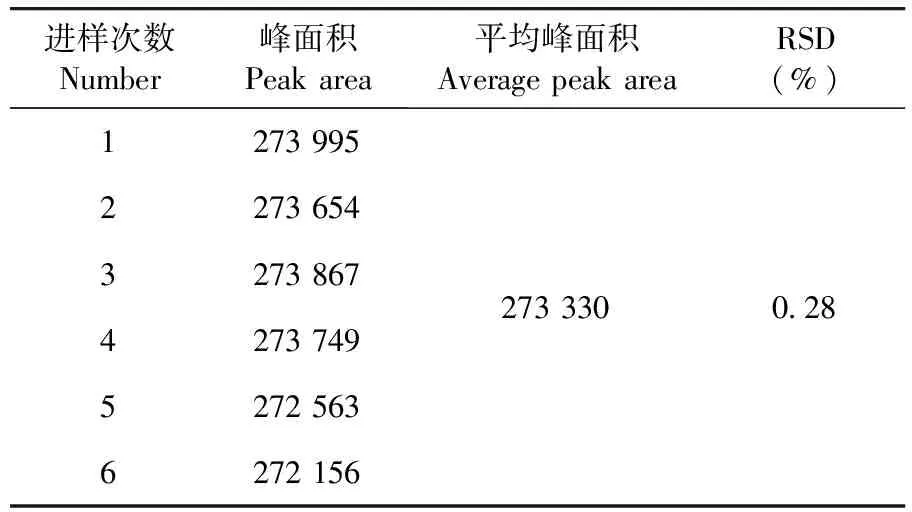
表5 精密度实验结果
2.2.5 重复性
测得平均含量为8.39 mg/g,RSD=0.90%(n=6),该法重复性良好。表6
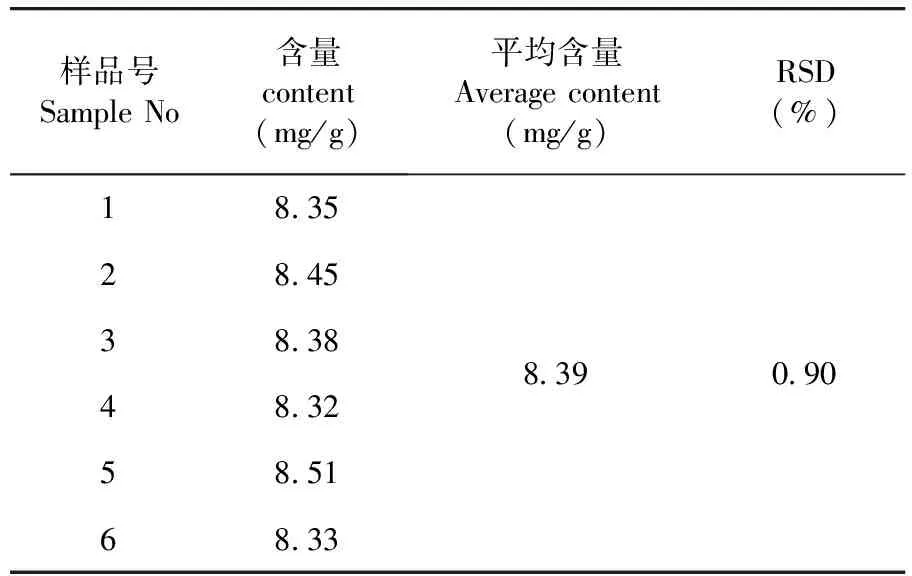
表6 重复性试验结果
2.2.6 加标回收率
测得平均回收率为101.77%,RSD=1.93%,回收率良好,准确度高。表7
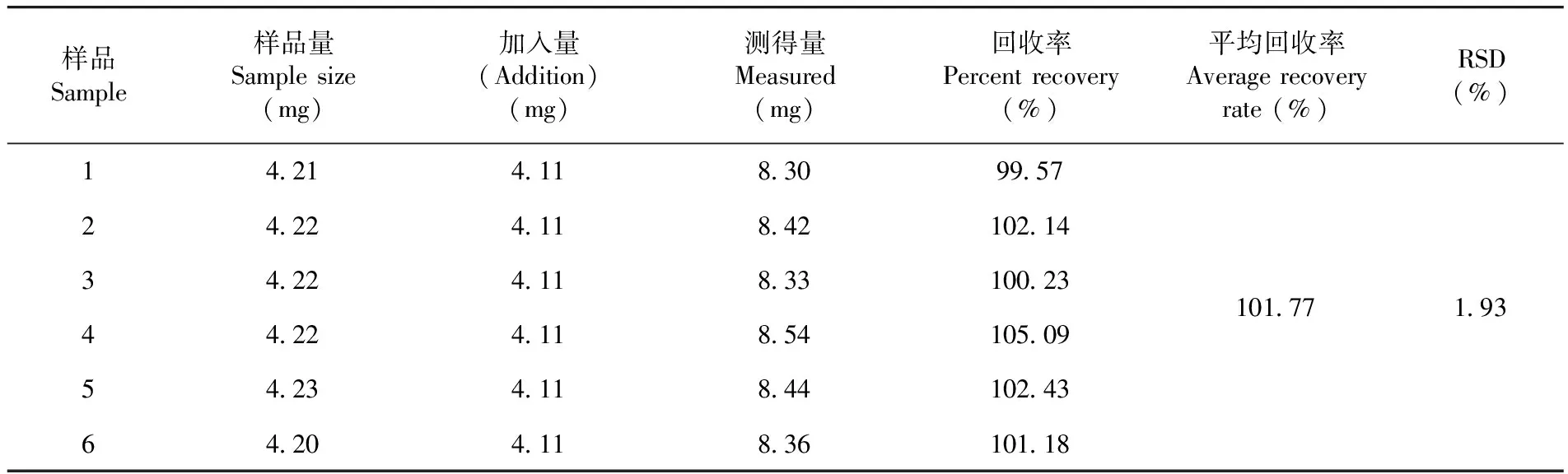
表7 加标回收率试验结果(n=6)
2.2.7 稳定性
稳定性实验结果RSD=0.39%,供试品溶液在室温放置12 h稳定性良好。表8
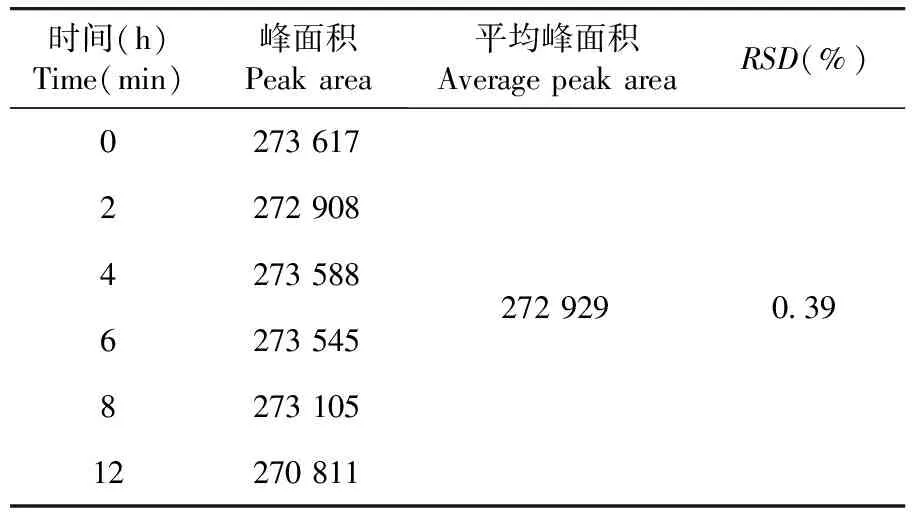
表8 稳定性
2.3 三批样品含量
HPLC法测得三批样品平均含量分别为8.39 mg/g、8.39 mg/g、8.45 mg/g;UV法测得三批样品平均含量分别为8.73 mg/g、8.70 mg/g、8.77 mg/g。与蚊不叮霜的标示量(8 mg/g)相比,虽然UV法和HPLC法测得结果均在合格范围内(标示量的90%~110%,即7.2~8.8 mg/g),但UV法测得的含量偏高,准确度较HPLC法差。表9
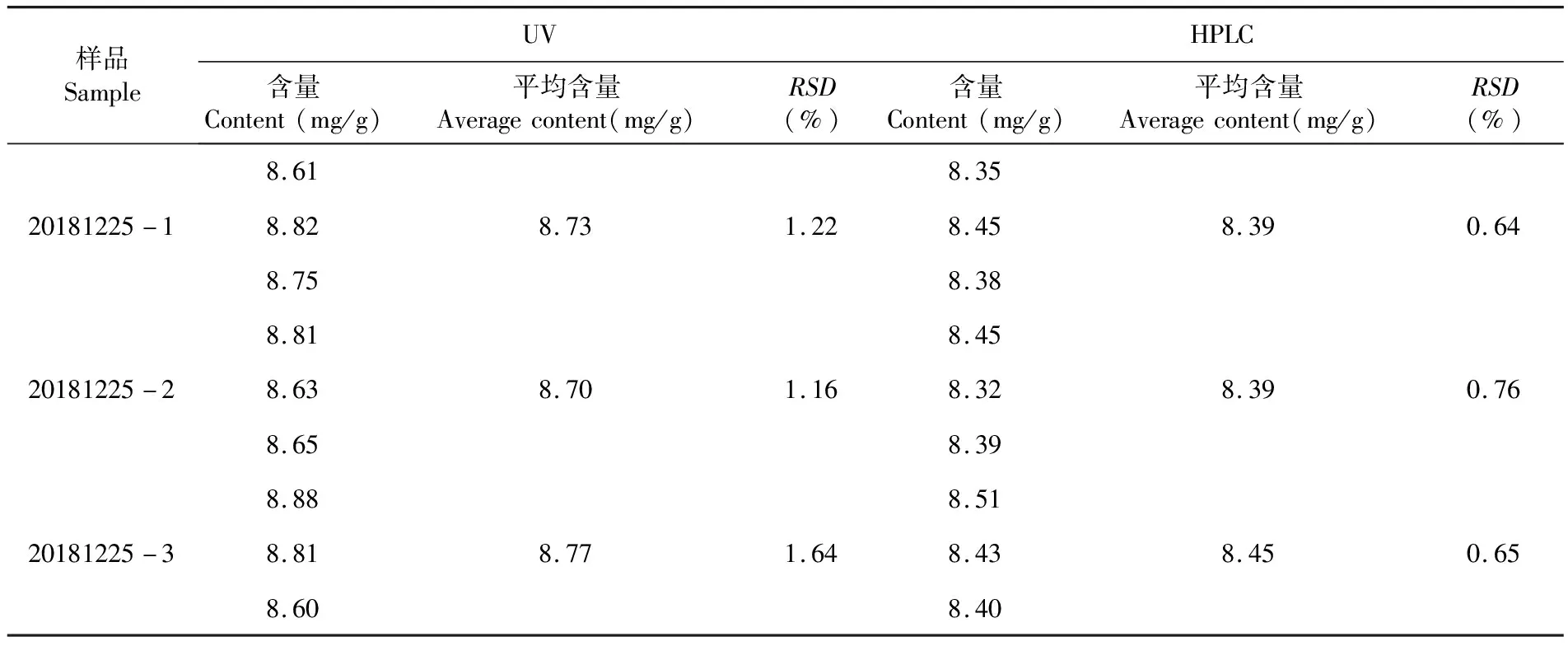
表9 三批样品含量
3 讨 论
参考《中国药典》2015版(二部)[19]中维生素B1有关物质检查的HPLC条件,将HPLC流动性确定为甲醇-乙腈-0.02 mol/L庚烷磺酸钠溶液(含1%三乙胺,用磷酸调pH值至5.5)。经测定,在此流动相条件下,色谱峰峰形良好,柱效、分离度均达到要求,故选定该流动相为本次实验所用流动相。
UV法的优点为操作简单、用时少、对仪器设备的要求不高[1,8],其缺点是易受样品中辅料等其他物质的干扰,使测得结果偏大;而HPLC法具有较好的分离效果,能够排除其他成分的干扰,测定准确性高[5,7,10]。研究通过对比UV法和HPLC法在测定蚊不叮霜中精密度、重复性、回收率及测定样品含量的准确度,最终确定HPLC测定蚊不叮霜中维生素B1含量的方法较优。
4 结 论
UV法及HPLC法的精密度、重复性均较好,UV法测得三批平均含量分别为8.73、8.70和8.77 mg/g,平均回收率105.13%;HPLC法测得平均含量分别为8.39、8.39和8.45 mg/g,平均回收率为101.77%,对比得出UV法较HPLC法测得三批平均含量分及回收率均偏高,故测定准确度不如HPLC法,且UV法稳定性较差,只能在室温下30 min稳定,HPLC法稳定性可以在室温12 h稳定,确定专属性和稳定性均较高HPLC法测定蚊不叮霜中维生素B1的含量。

