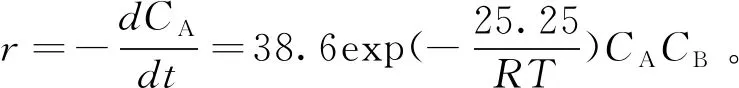酸性离子液体催化月桂酸制备生物柴油工艺的研究
梅星雨 王 晴 蔡 哲 端木佳辉 周祐昇 寿飞艳 颜诗婷 韩晓祥
(浙江工商大学应用化学系,杭州 310018)
随着矿物能源的日益减少和环境污染日益严重,人们迫切地寻求新的可再生燃料资源。生物柴油作为一种“绿色能源”,因其物化性能与石化柴油相近,具有不含硫、使用安全、清洁无污染、可生物降解性高、可与普通柴油混合使用等特点受到人们的广泛关注。生物柴油是一种高级脂肪酸酯类化合物,其中月桂酸甲酯不仅可作为生物柴油的主要成分之一,在合成食品乳化剂、日用化妆香精和药物等领域有重要应用[1]。传统的月桂酸甲酯制备工艺存在强酸腐蚀设备、副反应多、反应后酸废液难处理、催化剂不易回收、污染环境等缺点。因此,寻找一种清洁、高效的催化剂代替传统酯化反应催化剂的研究备受关注[2]。

1 材料与方法
1.1 材料与仪器
喹啉、溴代正丁烷、1-丁基-3-甲基咪唑硫酸氢盐([BMim]HSO4)、1-乙基-3-甲基咪唑硫酸氢盐([EMim]HSO4)、2,6-二甲基吡啶、5-乙基-2-甲基吡啶、乙腈、乙酸乙酯、甲苯、浓硫酸等(均为分析纯)。
Nicolet 380傅里叶红外光谱仪,Bruker AV500核磁共振光谱仪,STARe TGA热重分析仪,UV2550紫外-可见光谱仪。
1.2 方法
1.2.1 酸性离子液体的制备
将0.1 mol喹啉、0.1 mol溴代正丁烷和40 mL乙腈加入到100 mL三口瓶中,回流条件下搅拌反应48 h,反应结束后减压蒸除溶剂,残留物用乙腈/乙酸乙酯(1∶5)洗涤数次,产物经真空干燥后得紫褐色晶体溴代1-丁基喹啉。取0.1 mol的溴代1-丁基喹啉溶于50 mL蒸馏水中,机械搅拌的情况下向反应体系中滴加等摩尔的浓H2SO4,滴加完毕后,升温至90 ℃反应过夜,反应结束后,反应产物用甲苯洗涤3次,减压蒸除甲苯,产物经真空干燥后即可得1-丁基喹啉硫酸氢盐离子液体([BQu]HSO4)。相同的方法用于1-丁基-2,6-二甲基吡啶硫酸氢盐([BDMPy]HSO4)、1-丁基-5-乙基-2-甲基吡啶硫酸氢盐([BEMPy]HSO4)酸性离子液体的制备。
1.2.2 酸性离子液体的结构及酸性表征
采用KBr 压片法在Nicolet 380 型傅里叶红外光谱仪上对酸性离子液体进行红外光谱测定。以D2O 为溶剂,利用Bruker AV500 型核磁共振仪对酸性离子液体进行核磁共振光谱测定。氮气氛围中,利用TGA/DSC 1热重分析仪对离子液体的热稳定性进行测定。升温范围为室温至873 K,升温速率20 K/min。
利用Hammett法对离子液体的酸强度进行测定[20]。即以4-硝基苯胺为指示剂,在紫外可见分光光度计下测定样品的吸光度,并按下式计算Hammett函数H0,H0可用于表达酸性离子液体的酸度。
H0= pKa(I)aq+ log[x(I)/x(IH+)]
(1)
式中:pKa(I)aq为碱性指示剂4-硝基苯胺的离解常数;x(I)为未质子化碱性指示剂的摩尔分数;x(IH+)为质子化碱性指示剂的摩尔分数。指示剂4-硝基苯胺浓度为1.0×10-4mol/L (pKa= 0.99),离子液体浓度为2.0×10-2mol/L,水为参比液。
1.2.3 酸性离子液体催化合成月桂酸甲酯
将10 g (0.05 mol)月桂酸,一定量甲醇和催化剂依次加入100 mL三颈瓶,装上内置3Å分子筛的恒压滴液漏斗及回流冷凝装置,在一定的温度下加热回流反应。反应结束后,取样,在安捷伦气相色谱仪(Agilent 7890B,FID 检测器,HP-5 毛细管柱)上对样品进行分析,辛酸甲酯为内标物。并按GB/T 5530—2005测定反应前、后酸值,计算月桂酸的转化率。
月桂酸转化率= (1-反应后酸值/反应前酸值) × 100%
(2)
月桂酸甲酯产率=月桂酸甲酯产率实测值/月桂酸甲酯产率理论值×100%
(3)
1.4 月桂酸与甲醇酯化反应动力学模型[21,22]
酸性离子液体催化月桂酸与甲醇进行酯化反应时,离子液体以匀相形式参与反应中,反应得到的主要产物为月桂酸甲酯,该酯化反应的反应速率方程可表示为:
(4)
r为月桂酸酯化反应速率;k+和k-分别为正逆反应速率常数;CA、CB、CC和CD分别为月桂酸、甲醇、月桂酸甲酯和水的瞬时浓度;α、β、γ和η分别为对应的反应级数。由于3Å分子筛尽可能除去了反应中形成的水,且k+≫k-,因此该反应可视为不可逆反应。因此方程(4)可简化为:
(5)
假设α=β=1,Q=CB0-CA0,其中,CA0为月桂酸的初始浓度(mol/L),CB0为甲醇的初始浓度(mol/L),则CB=CA+Q,式(5)可改写为:
(6)
对式(6)积分可得式(7):
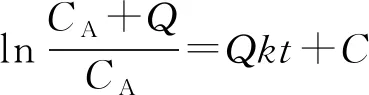
(7)
选择不同温度进行实验,不同时间点进行取样,根据式(7)进行线性拟合得不同温度下的修正反应速率常数k。再根据阿乌尼斯方程(8)即可获得酸性离子液体催化制备月桂酸甲酯反应的指前因子k0和反应活化能Ea。
(8)
2 结果与分析
2.1 离子液体的结构、稳定性及酸性表征
不同酸性离子液体的核磁光谱数据、红外光谱数据及热重数据为:
[BQu]HSO4:1H NMR (500 MHz, D2O): δ 0.59 (t, 3H), 1.06 (m, 2H), 1.62 (m, 2H), 4.60 (t, 2H), 7.50 (q, 1H), 7.62 (d, 1H), 7.76 (d, 1H), 7.80 (q, 1H), 7.93 (q, 1H), 8.61 (q, 1H), 8.86 (d, 1H);13C NMR (500 MHz, D2O): δ 12.74, 19.06, 31.16, 57.83, 118.02, 121.59, 129.73, 129.88, 130.50, 135.78, 137.37, 147.36, 148.26; IR (KBr)=3 401, 2 964, 2 869, 1 717, 1 527, 1 454, 1 382, 1 231, 1 169, 1 052, 878, 812, 778, 587 cm-1。热分解温度为597 K。
[BDMPy]HSO4:1H NMR (500 MHz, D2O): δ 0.59 (t, 3H), 1.05 (m, 2H), 1.63 (m, 2H), 2.61(s, 6H), 4.65 (t, 2H), 7.80 (d, 2H), 8.29 (q, 1H);13C NMR (500 MHz, D2O): δ 12.84, 19.17, 21.1, 33.4, 52.7, 123.1, 146.3, 154.9; IR (KBr)=3 417, 3 048, 2 992, 1 918, 1 627, 1 398, 1 219, 1 046, 878, 806, 582 cm-1。热分解温度为560 K。
[BEMPy]HSO4:1H NMR (500 MHz,D2O): δ 0.59 (t, 3H), 0.88 (t, 3H), 1.06 (m, 2H), 1.64 (m, 2H), 2.41(q, 2H), 2.61(s, 3H), 4.66 (t, 2H), 7.89 (d, 1H), 8.25 (d,1H), 9.16 (s,1H);13C NMR (500 MHz, D2O): δ 12.8, 13.5, 19.4, 21.1, 25.8, 32.7, 55.5, 126.0, 141.6, 141.8, 145.1, 152.5; IR (KBr)=3 434, 2 964, 2 870, 1 639, 1 523, 1 406, 1 219, 1 041, 845, 572 cm-1。热分解温度为551 K。
[BMim]HSO4的热分解温度为673 K;[EMim]HSO4的热分解温度为686 K。由此可见,酸性离子液体均具有相对稳定的结构,在反应条件下能保持良好的热稳定状态。
不同离子液体的H0值及催化酯化活性见表1,由表可见,[BQu]HSO4催化剂具有最强酸性,[BDMPy]HSO4及[BEMPy]HSO4催化剂酸性相对较弱。离子液体酸强度的大小与离子液体催化酯化反应时的活性次序有关。
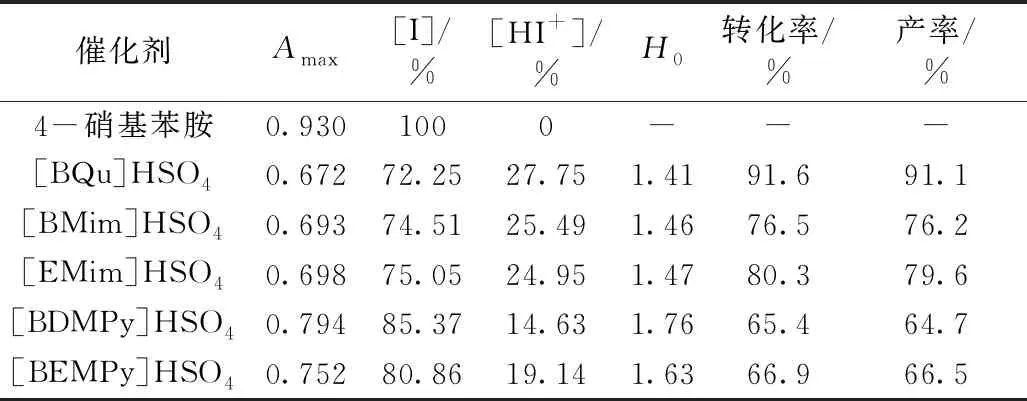
表1 不同离子液体的H0 值及催化酯化活性*
2.2 不同酸性离子液体催化酯化性能研究
酯化反应是典型的酸催化反应,催化剂的酸性是影响酯化反应的重要因素之一,而酸性离子液体的酸性可通过改变离子液体的阴、阳离子来实现,实验中考察了不同阳离子组成硫酸氢盐离子液体催化剂对月桂酸和甲醇酯化反应的影响,结果见表1。相同反应条件下,不同酸性离子液体在月桂酸甲酯合成反应中显示不同的催化性能,催化反应的活性大小次序为:[BQu]HSO4>[EMim]HSO4>[BMim]HSO4>[BEMPy]HSO4≈[BDMPy]HSO4。H0值大小反映了离子液体的酸性大小,结合表1中各离子液体的H0值,发现酸性离子液体酸强度大小次序与催化酯化反应活性次序基本一致。离子液体的酸性越强,催化反应时可提供参与反应的酸性活性中心数越多,催化效果越好。具有较强酸性的 [BQu]HSO4离子液体可提供较多酸活性中心,因此表现出较好的催化酯化性能。实验中选择[BQu]HSO4为催化剂,详细考察各因素对酯化反应的影响,进而对生物柴油的制备工艺进行优化。
2.3 不同因素对生物柴油产率的影响
以[BQu]HSO4为催化剂,详细考察了催化剂量、醇酸摩尔比、反应时间及反应温度等因素对月桂酸与甲醇酯化制备生物柴油反应的影响,不同因素对月桂酸与甲醇反应制备生产柴油产率的影响如图1所示,每组实验重复3次。
图1a为酸性离子液体[BQu]HSO4用量对生物柴油产率的影响。催化剂用量决定了参与催化反应酸性活性中心位点的多少,从而对反应速率产生影响。由图1a可知,随着催化剂用量的增加,参与反应的酸性活性中心增加,月桂酸转化率及生物柴油产率增加,当催化剂用量为月桂酸质量的1%时,月桂酸转化率及生物柴油产率分别为91.6%和91.1%。继续增加催化剂用量,月桂酸转化率及生物柴油产率变化不明显,此时反应基本达到平衡;进一步增加催化剂用量(>1.5%),月桂酸转化率及生物柴油产率下降。这是因为反应体系中过多的酸性活性中心促进了酯水解等副反应的发生,从而使生物柴油产率下降。
酯化反应是可逆反应,增加反应物的浓度有助于反应平衡向生成产物酯的方向进行,从而提高反应收率。图1b为不同醇酸摩尔比对月桂酸转化率及生物柴油产率的影响。随着醇酸摩尔比的增加,月桂酸转化率及生物柴油产率增加,当醇酸摩尔比为5∶1时,月桂酸转化率及生物柴油产率最大;继续增加甲醇的量,月桂酸转化率及生物柴油产率均下降,这是因为过量的甲醇增加了反应体积,从而降低了反应物及催化剂的相对浓度,使反应活性降低。因此,将醇酸摩尔比定为5∶1。
反应时间对酯化反应也有着重要影响,一般来说,延长反应时间有助于反应的进行。图1c为反应时间对月桂酸转化率及生物柴油产率的影响。随着反应时间的增加,月桂酸转化率及生物柴油产率先快速增加,而后趋于缓慢增加,进一步延长反应时间,月桂酸转化率及生物柴油产率略有下降。综合考虑,实验中选择3 h作为反应时间。
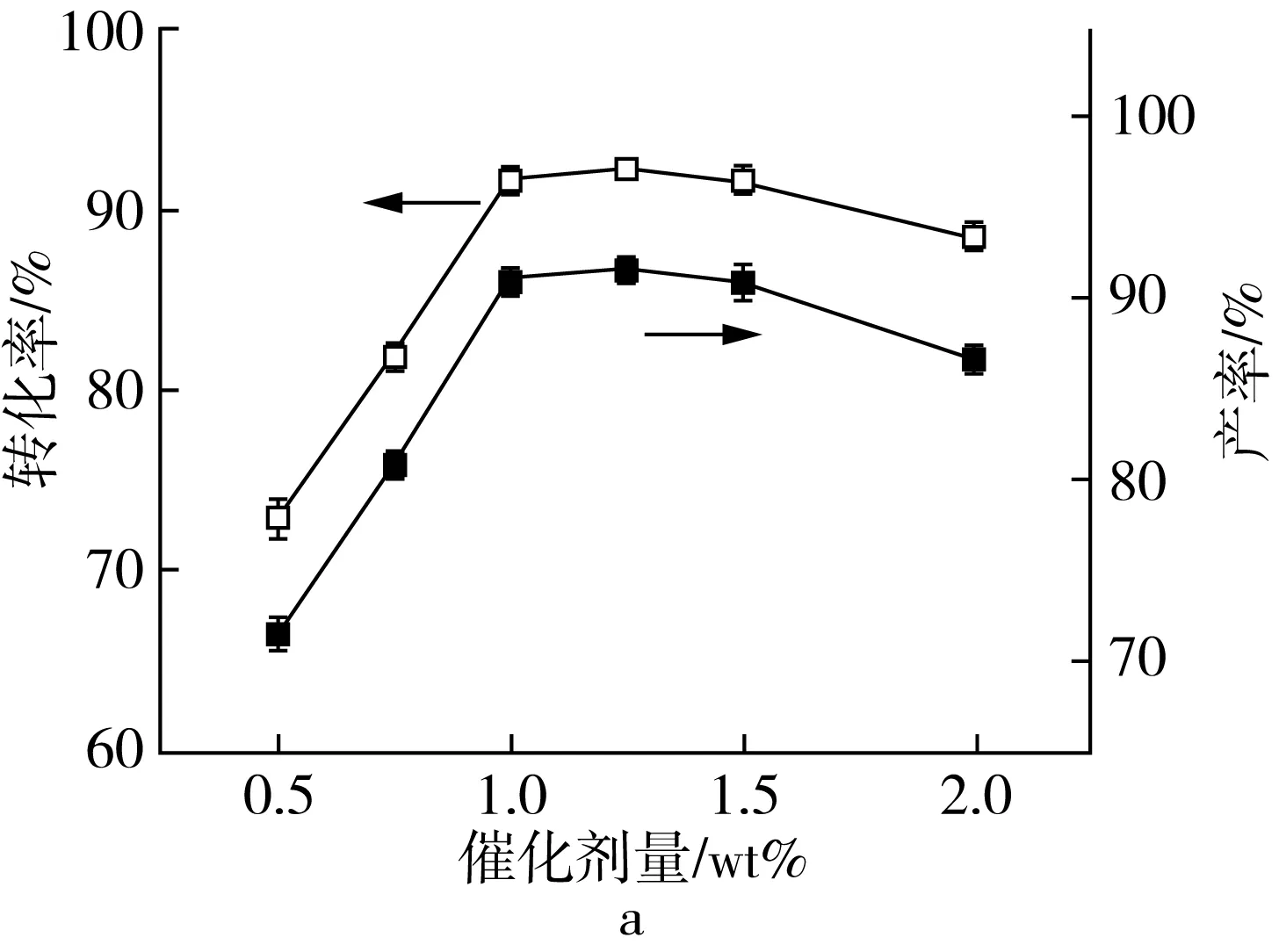
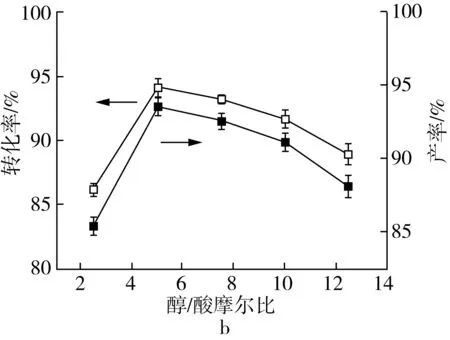
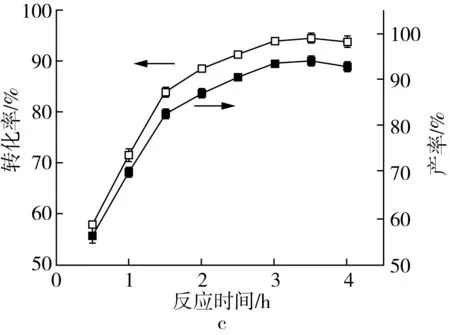

图1 不同因素对月桂酸与甲醇反应制备生产柴油产率的影响
通常情况下,提高反应温度有助于化学反应速率的增加。由图1d可见,月桂酸转化率及生物柴油产率随着反应温度的升高而增加。低温时,反应物分子间有效碰撞频率较低,且反应中形成的水不能及时带离反应体系,酯化反应收率较低;升高反应温度,分子间有效碰撞频率增加,生成物水的及时排除进一步促进了化学平衡向着酯生成的方向移动,从而有利于酯化反应的进行;反应温度过高时,甲醇可能会随蒸汽挥发损失,同时促进了酯水解副反应的发生,综合结果使生物柴油产率增加不明显。为降低能源消耗,温度选择373 K。
2.4 响应面法优化生物柴油的合成
2.4.1 分析因素的选取及分析方案
依据Box-Benhnken的中心组合实验设计原理,在单因素实验基础上,选择对月桂酸甲酯制备过程影响较大的三个因素,即催化剂用量(A)、醇酸摩尔比(B)和反应时间(C),进行三因素三水平响应面分析法优化月桂酸甲酯制备工艺条件,实验设计中的因素水平及编码水平见表2。依据响应面实验设计方案并进行相应实验,响应面实验设计方案及实验结果见表3,由表3可见,实验所得生物柴油的实际产率与理论预测值基本接近,表明该设计模型能较好地预测响应值Y(月桂酸甲酯产率)与A、B、C三因素间关系。二次回归方程可表示为:
Y=93.58+7.53A-1.05B+0.66C-8.89A2-1.26B2-7.53C2-0.44AB+7.27AC- 2.01BC

表2 实验设计中的因素水平及编码水平
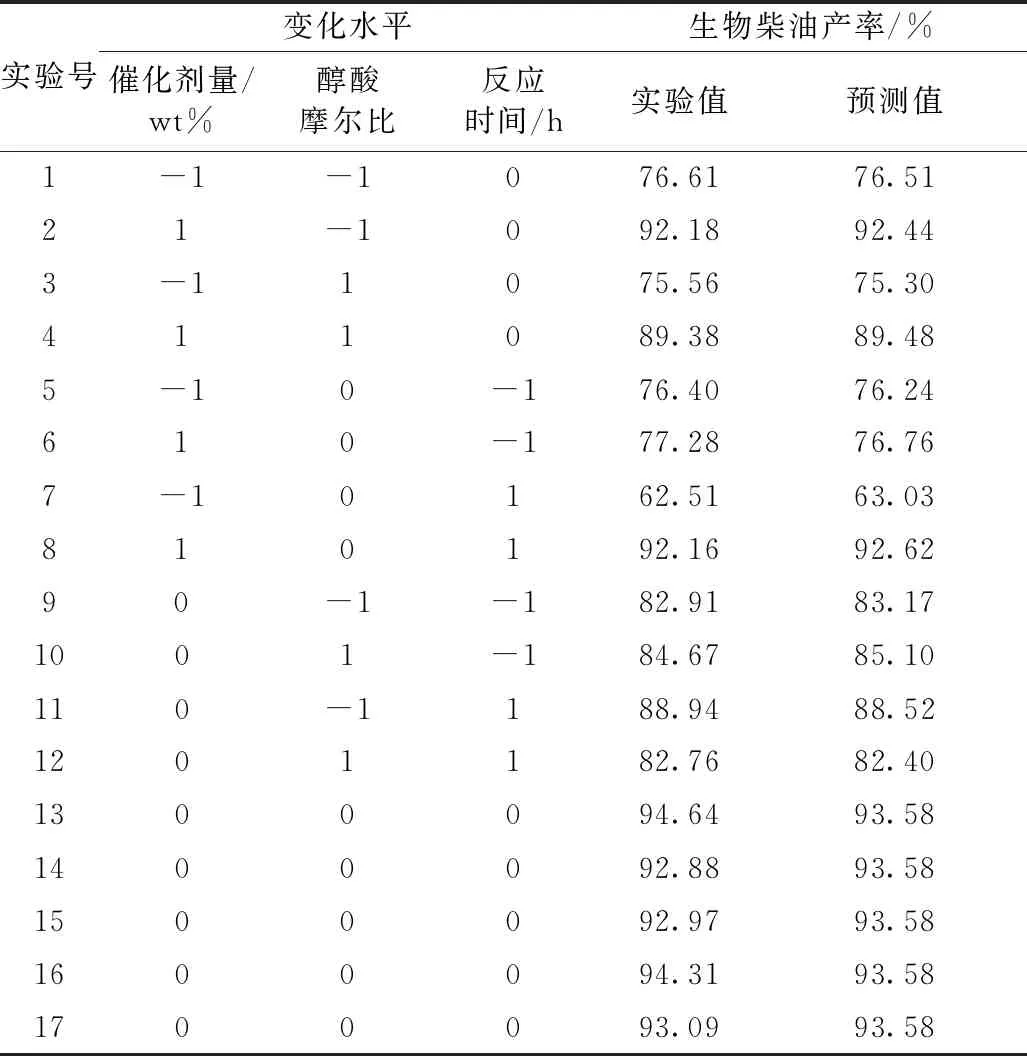
表3 响应面试验设计方案及实验结果
2.4.2 模型的建立与显著性检验
方差分析表见表4,该模型的P值<0.000 1,模型F值为255.57,F≫F0.01(9,7),表明模型在研究的回归区域内具有较好的拟合度,二次回归模型极其显著;模型的相关系数R2和AdjR2分别为0.997 0和0.993 1,说明方程拟合度较好,回归模型具有较高的可行性。模型的变异系数(C.V)为0.89%,在可接受范围内,表明设计模型具有较高的精确度和较好的可信度。综合分析结果可知,该回归模型设计合理、可靠,能应用该模型预测不同因素对生物柴油产率的影响。同样由表4数据可知,催化剂量、醇酸摩尔比对生物柴油产率的影响达极其显著水平(P<0.01),反应时间对生物柴油产率的影响达到显著水平(P<0.05);显著性影响次序为:催化剂量 >醇酸摩尔比 >反应时间;催化剂量和醇酸摩尔比的交互作用对生物柴油产率的影响不显著(P>0.05),而反应时间分别与催化剂量、醇酸摩尔比之间的交互作用对生物柴油产率的影响极显著(P<0.01)。
2.4.3 因素间的交互影响
各因素对生物柴油转化率影响的等高线图和响应面图如图2所示。是采用Design Expert软件绘制的不同因素与生物柴油产率间关系的三维空间曲面图和等高线图。根据等高线图形可推测不同变量间的相互作用对生物柴油产率的影响,图形呈圆形表明两因素间的交互作用不明显,等高线呈椭圆形则表示交互作用明显[23]。

表4 方差分析表
图2a和图2d是醇酸摩尔比和催化剂用量对生物柴油产率的交互影响。由图2d可知,沿着催化剂量方向的曲面更为陡峭;图2a的等高线图表明催化剂用量所在坐标轴方向上的等高线更为密集,说明反应条件下催化剂用量较醇酸摩尔比对生物柴油的产率影响更大。图2b和图2e显示了[BQu]HSO4用量和反应时间对生物柴油产率的交互影响,由图2e可知,当反应时间保持在3 h时,随着催化剂量的增加,生物柴油的产率先缓慢增加,然后基本保持不变,而当把催化剂量保持在1wt%时,随着反应时间的增加,生物柴油的产率呈现先上升后缓慢下降的趋势,相对而言,催化剂量对生物柴油产率的影响更大;由等高线图2b可知,催化剂量所在坐标轴方向的等高线更为密集,说明催化剂量与反应时间间的交互作用显著,这与方差分析结果相符合。图2c和图2f是醇酸摩尔比与反应时间对生物柴油产率的交互影响,反应时间所在方向上的等高线较醇酸摩尔比方向上等高线更加密集,说明反应时间对生物柴油产率的影响比醇酸摩尔比更大。方差分析表明两个因素间交互作用达显著水平。
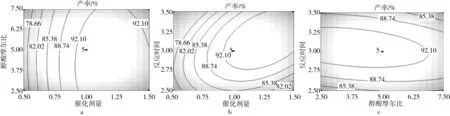
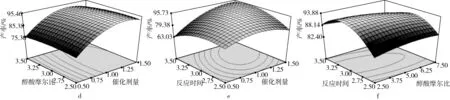
图2 各因素对生物柴油转化率影响的等高线图和响应面图
2.4.4 最佳工艺条件
通过响应面分析法优化酸性离子液体[BQu]HSO4催化月桂酸制备生物柴油的最佳工艺条件为:离子液体用量为月桂酸质量的1.32%,甲醇与月桂酸摩尔比为2.76∶1,反应时间3.24 h,温度373 K,此条件下生物柴油的产率为96.62%。进一步优化条件为:离子液体用量为月桂酸质量的1.3%,甲醇与月桂酸摩尔比为2.8∶1,反应时间3.2 h,温度373 K,此条件下3次平行实验得到生物柴油的产率分别为95.8%、96.4%和96.7%,平均产率为96.3%,验证值与理论预测值基本相符,表明采用模型真实有效。
2.5 [BQu]HSO4催化月桂酸制备生物柴油动力学模型
为进一步了解[BQu]HSO4催化月桂酸制备生物柴油反应过程,实验研究了上述优化条件下动力学模型,即在离子液体用量为月桂酸质量的1.3%,甲醇与月桂酸摩尔比为2.8∶1,反应温度分别为333、343、353、363、373 K条件下的反应。反应过程中,分别在30、60、90、120、150 min时间点进行取样分析,并绘制不同温度下lnCA/CB与时间点t的变化关系图,不同温度下反应物浓度(lnCA/CB)与时间(t)关系拟合图如图3所示。
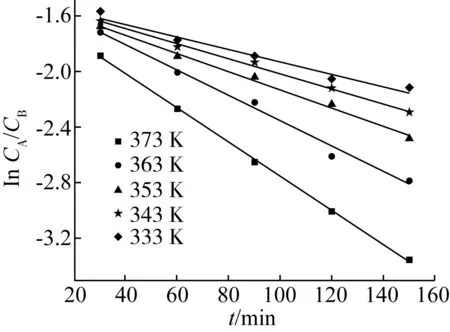
图3 不同温度下反应物浓度(ln CA/CB)与时间(t)关系拟合图
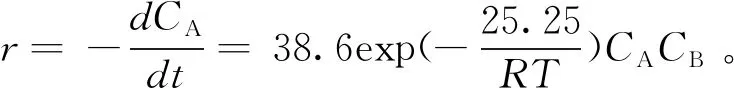
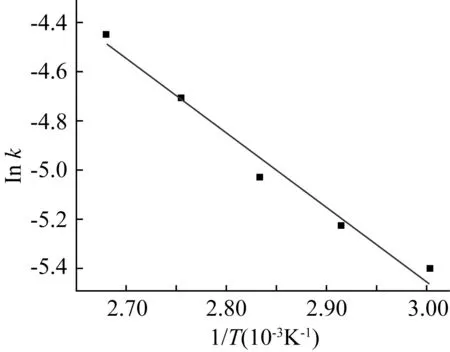
图4 lnk vs 1/T的阿乌尼斯方程
3 结论