初中化学“溶解度”教学的改进
殷志忠 田长明

摘要:从科学归纳影响固体溶解度因素和溶解度曲线类型、合理选择溶解度曲线相关习题和实验、运用溶解度的相关知识解决实际问题等三方面入手,结合例题阐释在初中化学就“溶解度”相关知识教学时,归纳总结时要注意科学性与规范化,习题与实验的选择要体现真实性与情境化,实际运用时要关注准确性与多元化。
关键词:溶解度; 硫酸亚铁; 氢氧化钙; 教学改进
文章编号:1005-6629(2020)09-0094-04
中图分类号:G633.8
文献标识码:B
“溶解度”是九年级化学中一个重要的知识点,也是各地中考化学考查的热点内容之一。因此在平时的课堂教学中,初中化学教师花了很多心思和精力来提高课堂教学的效果,但在追求教学成绩的同时,我们不能忘记学科本身的科学性以及化学知识的实用性。如何进一步提升初中化学课堂的教学品质,试从以下三方面进行阐释。
1 学会科学归纳
知识的归纳小结是课堂教学中一种重要的教学方法,它是从许多个别的具体事物中概括出一般性概念、原则或结论的思维方法,归纳的目的一方面能挖掘该知识点的本质,另一方面也便于学生理解、记忆和运用。但发现有些教师归纳知识点时有时显得不严谨、不科学。
案例1 影响固体溶解度的因素
沪教版九年级化学教材中对溶解度的定义有如下描述:“固体物质的溶解度是指在一定温度下,该物质在100g溶剂(通常溶剂为水)中达到饱和状态时所溶解的质量”[1]。根据这个定义,很多教师对影响固体溶解度大小的因素一般都会做如下归纳:
溶质和溶剂本身的性质是内因;温度为外因。
影响固体物质溶解度的外部因素难道只有温度吗?溶液中如果含有两种或两种以上的溶质,溶质之间对彼此的溶解度是否有影响?我们知道在两种含有相同离子的盐溶于水时,它们的溶解度一般都会降低,这种现象叫做同离子效应。如在相同的温度下,氯化钠在氯化钾溶液中的溶解度比在水中的溶解度要小,同样氯化钾在氯化钠溶液中的溶解度要比在水中的溶解度小。因此笔者建议在“温度”后面应加“等”。
案例2 溶解度曲线的类型
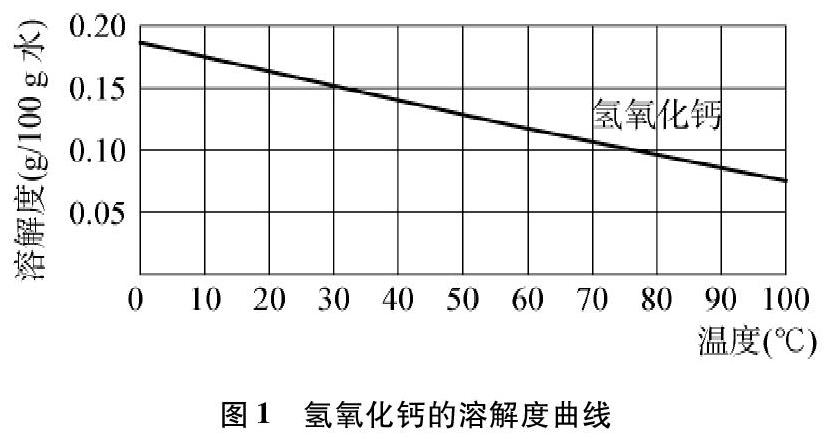
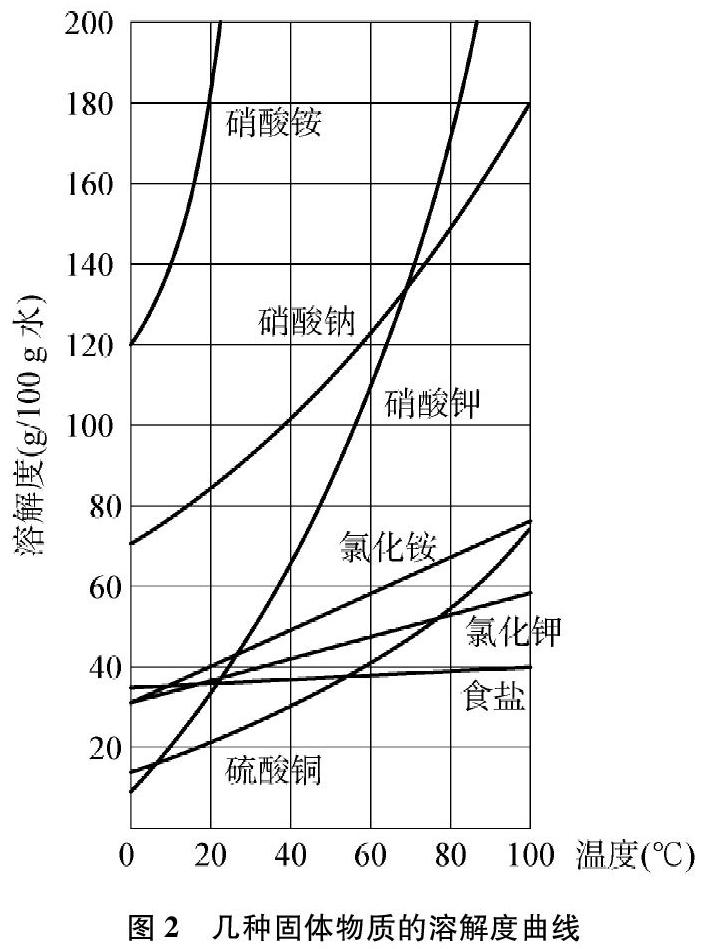
沪教版九年级化学下册第20页有两张溶解度曲线图(见图1和图2)[2],
于是有教师在教学中对溶解度曲线进行如下归纳:
溶解度曲线有下列有三种类型:
(1) 大多数固体物质的溶解度曲线左低右高,溶解度随温度升高而增大。如硝酸钾等。
(2) 少数固体物质的溶解度曲线较平缓,溶解度受温度的影响很小。如氯化钠等。
(3) 极少数固体物质的溶解度曲线是左高右低,
溶解度随温度的升高而降低,如氢氧化钙(图1)等。
溶解度曲线只有上面这三种类型吗?答案肯定是否定的,因为不是所有物质的溶解度都是单调上升或单调下降的。有些固体的物质的溶解度先是随着温度的升高而增大,当达到一定温度后,溶解度又随着温度的升高而减小,如硫酸亚铁、硫酸钠等。笔者以硫酸亚铁为例:
硫酸亚铁在不同温度下的溶解度不同,析出晶体的组成也有所不同。表1是硫酸亚铁的溶解度数据(根据《兰氏化学手册》换算)。
造成这一现象的原因是FeSO4·7H2O晶体热稳定性差,受热后配体水分子容易失去。FeSO4·7H2O热分解失去结晶水过程大致可分为3个阶段,在23~78℃时FeSO4·7H2O逐渐失去3个配体水,生成FeSO4·4H2O,然后在78~159℃时再陆续失去3个配体水,生成FeSO4·H2O,在373℃时可完全脱水[3]。上述过程可简单表示为:
因此建议将“溶解度曲线有下列有三种类型”改为“溶解度曲线一般有下列三种类型”更贴切。
2 学会合理选择
经常会听到这样一句话,“不让学生跳入题海,教师必须跳入题海”。这句话隐含的意义就是教师跳入题海对试题进行甄别和选择,选择科学的、合适的试题用于课堂教学。其实在教学过程中不仅试题需要选择,很多东西都需要选择,如教学的手段、实驗的方法等。
2.1 合理选择习题
习题是用来巩固学生所学的知识,训练学生思维与方法的重要载体,因此,利用真实的化学情境,设置情境化的化学问题,帮助学生提高解决化学实际问题的能力,引导学生做真题、真做题,既避免片面追求“偏”“怪”“难”的假题,来机械训练学生刷题,也防止题目中混入一些不科学的信息误导学生,这也是化学学科价值与育人价值的体现。
溶解度曲线是各地化学中考必考的一个重要知识点,因此在平时的教学中针对这方面的训练也是必不可少的,但在编制试题的过程中,命题者往往会用“A”“B”“C”或“甲”“乙”“丙”来表示某种物质,如下列这道题:
案例3 甲乙两种物质的溶解度曲线如图3所示,
下列说法中正确的是
A. 30℃时,50g水可以溶解25g甲物质
B. 升温能使甲物质的不饱和溶液变为饱和溶液
C. 20℃时,甲、乙两种物质的溶解度相同
D. 30℃时,乙物质的溶解度比甲物质的溶解度大
有专家提出这样的疑问,在溶解度曲线中用“A”“B”“C”或“甲”“乙”“丙”来表示固体物质,这样的固体物质是否存在?
例如:溶解度随着温度的升高而降低的物质,中国各种版本的初中教材中常见的物质就是氢氧化钙,笔者翻阅了美国高中主流理科教材《科学发现者(中册)》关于固体物质的溶解度曲线[4],教材提供了图4,其中溶解度随着温度的升高而降低的物质是Ce2(SO4)3。无论是Ca(OH)2,还是Ce2(SO4)3,其溶解度曲线都不符合试题中的“乙”物质。笔者查阅了《兰氏化学手册》关于固体物质溶解度的相关数据,其中二水合乙酸钙和硫酸锂的溶解度也是随着温度的升高而降低的[5]。
通过比对数据发现二水合乙酸钙和硫酸锂也不符合试题中的“乙”物质。
可喜的是,这样的问题已经引起各地中考命题专家的重视,在命制试题时溶解度曲线中的每一条曲线都代表着一种具体的物质,只是我们大多数一线教师在教学过程中并没有意识到这个问题,在平时的教学中用“A”“B”“C”或“甲”“乙”“丙”来表示某物质的溶解度曲线的习题还是屡见不鲜。选择溶解度曲线的相关习题,可以具体以某些物质的溶解度曲线为例,围绕溶解度、饱和溶液与溶液的溶质质量分数设置相关问题,如:在不同温度下,物质溶解性的变化情况;相同温度下,不同物质的溶解性的定量比较;依据溶解度曲线,判定某温度下一定量溶剂中溶解一定量的溶质时所得溶液是否饱和,以及所得溶液的溶质质量分数等等。这样既加深学生对所学概念的理解,又对溶解度曲线的应用有初步认识。
2.2 合理选择实验
实验是化学的最高法庭,它是证明化学结论的最好手段。通过化学实验引导学生进行科学探究,既是化学学习的方法,也是化学学习的重要内容,同时基于实验的实证研究是培养学生化学核心素养的重要体现。要通过实验引发学生思考,培养他们的发散思维与逆向思维。为了验证氢氧化钙的溶解度随着温度的升高而降低,在教学过程中有些教师会做下列实验:
在试管中加入约占试管容积三分之一的饱和石灰水,用酒精灯对着溶液部分加热,实验装置如图5,观察实验现象。
加热一段时间后发现试管中溶液会出现浑浊,故上课教师认为产生浑浊的原因是有氢氧化钙析出。笔者认为这样的实验设计是不严谨的,因为氢氧化钙也会和空气中的二氧化碳反应生成碳酸钙沉淀,为了增强说服力,应该在澄清石灰水上方加一层植物油液封,隔绝空气。本研究选择的实验如图6,加热液封后的澄清石灰水,如果出现浑浊,应该是氢氧化钙由于温度升高溶解度降低而析出。
同样,为证明石蜡的成分中含有碳元素,多数教师会利用燃烧的方法,并用一只内壁上浸有澄清石灰水的燒杯罩在火焰的上方,来证明石蜡燃烧的产物中是否有二氧化碳气体,从而推测石蜡中的成分是否含有碳元素。这里就有一个问题,烧杯内壁上的澄清石灰水变浑浊就一定能证明产生二氧化碳吗?其实有两种可能:一种是由于石灰水与二氧化碳反应产生碳酸钙;另一种是澄清石灰水受热氢氧化钙溶解度降低,导致析出;当然,还有可能是由于溶液中水分受热蒸发,也会使其中溶质析出。笔者在做同样的实验时,是将一只集气瓶或广口瓶罩在火焰的上方收集生成的气体,后将澄清石灰水倒入瓶内振荡,观察是否变浑浊。所以在选择化学实验时,应充分考虑实验的真实性和合理性,做到简洁明了、科学合理。
3 学会实际应用
溶解度是定量表示物质溶解性强弱的化学概念,其内涵非常丰富,必须要通过一些实际应用,来加深学生对这一概念的理解。对于溶解度的应用,可以从以下几方面思考:一是利用溶解度进行相关的定量计算,如农业上常用饱和食盐水来选种,可设置常温下配制一定质量的饱和食盐水需要的水和食盐的质量等;二是利用不同物质其溶解度随温度变化幅度不同对其混合物进行分离提纯,如氯化钠中混有少量的硝酸钾如何提纯、硝酸钾中混有少量的氯化钠如何提纯、“夏天晒盐、冬天捞碱”的原理是什么;三是从理解溶解度本身的概念内涵去应用,如海水晒盐得到的海盐中会含有一定量的氯化镁和氯化钙,实验室中为了达到提纯的目的,可以用饱和氯化钠溶液反复冲洗海盐固体,该饱和氯化钠溶液是否可以无限使用?为什么?试说明其中的原理等等。当然,还可以更多地从定量的角度去利用溶解度解释下列问题。
问题1 氢氧化钠暴露于空气中,表面会形成溶液,这是为什么?
氢氧化钠易潮解,初中化学教师都知道,但为什么易潮解,氢氧化钾能不能潮解呢?很多教师知之甚少,其实氢氧化钠易潮解也与溶解度有关,表3是20℃时含钠或钾的部分化合物在水中的溶解度。
从表中不难发现,氢氧化钠、氢氧化钾和碳酸钾的溶解度很大。笔者查阅了相关资料,发现氢氧化钾和碳酸钾都易吸湿潮解。为什么常温时溶解度大就易潮解呢?一般情况下,固体物质溶解度大,易溶于空气中的水分而潮解。
问题2 20℃时,在饱和食盐水中通入足量氨气和二氧化碳,为什么会有碳酸氢钠晶体析出?
这是侯氏制碱的方法,要解决这一问题,必须利用溶解度的相关知识。已知20℃时,NaCl的溶解度为36g/100g水,NaHCO3的溶解度为9.7g/100g水。不妨假设20℃时氯化钠饱和溶液为136g,则:
通过计算不难发现,136g氯化钠饱和溶液中通入足量氨气和二氧化碳,溶剂的质量会减少11.1g,此时最多能溶解碳酸氢钠8.6g,而生成碳酸氢钠的质量为51.7g,远大于8.6g,因此碳酸氢钠晶体会析出。当然,在混合盐溶液中,影响析出晶体的因素比较复杂,在此不再赘述。
九年级化学“溶解度”的教学既是重点,也是难点,化学教师应切实改进教学方法,学会归纳相应的知识点,注重科学性与规范化;学会选择相关的习题与化学实验,体现真实性与情境化;学会实际运用所学化学知识,关注准确性与多元化。教师要以培养学生的学科核心素养为己任,不断提高学生解决实际化学问题的能力。
参考文献:
[1][2]中学化学国家课程标准研制组. 义务教育教科书·化学(九年级下册)[M]. 上海:上海教育出版社, 2015:18, 20.
[3]陆海燕. 浅析七水硫酸亚铁溶解度引出的困惑[J]. 化学教学, 2011, (5):76.
[4][美]菲利普(Phillips J. S.)等著, 王祖浩等译. 美国高中主流理科教材·化学概念与应用[M]. 杭州:浙江教育出版社, 2008:479.
[5]James G. Speight, ph. D. Lange's Handbook of Chemistry [M]. New York:McgrawHill Sixteenth Edition, 1956.

