胃癌组织中血管拟态生成及其临床意义
戴佳文,吴健,尤小兰,王元杰,赵小军,程之逸,刘贵远,黄传江
(1.泰州市第三人民医院,江苏泰州225321;2.泰州市人民医院,江苏泰州225300)
世界范围内,胃癌是第5大恶性肿瘤,是癌症相关死亡的第3大原因[1]。全球每年新增胃癌100余万例,其中40%发生在中国,且胃癌死亡事件也主要发生在中国[2],严重威胁国人健康。以手术为主的综合治疗并没有有效地改善进展期胃癌患者的预后,进展期胃癌的患者5年整体生存率不到30%[3]。近年来,靶向VEGF受体抑制内皮细胞依赖性血管生成的单克隆抗体已成为晚期胃癌患者挽救治疗的重要途径[4]。然而,靶向VEGF信号的药物并未取得预期疗效。胃癌组织中血管拟态(Vascular Mimicry,VM)样结构的存在可能是抗内皮细胞依赖血管生成药物治疗失败的重要机制[5]。探索胃癌组织中VM样结构生成状况及其对胃癌患者预后的影响,探寻胃癌治疗的新靶点,对提高胃癌患者整体临床疗效具有重要的意义。
1 材料与方法
1.1 材料
1.1.1 临床资料我们建立了泰州地区胃肠肿瘤生物样本库,从样本库中调取了2012年6月至2013年12月在江苏省泰州市人民医院胃肠外科进行胃癌根治手术患者的石蜡标本,按照病例纳入及排除标准,最终入组130例。病例纳入标准:(1)行D2胃癌根治达R0切除;(2)术前检查无手术禁忌症;(3)术后病理资料完整;(4)术后完成半年辅助化疗;(5)临床随访资料完整。排除标准:(1)术前接受过新辅助放化疗;(2)姑息性手术;(3)伴有其他系统恶性患者;(4)合并严重基础疾病患者。患者基线资料详见表1,本组病例无围手术期死亡及严重并发症发生。根据术后病理结果,有化疗指征的患者术后4周开始进行XELOX或FOLFOX方案化疗,总疗程6个月。自患者手术后出院即开始随访,至2019年12月本课题结束,临床随访5年,共有73例(56.15%)发生转移或复发,其中69例(53.08%)患者死亡,死亡最早在手术后5个月。
1.1.2 主要仪器与试剂LEICA全自动组织脱水机(ASP300,德国莱卡);派斯杰多功能包埋机(BM450A中国常州);LEICA切片机(RM2235,德国莱卡);奥林巴斯显微镜(MPUS BX51,日本);小鼠抗CD34单克隆抗体(一抗)(abcam公司,ab8536);辣根过氧化物酶标记抗鼠/兔免疫球蛋白多聚体分子(二抗)(Dako公司);3,3-二氨基联苯胺四盐酸盐(DAB显色剂,Dako公司);透明液(北京九州柏林生物科技有限公司)。
1.2 方法
1.2.1 CD34-PAS免疫组化双重染色应用福尔马林固定、石蜡包埋的组织进行免疫组化染色均。将蜡块包埋的组织制成4μm厚度的切片。将切片在二甲苯中脱蜡,并在梯度乙醇中水化;3%的过氧化氢的甲醇溶液封闭10分钟处理内源性过氧化物酶;磷酸盐缓冲液洗涤切片3遍后在微波炉中在95°C下用柠檬酸盐缓冲液预处理20分钟进行抗原热修复;在载玻片上滴加CD34一抗(1:200)4°C孵育过夜;磷酸盐缓冲液冲洗3分钟,甩干玻片后滴加二抗,湿盒内孵育30分钟;磷酸盐缓冲液再次冲洗3分钟,甩干玻片后滴加DAB液(1:50)进行显色,室温孵育10min;DAB反应后,将切片用0.5%高碘酸溶液处理10分钟,并用蒸馏水冲洗3次,持续3分钟;Schiff溶液避光染色20分钟;显色后的切片充分水洗后放入苏木素中染5分钟后再次水洗,流水冲洗10分钟;梯度酒精丙酮浸泡后盖玻片盖好。
1.2.2 CD34-PAS双重染色的评估每个标本均进行CD34–PAS免疫组化染色3次,CD34阴性对照(省略一抗)其他操作步骤不变,阳性对照由CD34试剂供应商提供,所有切片由两位主治医师以上资深病理科医生采用MPUS BX51显微镜读片,独立诊断完成。在CD34–PAS双重染色中,VM阳性状态表现为粘多糖围成的通道样结构,PAS染色阳性,但CD34阴性,管道内可见红细胞。VM阴性状态即组织中仅可见CD34阳性表达的内皮细胞依赖血管。
1.3 数据处理及统计方法所有数据应用SPSS16.0 统计软件进行数据分析,计数资料比较采用χ2检验;计量资料用`x±s表示,采用独立样本t检验进行均数比较;采用Kaplan-Meier法进行生存分析,两组患者生存率采用Log-rank法进行比较;采用Cox回归模型法分析影响胃癌患者总生存期的危险因素。P<0.05表示差异有统计学意义。
2 结果
2.1 VM仅见于胃癌组织,胃粘膜组织中未见VM CD34-PAS免疫组化双染显示仅胃癌组织中存在VM样结构,同一张胃癌组织切片中可见内皮细胞依赖性血管和VM,VM样结构中及内皮细胞依赖性血管中均可见红细胞。相应的胃粘膜组织中仅见内皮细胞依赖血管,未见VM样结构。
2.2 胃癌组织中血管拟态生成与各临床病理特征之间关系CD34-PAS双重染色显示130例胃癌患者中31例患者胃癌组织中VM阳性表达(23.85%);其余99例为VM阴性(76.15%)。根据CD34-PAS免疫组化双染结果,将患者分为VM阳性组(31例),VM阴性组(99例),分析VM生成与胃癌患临床病理特征之间的关系,统计结果表明胃癌组织中VM生成与肿瘤大小、肿瘤分化程度,肿瘤侵袭深度、胃周淋巴结转移状态、TNM分期及脉管中有无癌栓均相关(P均<0.05,见表1)。

表1胃癌组织中VM生成与病理特征之间关系

续表
2.3 胃癌组织VM生成对患者预后的影响
2.3.1 胃癌组织中VM生成对患者OS影响VM阴性组患者总生存时间48.28±1.64月(95%CI:45.06~51.50),VM阳性组患者总生存时间24.88±2.11月(95%CI:20.75~29.01),两组OS差异有高度统计学意义(LogRank:Chi-squre=58.35,P<0.01,见图1)。
2.3.2 胃癌组织中VM生成对患者DFS的影响VM阴性组患者无复发生存时间44.88±1.88月(95%CI:41.19~48.57),VM阳性组患者无复发生存时间19.26±1.78月(95%CI:15.76~22.75),两组DFS差异有高度统计学意义(Log Rank:Chisqure=59.45,P<0.01,见图2)。

图1胃癌组织中VM生成对OS的影响

图2胃癌组织中VM生成对DFS的影响
2.4 影响胃癌患者预后的单因素分析根据患者术后生存状态,分为生存组及死亡组,比较各临床病理参数及胃癌组织中VM生成与患者生存之间的关系。单因素生存分析显示,年龄、肿瘤位置、肿瘤大小、肿瘤分化、浸润深度、胃周淋巴结转移状况、TNM分期、脉管内有无癌栓及VM生成状态是影响本组患者预后的单因素(见表2)。
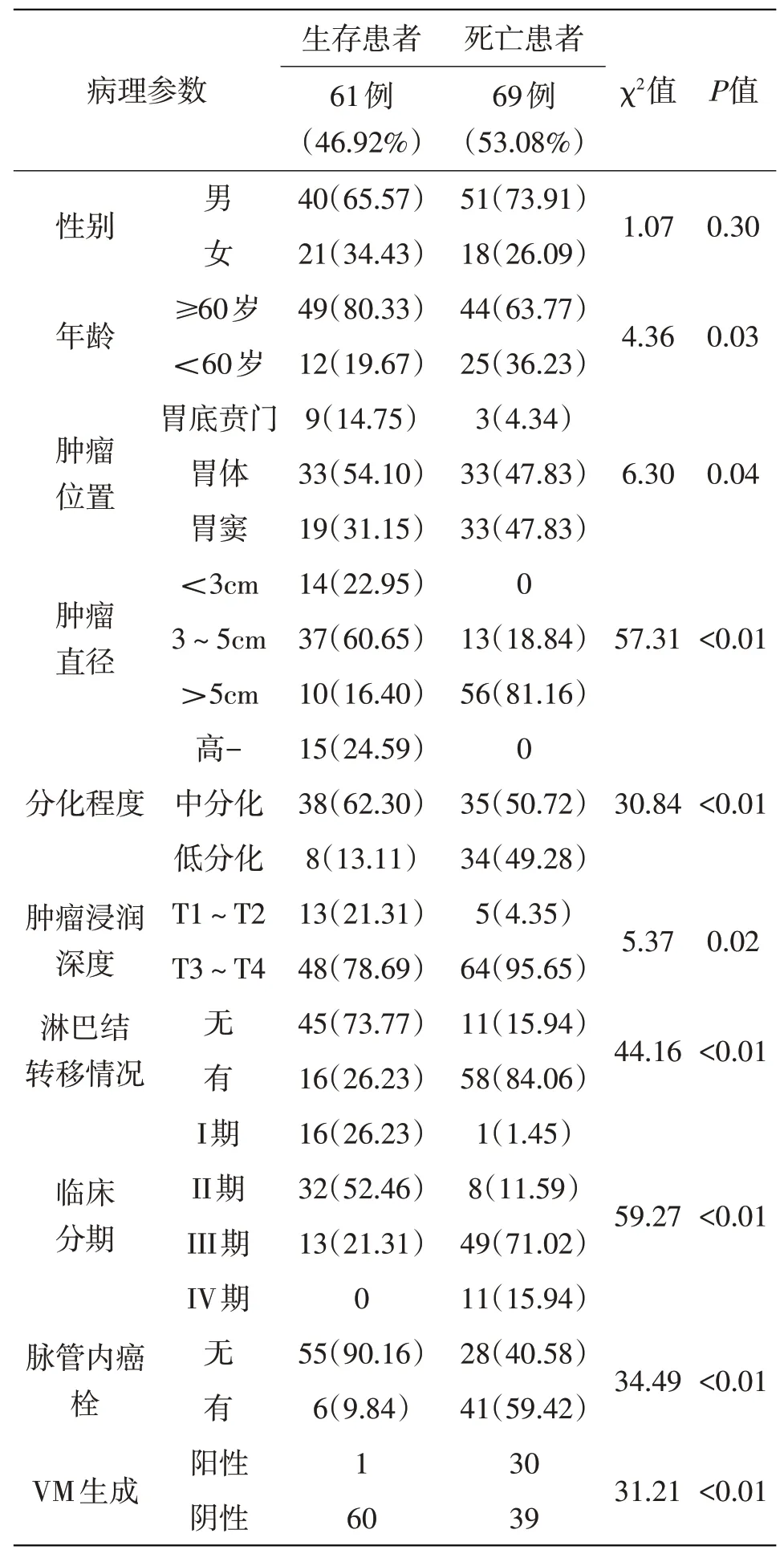
表2影响本组130例患者术后总体生存率的单因素分析
2.5 影响胃癌患者预后的多因素回归分析多因素回归分析结果显示,肿瘤分期、VM生成、肿瘤分化、脉管内有无癌栓是影响本组患者预后的独立预后因素(见表3)。

表3影响本组130例患者术后总体生存率的多因素回归分析
3 讨论
VM是指某些高度恶性肿瘤细胞通过自身变形模拟血管内皮细胞并与细胞外基质相互作用模仿血管壁结构形成可以运输血液(血浆、红细胞)的管道系统,从而重塑肿瘤微循环,并与宿主血管相连使肿瘤获得血液供应的一种现象[6]。VM具有如下特点:形成的血管管道呈簇状或图案样排列;管道内没有血管内皮细胞衬垫覆盖,免疫组化CD31/CD34染色阴性;被大量的层粘连蛋白、纤维粘连蛋白以及胶原蛋白等细胞外基质包绕,过碘酸-雪夫(Periodic Acid-Schiff,PAS)染色阳性[7]。VM是肿瘤经典血液供应的重要补充,可以为肿瘤组织提供更多的血液供应,对内皮依赖性血管是肿瘤唯一血液供应方式的传统观念提出了挑战。同时,VM的存在解释了抗血管生成靶向药物疗效不如预期的原因[5]。
1999年,Maniotis等[7]在黑素瘤中发现并定义了VM,继而更多学者在多种恶性肿瘤中均发现了此类内有红细胞但没有内皮细胞的管道样结构。VM为快速生长的肿瘤提供必需的营养物质,促进肿瘤生长,并且基于VM缺乏内皮结构,通过渗漏作用增加肿瘤灌注。此外,已有研究发现VM与内皮细胞依赖血管相通[8],促进肿瘤细胞进入血液循环,导致转移。VM样结构因缺乏内皮细胞,所以靶向内皮细胞的抗血管生成药物对其作用甚微。甚至有研究[8]发现,抗血管生成治疗使血管密度下降,导致组织乏氧,而乏氧环境促进了VM的形成,加速肿瘤进程。目前有关胃癌VM生成,以及VM在胃癌预后评估中的预测价值的报道甚少,通过检查胃癌组织中VM生成,探寻血管拟态与各临床病理参数及患者术后生存之间的关系,分析VM在胃癌预后评估中的预测价值,将为胃癌预后评估提供一个全新的方法。
本研究通过CD34-PAS免疫组化双染发现VM仅在胃癌组织中表达,胃粘膜组织中检测未发现VM,进一步佐证了VM生成与肿瘤恶性生物学行为之间的关系。本研究中,我们检查了130例胃癌患者胃癌组织标本,其中31例(23.85%)VM阳性,且VM的发生率随着胃癌进展而增加。胃癌VM生成与与肿瘤大小、肿瘤分化程度,肿瘤侵袭深度,TNM分期,胃周淋巴结转移及脉管中有无癌栓均相关,表明胃癌组织中VM生成预示患者不良预后。然而,胃癌组织中VM生成对胃癌患者术后总体生存率的影响仍存在争议,既往一项研究报道,胃癌组织中VM生成与胃癌患者的预后没有密切关系[9]。本研究通过对患者术后5年的随访分析发现,胃癌组织中VM阴性患者的5年总体生存率及无病生存率均显著高于VM阳性组患者。在进一步的研究中,我们分析了影响本组130例患者术后总体生存的单因素。单因素生存分析显示,患者年龄、肿瘤位置、肿瘤大小、肿瘤分化、浸润深度、胃周淋巴结转移状况、TNM分期、脉管内有无癌栓及VM生成是影响本组患者预后的因素。众所周知,肿瘤大小、肿瘤分化、浸润深度、胃周淋巴结转移状况、TNM分期、脉管内有无癌栓等为胃癌预后不良因素,而肿瘤的位置及患者年龄与预后的影响未见类似报道。然而,多因素回归分析结果表明胃癌患者TNM分期、肿瘤分化、脉管内有无癌栓及VM生成状况是影响本组患者术后总体生存率的独立预后因素。胃癌VM生成预示着肿瘤细胞的高侵袭性,与肿瘤的复发进展密切相关,这与既往研究结果一致[10]。
总之,胃癌组织中VM生成是胃癌患者预后不良的一项重要指标。临床检测胃癌组织中VM生成状况,有利于患者预后评估,指导患者临床治疗。此外,进一步探寻胃癌组织中VM生成机制,为胃癌术后综合治疗提供全新的靶点,有望提高胃癌患者术后整体疗效,提高进展期胃癌患者总体生存率。

