辅酶NADH与色氨酸共振能量转移的荧光动力学研究
王梦雨,曹思敏,李昊阳,张梦婕,李 栋,赵泽楠,徐建华
(华东师范大学精密光谱科学与技术国家重点实验室,上海200241)
辅酶还原型烟酰胺腺嘌呤二核苷酸(Nicotinamide adenine dinucleotide,NADH)是烟酰胺腺嘌呤二核苷酸的还原态,产生于糖酵解和细胞呼吸作用中的柠檬酸循环,在维持细胞生长、分化和细胞保护以及氧化还原反应和能量代谢过程中发挥着重要作用[1].色氨酸(Trp)作为20种氨基酸之一,是氨基酸中最主要的荧光发色团,属于非极性的芳香族氨基酸,可直接参与生物体中蛋白质的合成,是绝大多数蛋白质内源荧光的主要来源[2].
采用荧光寿命成像显微镜(FLIM)和荧光共振能量转移(FRET)技术,通过色氨酸和NADH之间的相互作用可以了解癌细胞内的代谢活性.癌细胞中葡萄糖的摄取和糖酵解进行的速度大约是正常细胞的10倍,因此,通过分析色氨酸和NADH的荧光寿命分布及两者之间的能量转移效率(Eτ,%)并与正常细胞比较,来分析癌细胞在葡萄糖刺激下的糖酵解活性,并且用抗癌药物阿霉素对癌细胞进行治疗,观察治疗前后癌细胞的代谢活性.研究发现,癌细胞在葡萄糖刺激下,结合型NADH/游离型NADH比率以及色氨酸和NADH之间的能量转移效率增加,高于正常细胞.色氨酸和NADH之间能量转移效率的增加也表明了色氨酸被猝灭,寿命减小.阿霉素治疗后,结合型NADH/游离型NADH比率减小,糖酵解和代谢活性下降.结果表明,色氨酸、NADH的荧光寿命分布以及色氨酸与NADH之间的能量转移效率都可以作为生物标志物用来观察癌细胞的代谢活性[3~5].
细胞内有多种结构类型的色氨酸,包括单体色氨酸以及多种蛋白质内的色氨酸[2],是否所有类型的色氨酸都能和NADH产生相互作用尚未见报道.并且,大多数蛋白质肽链上通常含有不止一个色氨酸分子,每个色氨酸分子对蛋白质之间、蛋白质-NADH之间相互作用的荧光贡献也不同,因而系统地分析色氨酸在不同状态下与NADH的相互作用非常必要.
荧光光谱测量技术已被广泛应用于获取与受体反应前后的生物分子(供体)的荧光寿命变化的信息[6,7].本文从时间分辨荧光光谱出发,结合紫外-可见吸收光谱和稳态荧光光谱,对不同环境下的色氨酸和辅酶NADH之间的共振能量转移荧光动力学进行了研究,并且通过荧光衰减相关光谱(DAS)对乳酸脱氢酶内色氨酸不同寿命的荧光衰减与NADH能量转移效率进行了分析.
1 实验部分
1.1 试剂与仪器
β-烟酰胺腺嘌呤二核苷酸(β-NADH,纯度98%)和丙酮酸(Pyruvic acid,纯度98%)购于上海Aladdin公司;Tris-base(纯度≥99.9%)和浓盐酸(质量分数37%)购于国药集团化学试剂有限公司;色氨酸(L-Tryptophan,纯度≥99.5%)、牛血清白蛋白(Bovine serum albumin,BSA,纯度≥98%)和兔肌肉乳酸脱氢酶(Lactate dehydrogenase,LDH,600~1200 u/mg)购于上海 Sigma-Aldrich公司;实验用水为18.2MΩ·cm去离子水.所有试剂均用Tris-HCl缓冲液(50 mmol/L Tris,150 mmol/L NaCl,pH=7.35)配置.
TU1901型紫外-可见分光光度计(北京普析通用仪器有限公司);FluoroMax-4型荧光分光光度计(日本Horiba公司);时间分辨荧光测量系统:激发光源是由PDL 800-D型驱动器(德国PicoQuant公司)控制的PLS 298型亚纳秒脉冲LED(德国PicoQuant公司),荧光衰减曲线由PMA165A-N-M型光电倍增探测器和PicoHarp 300型时间单光子技术模块(德国PicoQuant公司)探测获得.
1.2 实验方法
1.2.1 样品浓度的测定 分别配制1 mmol/L Trp的溶液,200 μmol/L BSA的溶液和40 μmol/L LDH的溶液,并分别稀释至所需浓度.将Trp和NADH以摩尔比1∶1(100 μmol/L Trp+100 μmol/L NADH)混合,BSA 和 NADH 以摩尔比 1∶3(15 μmol/L BSA+45 μmol/L NADH)以及摩尔比 1∶6(15 μmol/L BSA+90 μmol/L NADH)混合,LDH和NADH以摩尔比1∶3(15 μmol/L LDH+45 μmol/L NADH)混合. 配制完成后,将样品移取至石英比色皿中,采用紫外-可见分光光度计测量,探测范围为190~500 nm.Trp,BSA和LDH的浓度分别根据它们在280 nm处的摩尔消光系数(εTrp=5540 L·mol—1·cm—1[8],εBSA=43824L·mol—1·cm—1[9],εLDH=2×105L·mol—1·cm—1[10])测定 .
1.2.2 稳态荧光光谱的测定 取NADH溶液以及Trp-NADH,BSA-NADH,LDH-NADH混合溶液,测量NADH的稳态荧光光谱,激发波长设为340 nm,光谱分辨率设为2 nm.
1.2.3 时间分辨荧光光谱的测定 Trp,BSA以及LDH的荧光寿命由基于时间相关单光子计数技术的时间分辨荧光测量系统得到.激发波长为298 nm,重复频率为10 MHz.系统仪器响应函数通过检测水中质量分数0.34%SiO2纳米颗粒激发光的瑞利散射获得,为0.2 ns.数据拟合的准确性采用非线性最小二乘法χ2的大小来判断[11],拟合越准确,χ2越接近1.本文所有曲线数据拟合其χ2数值均在1.0左右. 分子荧光寿命的平均值(τavg)计算[6]如下:

式中,αi为与第i个荧光寿命时间常数τi对应的归一化振幅.
DAS的构建:通过拟合不同波长下各个寿命的荧光衰减曲线,再用稳态荧光光谱数据对拟合的结果进行归一化得到[7].
2 结果与讨论
2.1 水溶液中单体色氨酸和NADH之间的相互作用
FRET是两个分子的电子激发态之间的一种与距离相关的相互作用,被激发的供体分子可以将其能量转移至(一个)受体分子[11].Heikal[12]的研究表明,单体色氨酸的发射光谱和NADH的吸收光谱显著重叠;加入NADH后,单体色氨酸荧光会发生显著猝灭,由此判断NADH和单体色氨酸之间能够发生FRET.
图1(A)给出了加入NADH前后单体色氨酸的时间分辨荧光衰减曲线,IRF为仪器响应函数.可见,NADH加入前后单体色氨酸的荧光衰减曲线并未发生明显变化,供体与受体的浓度均为100 μmol/L.对衰减曲线采用了双指数函数进行拟合,拟合数据列于表1.单体色氨酸荧光的2个寿命成分分别为0.57和3 ns,占比分别为23.5%和76.5%,与文献结果一致[13,14].但是,加入NADH后,单体色氨酸的两个寿命及其对应的成分占比均未发生明显变化,平均寿命基本不变(表1).实验数据表明水溶液中单体色氨酸和NADH之间并未发生明显的FRET.将单体Trp的浓度提高至1 mmol/L,NADH浓度从100 μmol/L逐渐提高至600 μmol/L,仍与上述实验结果相同.因此,从单体色氨酸和NADH光谱重叠以及单体色氨酸的荧光被猝灭(加入NADH后)的现象[12]来判断二者之间发生FRET不正确.单体色氨酸的荧光猝灭并不是因为FRET,而是由于重吸收(内滤效应)所致,即Trp的发射光谱和NADH的吸收光谱有着显著的重叠,Trp发出的荧光会被NADH重吸收,进而导致Trp荧光强度下降.除了满足光谱重叠的条件外,实现供受体分子之间的FRET还要满足以下两个条件:(1)分子间距需足够近,也就是供受体分子的距离在1~10 nm间;(2)供体分子的发射态偶极矩和受体分子的吸收态偶极矩以及它们的向量要满足一定的条件[11].供受体之间的距离对于两者之间能否发生FRET尤其重要.

Fig.1 Fluorescence lifetime decay curves of tryptophan(A)and steady⁃state fluorescence spectra of NADH(B)
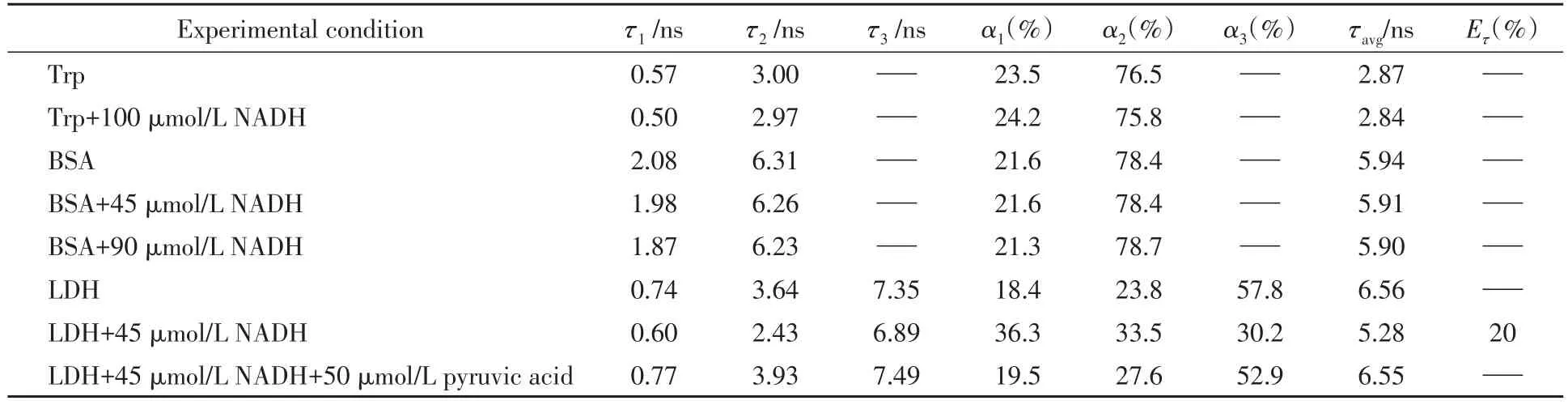
Table 1 Fluorescence lifetimes(τi),the average(τavg)and the fluorescence decay parameters(αi)of Trp,BSA and LDH with NADH and pyruvic acid
研究发现,NADH和各种脱氢酶的结合会导致NADH的荧光光谱峰值发生蓝移[15~17],因此NADH荧光光谱的位移可以间接反映其与配体的结合情况.由图1(B)可见,单体色氨酸与NADH混合后,NADH稳态荧光峰值未发生任何位移,表明单体色氨酸和NADH之间处在相对游离状态,仅仅依靠扩散作用难以发生FRET.
2.2 牛血清白蛋白和NADH之间的相互作用
大多数蛋白质的内源荧光来源主要是色氨酸.对于蛋白质荧光特性的研究主要是对色氨酸荧光特性的研究[2].图1(A)已表明单体色氨酸和NADH之间无法发生明显的FRET.为了研究含有色氨酸残基的蛋白质与NADH间的FRET,研究了BSA和NADH之间的相互作用.BSA是一种较大的球状蛋白,是血浆中最丰富的蛋白质之一.每个BSA上含有Trp-212和Trp-134 2种色氨酸残基.Trp-212位于蛋白质内的化学微环境中,Trp-134位于蛋白质的表面[18,19].
图2给出了加入不同浓度NADH前后15 μmol/L BSA的时间分辨荧光衰减曲线.可见,NADH加入后,BSA的荧光衰减曲线基本无变化.对曲线采用双指数函数进行拟合,结果如表1所示.BSA表现出2.08和6.31 ns 2个寿命成分,占比分别为21.6%和78.4%.加入不同浓度NADH后,BSA的寿命大小及其占比均未发生明显变化,平均寿命基本不变.这一现象表明了BSA和NADH之间并未发生明显的FRET.
由图1(B)可见,BSA与NADH混合后,NADH的稳态荧光光谱也未发生明显位移,表明BSA和NADH在溶液中也是处于相对游离的状态.NADH和BSA上的色氨酸之间未发生FRET.

Fig.2 Fluorescence lifetime decay curves of BSA in the absence and presence of NADH
2.3 乳酸脱氢酶和NADH之间的相互作用
LDH在人体内通常以四聚体的形式存在,具有4个完全等价的NADH结合位点,同时每个单体上都含有6个色氨酸(Trp-150,Trp-190,Trp-203,Trp-225,Trp-248,Trp-323).乳酸脱氢酶中至少有3种色氨酸,其中两种可以被NADH猝灭[20].由于LDH上存在4个NADH的结合位点,所以在LDH-NADH溶液中采用1∶3的浓度比就足以观察到猝灭现象,即15 μmol/L LDH+45 μmol/L NADH.
图3为LDH的时间分辨荧光衰减曲线.可见,加入NADH后,LDH的时间分辨荧光衰减曲线明显下降.数据表明,LDH的荧光衰减曲线至少需要3个寿命才能较好地拟合,所以采用三指数函数进行拟合(χ2<1.05),拟合结果见表1.单独LDH中色氨酸的3个寿命为0.74,3.64和7.35 ns,占比分别为18.4%,23.8%和57.8%,平均寿命为6.56 ns,与文献报道一致[20].加入NADH后,色氨酸3种寿命大小及其占比均发生了不同程度的变化,平均寿命降至5.28 ns.实验结果表明,LDH和NADH之间发生了FRET.

Fig.3 Fluorescence lifetime decay curves of LDH in the absence and presence of NADH and pyruvic acid
LDH荧光寿命的衰减主要来源于色氨酸到NADH的能量转移现象.Eτ(%)的计算[6]如下:

式中,τDA为受体存在时的供体的平均寿命;τD为供体单独存在时的寿命.计算结果表明,45 μmol/L NADH加入后,LDH和NADH之间的能量转移效率达到20%.
为了更加直观地描述LDH 3种寿命成分的变化趋势,根据时间分辨荧光衰减曲线以及稳态荧光光谱,构建了加入NADH前后LDH的DAS光谱,结果如图4所示.

Fig.4 Decay⁃associated spectra of 15µmol/L LDH(A),15µmol/L LDH+45µmol/L NADH(B)and 15µmol/L LDH+45µmol/L NADH+50µmol/L pyruvic acid(C)
DAS光谱常被用于区分溶剂弛豫和基态异质性,在色氨酸和NADH领域中被广泛应用[21,22].蓝端为正、红端为负的DAS通常反映为溶剂弛豫信号,而全部波长为正的DAS则与基态异质性有关.从图4(A)可见,LDH的3个寿命成分对应的DAS在所有测量波长处都为正值,表明这3个寿命与基态异质性相关,反映了LDH中存在至少3种不同微环境下的色氨酸荧光寿命成分[20].
由图4(B)可见,随着NADH的加入,长寿命成分(7.35 ns)的相对振幅从57.8%显著下降至30.2%,曲线明显下降.寿命衰减(至6.89 ns)的同时还伴随着振幅的显著下降,一部分色氨酸被强烈猝灭(完全猝灭或猝灭至较短寿命成分的水平),从而引起振幅减少;而另一部分色氨酸则表现出了适度猝灭,从而引起寿命的减小.LDH的短寿命成分略有下降,其相对振幅则随着NADH的加入而显著增加(从18.4%增长至36.3%),振幅的显著上升是由于其约7 ns的长寿命成分被强烈猝灭至接近约0.7 ns的水平.约4 ns的寿命成分也表现出了一定猝灭的特性,其振幅的增加则表明长寿命成分的猝灭对其也有一定贡献.可以看出,在色氨酸的3种寿命成分中,长寿命成分(7.35 ns)的衰减占据整体衰减的主要部分.同时,NADH与LDH混合后,NADH的荧光光谱峰值蓝移了近37 nm,如图1(B)所示,表明LDH和NADH处在结合状态[15~17].LDH和NADH结合后,NADH被固定在LDH的结合位点上,与LDH上的6个色氨酸之间的距离被确定,每个色氨酸和NADH之间距离均不相同.LDH-NADH复合物的晶体结构数据表明[20],虽然这6个色氨酸与NADH之间的距离都小于能量转移特征距离(R0,2.34 nm),但是在6个色氨酸中,只有Trp-248和NADH之间距离最近(1.31 nm),两者发生了显著的FRET.对比单体色氨酸和BSA与NADH之间的相互作用,单体色氨酸-NADH和BSA-NADH都处在相对游离的状态,仅仅依靠分子扩散作用,色氨酸和NADH之间并不能发生FRET.由此表明,蛋白结合位点的存在是NADH和色氨酸之间能够发生FRET的前提条件.为了进一步证实此结论,采用丙酮酸来阻断LDH和NADH之间的FRET通道.
研究发现,LDH上除了有辅酶NADH的结合位点外,还存在底物丙酮酸的结合位点[23].当丙酮酸和NADH连接到LDH上后,在LDH的催化作用下两者之间发生反应,形成非荧光的乳酸和NAD+[24].NAD+是NADH的氧化态.由图3可见,在LDH-NADH溶液中加入50 μmol/L丙酮酸后,LDH的时间分辨荧光衰减曲线回升,与单独LDH的时间荧光衰减曲线基本重合.LDH-NADH溶液中加入丙酮酸后,色氨酸的3种荧光寿命和相对振幅都普遍增加,平均寿命增至6.55 ns,与单独LDH的色氨酸平均寿命相同.同样,为了更加直观地描述色氨酸3种寿命成分的相对振幅变化趋势,构建了在LDH-NADH溶液中加入丙酮酸后,LDH的DAS谱图,如图4(C)所示.加入丙酮酸后,色氨酸长寿命成分的相对振幅从30.2%显著增至52.9%,曲线明显上升,短寿命成分的相对振幅从36.3%降至19.5%,与单独LDH寿命成分的相对振幅相近.同时,在LDH-NADH溶液中加入丙酮酸后,pH值为7.20,同之前单独LDH的pH值(pH=7.35)无显著差别,LDH的结构不会因为加酸而发生改变.DAS谱图中峰值所在波长的稳定也表明了LDH的结构并未发生改变.
可见,丙酮酸的加入未对LDH的结构产生影响.LDH中色氨酸荧光寿命回升是由于丙酮酸阻断了LDH和NADH之间发生FRET,证实了结合位点是LDH和NADH之间发生FRET的前提条件.
综上所述,本文采用时间相关单光子计数技术,探讨了不同结构类型的色氨酸和NADH之间的荧光动力学.通过时间分辨荧光光谱对单体色氨酸、BSA、LDH与NADH之间的相互作用进行了分析.结果表明,加入NADH后,3种物质只有LDH中色氨酸的荧光寿命发生明显衰减,且能量转移效率Eτ增加.根据LDH的DAS谱图的构建,对LDH中色氨酸的3个寿命成分对色氨酸与NADH之间的发生FRET的具体贡献进行了分析,发现LDH中色氨酸长寿命成分的衰减占据整体衰减的主要部分.以丙酮酸作为阻断剂,阻断LDH和NADH之间的相互作用,证实LDH上存在NADH结合位点是色氨酸与NADH之间发生FRET的前提条件.乳酸脱氢酶LDH是与细胞代谢相关的酶,利用脱氢酶和NADH之间的能量转移特性能为深入研究细胞代谢提供新思路.

