关节康片调控白细胞介素6表达促进膝关节损伤修复的机制及相关生物标志物的测定
曹厚然, 冯文俊, 陈昭, 曾意荣
(1.广东省中医院,广东广州 510120;2.广州中医药大学第一附属医院,广东广州 510405;3.广州中医药大学第五临床医学院,广东广州 510095)
膝关节损伤的修复通常根据患者伤情采取不同的方法[1-4],其中包括药物保守治疗、修复性治疗以及重建治疗等。但修复性治疗和恢复性训练一定程度上可影响患者的日常工作生活,手术治疗包括膝关节镜检或全膝关节置换手术后,存在膝关节炎加重及假体周围感染的风险,需使用抗生素控制感染,甚至需行二次翻修手术,进一步增加了患者的负担[5-7]。
膝关节损伤属于中医学 “筋伤”“骨痹” 的范畴。中医治疗膝关节损伤,可依据辨证分型,重视整体观念,调节全身气血运行,缓解局部血液循环,扶助正气,祛除外邪,达到身体的阴阳平衡,促进损伤的修复[8-10]。关节康片是本院骨科常用的院内制剂,既往临床观察与实验研究发现,该制剂对包括膝关节损伤、膝骨关节炎在内的骨伤具有较好的促进恢复作用[11-16]。然而,目前对于该恢复作用的实验验证方法较为简单,尚缺乏科学、系统、深入和可准确量化的评价方法。既往文献报道膝关节发生损伤时,损伤部位和血液中白细胞介素6(IL-6)水平发生显著变化[10,17-19],故我们推测观察关节康片干预后机体IL-6 的变化情况,能够从分子生物学水平阐释该制剂的功效机制。认为该靶标除可作为肿瘤标记物外,也对机体多种异常状态和炎症反应起到准确的标示作用,换言之,当膝关节损伤这种异常状态存在的情况下,IL-6 水平可能也会产生显著变化,研究这种变化,对明确相关治疗机制具有重要的科学意义[20-22]。同时,IL-6水平发生改变时,血液和体液内存在的多种炎症因子水平也会发生显著变化,这些炎症因子则可作为指标性成分,用于建立关节康片促进膝关节损伤修复功效评价的标志物。基于此假说,进行如下研究:
1 材料
1.1动物SPF 级昆明种小鼠30 只,雌雄各半,体质量(20 ± 2)g,购自广东省实验动物中心,许可证号:SCXK(粤)2018-0002,动物质量合格证号:440072000066136。于广东省中医药工程技术研究院SPF 级动物实验室饲养,设施使用许可证号:SYXK(粤)2015-0059。
1.2药物、试剂与仪器关节康片,由广州中医药大学第一附属医院制备,每片0.25 g。酶联免疫吸附分析(ELISA)活性筛选所用试剂盒购自美国DPC 公司;LXB4(纯度98%,批号:ZC-22879)、PGE1(纯度98%,批号:ZC-20827)、(±)12-HETE(纯度98%, 批号: ZC-22942)、±5(6)DiHET(纯度98%,批号:ZC-23000)、PGE2(纯度98%,批号:ZC-21245)等对照品购自上海甄准生物科技有限公司;胡椒碱对照品(内标,批号:110775-201706)购自中国食品药品检定研究院;ELISA 分析、液相色谱-质谱联用(LC-MS)法分析和样品处理所用二甲基亚砜(DMSO)、乙腈、甲醇、甲酸等试剂均为色谱纯,购自德国Merck 公司。Thermo-TSQ Quantum 高效液相色谱-质谱联用(HPLC-MS)仪,配备ESI 离子源、Accela 高压泵-自动进样器系统(美国Thermo- Fisher 公司); 色谱柱为AgilentSB-C18(规格2.1 mm × 100 mm,粒径2.7 μm,美国Agilent 公司);Varioskan Flash 全波长多功能酶标仪(美国Thermo-Fisher公司)。
2 方法与结果
2.1动物实验
2.1.1 分组、造模与给药 将30只小鼠分为空白对照组(6只)和造模组(24只)。空白对照组,不进行任何处理,给予正常饮食。造模组小鼠参考Fang等[1]的方法建立膝关节损伤小鼠模型:给予小鼠腹腔注射10 g/L 戊巴比妥钠(50 mg/kg)麻醉后,置于手术台上,以0.2 mm 直径钢针穿刺,后取出钢针,用酒精清洗伤口,止血夹止血30 min,注射青霉素(4 万单位),连续注射7 d。然后将这些造模小鼠分为模型对照组,关节康低、中、高剂量组,每组6 只。模型对照组止血并注射青霉素后,每日给予10 mL生理盐水灌胃,关节康低、中、高剂量组每日给予450、900、1 800 mg/kg剂量(以药片粉末质量计,下同)的关节康溶液(药片粉末溶于生理盐水后滤过)灌胃,连续7 d。第8 天,将空白对照组小鼠全部处死,其余各组随机选取3只处死。未处死动物中,原属模型对照组的小鼠继续正常饲育(此设为模型对照观察组),原给予低、中、高剂量关节康溶液的各给药组停止给药,正常饲育(此设为关节康低、中、高剂量观察组),继续观察各组小鼠恢复状况,以能正常行走者示恢复,记录每只动物恢复的时间,并在确认恢复后处死动物。
2.1.2 ELISA 法检测小鼠血浆、膝关节匀浆IL-6含量 取各组小鼠血浆和膝关节匀浆液样品,置于96 孔板中, 每组每个基质3 孔, 参照IL- 6 ELISA试剂盒说明方法处理。应用酶标仪测定,以空白对照组为参比,计算相对表达值。所得结果代入SPSS 17.0统计软件进行方差分析(ANOVA)检验。2.1.3 IL-6 含量检测结果 图1 结果显示:术后第8 天,模型对照组血浆和膝关节匀浆液IL-6 水平较空白对照组明显升高(P <0.01),关节康各给药组中,除低剂量组,其余2 组的IL-6 水平均较模型对照组显著上升(P <0.01),且有剂量依赖性,同时血浆与膝关节匀浆液中IL-6 水平无显著性差异(P >0.05)。
观察至恢复的动物中,IL-6 水平相较术后第8 天处死的相同方法处理组回落明显(P <0.01),其结果同样具有剂量依赖性,血浆与膝关节匀浆液中IL-6水平亦无显著性差异(P >0.05)。
上述结果表明,关节康片可能通过调控体内IL-6表达起到促进膝关节损伤修复的功效。

图1 各组小鼠血浆、膝关节匀浆IL-6含量比较(x ± s,n = 3)Figure 1 Comparison of IL-6 content in plasma and knee joint homogenate in various groups(x ± s,n = 3)
2.2 LC-MS测定IL-6相关炎症因子根据研究[22-23]报道,我们选择了LXB4等5个炎症因子,建立了LC-MS 同时测定方法,并进行生物样品分析方法学考察。
2.2 .1 制备IL-6相关炎症因子混合对照品溶液 取LXB4、 PGE1、(±)12- HETE、 ± 5(6)DiHET、PGE2 对照品,精密称定,置于同一容量为10 mL量瓶中,加甲醇溶解并定容至刻度,即得各对照品含量均为100 μg/mL的溶液。
2.2.2 供试品溶液的制备 精密吸取血浆或膝关节匀浆液100 μL,置于Captiva ND 96 孔板(孔径0.2 μm)中。每个实验组每个基质各6 孔,每孔精密加入300 μL 含100 ng/mL 胡椒碱(内标)的乙腈,封口后抽滤,滤液收集于接收盘中,封口膜密封,备用。
2.2.3 LC-MS 测定条件 使用ESI 离子源,正负离子同时扫描的选择离子反应模式(SRM),喷雾电压3 500 V(正离子)/3 000 V(负离子),雾化室温度350 ℃,离子传输管温度300 ℃,鞘气压力30 psi,辅气压力10 psi,各待测炎症因子的离子对、管径补偿(Tube Length Offset)电压和碰撞能量(CE)见表1。色谱条件:使用Agilent SB-C18色谱柱,乙腈(A)-0.1%甲酸水溶液(B)为流动相,梯度洗脱。程序:0 ~1.5 min,5% ~5% A;1.5 ~2.0 min,5% ~100% A; 2.0 ~5.0 min, 100% ~100% A;5.0 ~5.5 min,100% ~5% A;5.5 ~7.5 min,5% ~5% A。进样量10 μL,柱温25 ℃。混合对照品和供试品的离子流图见图2。
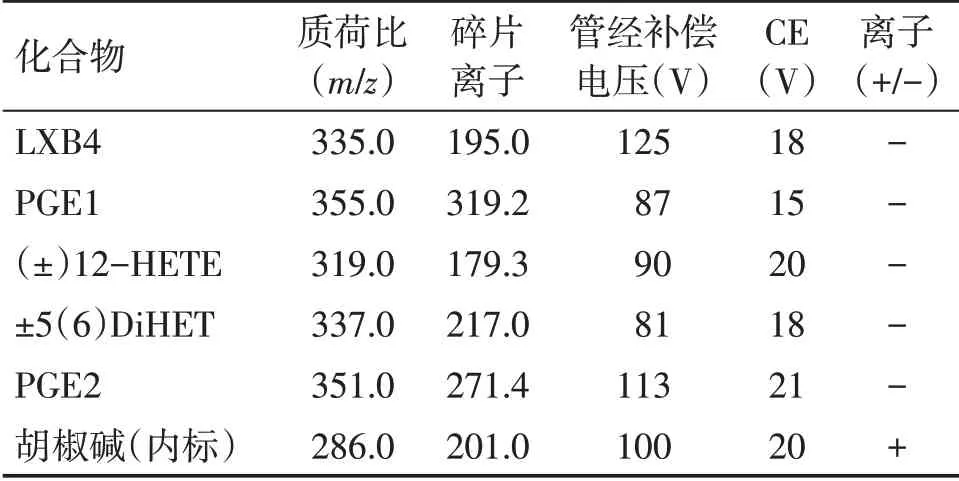
表1 各炎症因子及内标质谱扫描参数Table 1 Mass scan parameters of various inflammatory factors and internal standard
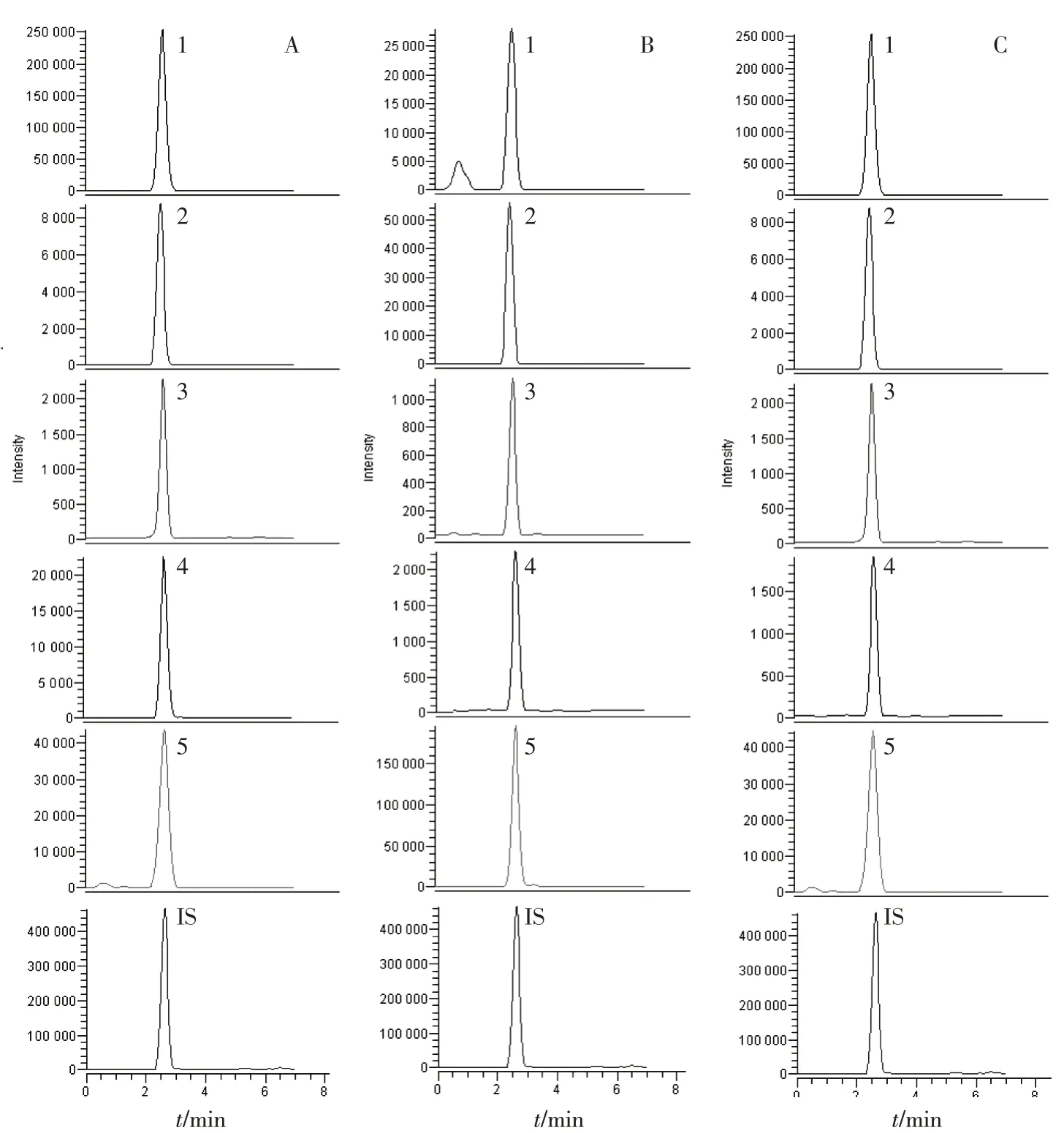
图2 各炎症因子LC-MS离子流图Figure 2 LC-MS ion current chromatograms for various inflammatory factors
2.2.4 炎症因子测定方法学考察
2.2.4.1 线性和灵敏度 取混合对照品溶液,分别精密吸取适量至8个1.5 mL离心管中,加生理盐水适量稀释,即得各化合物浓度分别为2、5、10、20、50、100、200、500 ng/mL 的溶液。取上述溶液,按 “2.2.2” 项下方法进行处理。按照“2.2.3”项下LC-MS 测定方法进样分析, 结果代入LC-Quan 软件(美国Thermo-Fisher 公司)中。以峰面积比为横轴x,浓度为纵轴y,所得各炎症因子的回归方程和相关系数见表3。
为考察灵敏度,取对照品溶液,加生理盐水逐级稀释,按 “2.2.2” 项下方法进行处理,按照“2.2.3” 项下LC-MS测定方法进样分析,至信噪比(S/N)<10。 结果显示, 各成分的最低定量限(LLOQ)在0.1 ~1.0 ng/mL 范围内。为便于考察,将LLOQ 样品浓度统一定为1.0 ng/mL,平行制备6 份溶液,按照 “2.2.3” 项下LC-MS测定方法进样分析,记录各待测物峰面积,计算回收率和回收率的相对标准偏差(RSD,sR)。结果显示,LLOQ样品的平均回收率为88.79%~103.91%,sR为5.88%~14.24%。具体结果见表3。
上述结果表明,本研究所建立的LC-MS 方法可在2 ~500 ng/mL 对各待测物进行准确测定,且灵敏度良好。
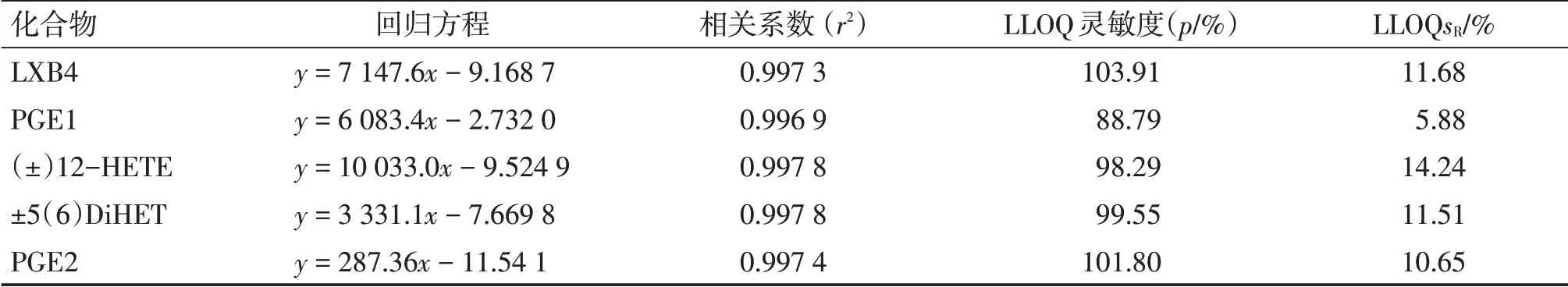
表3 线性与灵敏度Table 3 Linearity and sensitivity (n = 6)
2.2.4.2 精密度和准确度 取混合对照品溶液,精密吸取适量至1.5 mL 离心管中,精密加入生理盐水适量,配制成各炎症因子含量分别为5、50、400 ng/mL的溶液,记为QC样品,每个浓度平行制备6份。取上述样品,按 “2.2.2” 项下方法进行处理,按照 “2.2.3” 项下LC-MS 测定方法进样分析,记录各待测物峰面积,计算回收率和回收率的sR。结果显示,样品的平均回收率为96.27% ~106.08%,sR为2.94% ~10.44%,表明本方法精密度和准确度良好。具体结果见表4。
2.2.4.3 稳定性考察 按 “2.2.4.2” 项下方法制备QC 样品,共制备4 组,分别按如下方法处理:①常温稳定性:样品置于常温(25 ℃)8 h;②进样器稳定性:样品置于LC-MS自动进样器中(温度设置为4 ℃)2 h;③冻融稳定性:样品于-20 ℃冻存,取出融化,如此重复3 个循环;④长期稳定性:样品于-20 ℃冻存30 d后,取出融化。上述各组样品完成相应处理后,按 “2.2.2” 项下方法制备供试品溶液,按照 “2.2.3” 项下LC-MS 测定方法进样分析,记录各待测物峰面积,计算回收率和回收率的sR。结果显示,样品的平均回收率为90.82% ~106.26%,sR为4.23% ~12.66%,表明本方法所制备的样品稳定性良好。具体结果见表5 ~表8。
表4 精密度和准确度测定结果Table 4 The detection results of precision and accuracy ( ± s,n = 6)

表4 精密度和准确度测定结果Table 4 The detection results of precision and accuracy ( ± s,n = 6)
化合物LXB4 PGE1(±)12-HETE±5(6)DiHET PGE2标示浓度[ρ/(ng·mL-1)]5.000 50.000 400.000 5.000 50.000 400.000 5.000 50.000 400.000 5.000 50.000 400.000 5.000 50.000 400.000测得浓度[ρ/(ng·mL-1)]4.999 ± 0.306 49.557 ± 4.338 404.158 ± 39.162 4.852 ± 0.409 51.531 ± 4.812 424.310 ± 35.026 4.985 ± 0.400 49.958 ± 1.471 424.310 ± 35.026 4.855 ± 0.507 48.135 ± 3.917 393.755 ± 23.613 4.996 ± 0.313 51.035 ± 5.317 405.169 ± 30.741回收率(p/%)99.98 99.11 101.04 97.04 103.06 106.08 99.69 99.92 106.08 97.10 96.27 98.44 99.91 102.07 101.29 sR/%6.11 8.75 9.69 8.42 9.34 8.25 8.02 2.94 8.25 10.44 8.14 6.00 6.27 10.42 7.59
2.2.4.4 基质效应考察 取混合对照品溶液,按“2.2.4.2” 项下各浓度,加甲醇稀释制备QC 样品,取所得溶液,按 “2.2.2” 项下方法制备供试品溶液,按照 “2.2.3” 项下LC-MS 测定方法进样分析,记录各待测物峰面积,计算回收率和回收率的sR。结果显示,样品的平均回收率为92.61%~106.73%,sR为4.67%~13.13%,表明样品基质对测定不存在明显影响。具体结果见表9。
表5 常温稳定性考察结果Table 5 The results of room temperature stability ( ± s,n = 6)
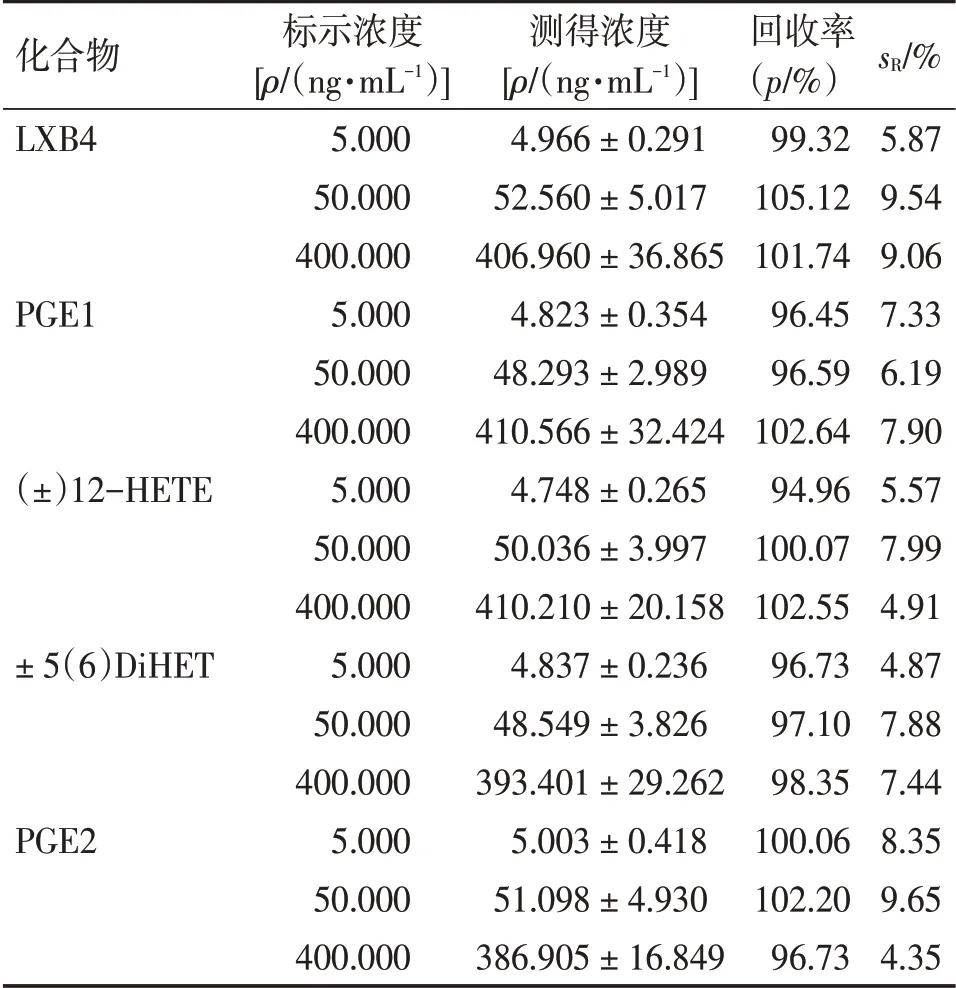
表5 常温稳定性考察结果Table 5 The results of room temperature stability ( ± s,n = 6)
化合物LXB4 PGE1(±)12-HETE± 5(6)DiHET PGE2标示浓度[ρ/(ng·mL-1)]5.000 50.000 400.000 5.000 50.000 400.000 5.000 50.000 400.000 5.000 50.000 400.000 5.000 50.000 400.000测得浓度[ρ/(ng·mL-1)]4.966 ± 0.291 52.560 ± 5.017 406.960 ± 36.865 4.823 ± 0.354 48.293 ± 2.989 410.566 ± 32.424 4.748 ± 0.265 50.036 ± 3.997 410.210 ± 20.158 4.837 ± 0.236 48.549 ± 3.826 393.401 ± 29.262 5.003 ± 0.418 51.098 ± 4.930 386.905 ± 16.849回收率(p/%)99.32 105.12 101.74 96.45 96.59 102.64 94.96 100.07 102.55 96.73 97.10 98.35 100.06 102.20 96.73 sR/%5.87 9.54 9.06 7.33 6.19 7.90 5.57 7.99 4.91 4.87 7.88 7.44 8.35 9.65 4.35
表6 进样器稳定性考察结果Table 6 The results of bench-top stability( ± s,n = 6)

表6 进样器稳定性考察结果Table 6 The results of bench-top stability( ± s,n = 6)
化合物LXB4 PGE1(±)12-HETE±5(6)DiHET PGE2标示浓度[ρ/(ng·mL-1)]5.000 50.000 400.000 5.000 50.000 400.000 5.000 50.000 400.000 5.000 50.000 400.000 5.000 50.000 400.000测得浓度[ρ/(ng·mL-1)]5.038 ± 0.480 48.200 ± 3.650 399.511 ± 26.548 4.972 ± 0.536 51.876 ± 3.666 401.854 ± 47.188 4.552 ± 0.227 48.461 ± 4.593 422.761 ± 28.709 4.743 ± 0.309 49.765 ± 5.019 407.941 ± 39.696 4.943 ± 0.432 52.936 ± 2.105 404.978 ± 39.477回收率(p/%)100.75 96.40 99.88 99.45 103.75 100.46 91.05 96.92 105.69 94.87 99.53 101.99 98.87 105.87 101.24 sR/%9.53 7.57 6.65 10.79 7.07 11.74 4.98 9.48 6.79 6.50 10.09 9.73 8.74 3.98 9.75
2.2.4.5 各组血浆与膝关节匀浆液中IL-6相关炎症因子含量比较 取 “2.2.2” 项下制备的供试品溶液,按照 “2.2.3” 项下LC-MS 测定方法进样分析,记录各待测物峰面积,计算含量并将含量结果代入SPSS 软件中使用Student-T进行检验分析。结果显示:在空白对照组与术后第8天处死的模型对照组中,各炎症因子的含量存在明显差异(P<0.05 或P<0.01);术后第8 天处死的各给药组中,除低剂量组外,其余2组炎症因子含量均较模型对照组明显下降(P<0.05 或P<0.01)。各观察组的测定结果则与空白对照组无明显差异(P>0.05);同一处理组中不同基质的结果存在显著性差异(P<0.05),但变化趋势基本相同。上述结果表明,本研究所选用的5个炎症因子可以作为评价膝关节损伤及关节康片在其中所起作用的生物指标。具体结果见图3。
表7 冻融稳定性考察结果Table 7 The results of freeze-thaw stability( ± s,n = 6)
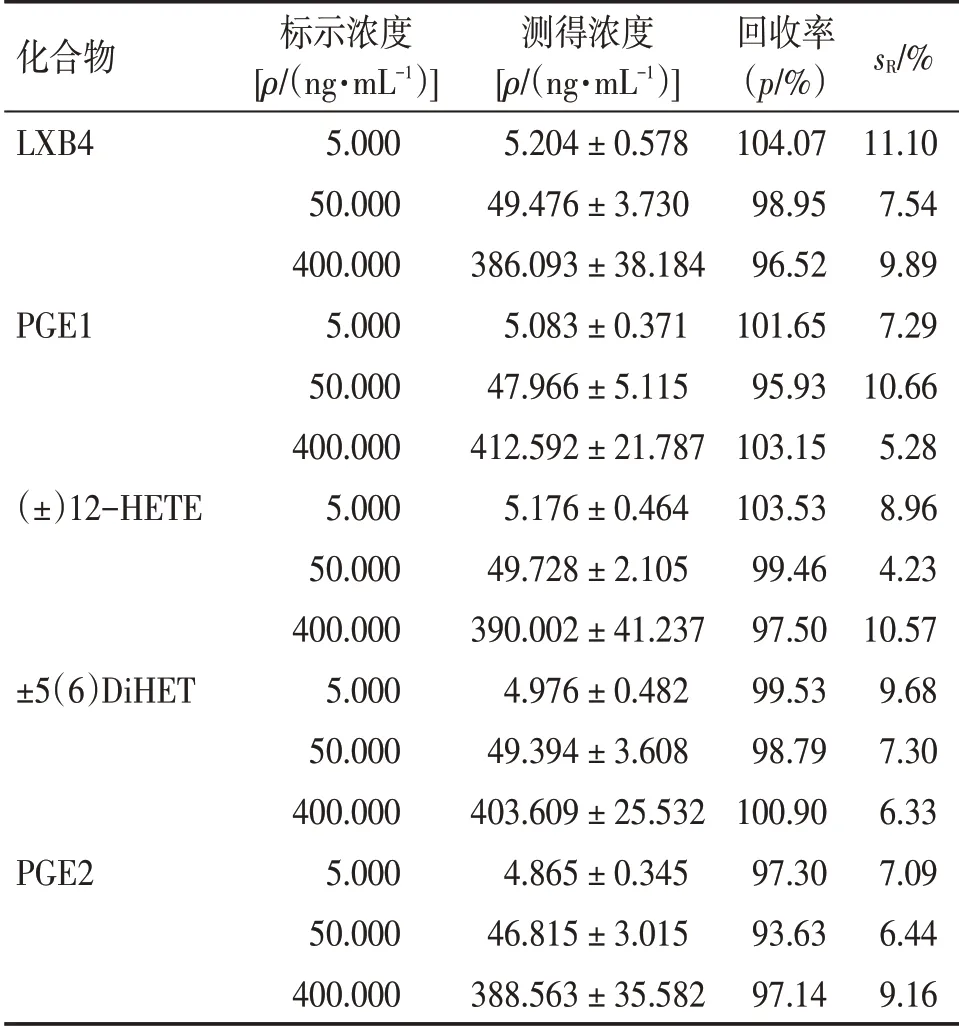
表7 冻融稳定性考察结果Table 7 The results of freeze-thaw stability( ± s,n = 6)
化合物LXB4 PGE1(±)12-HETE±5(6)DiHET PGE2标示浓度[ρ/(ng·mL-1)]5.000 50.000 400.000 5.000 50.000 400.000 5.000 50.000 400.000 5.000 50.000 400.000 5.000 50.000 400.000测得浓度[ρ/(ng·mL-1)]5.204 ± 0.578 49.476 ± 3.730 386.093 ± 38.184 5.083 ± 0.371 47.966 ± 5.115 412.592 ± 21.787 5.176 ± 0.464 49.728 ± 2.105 390.002 ± 41.237 4.976 ± 0.482 49.394 ± 3.608 403.609 ± 25.532 4.865 ± 0.345 46.815 ± 3.015 388.563 ± 35.582回收率(p/%)104.07 98.95 96.52 101.65 95.93 103.15 103.53 99.46 97.50 99.53 98.79 100.90 97.30 93.63 97.14 sR/%11.10 7.54 9.89 7.29 10.66 5.28 8.96 4.23 10.57 9.68 7.30 6.33 7.09 6.44 9.16
表8 长期稳定性考察结果Table 8 The results of long-term stability ( ± s,n = 6)
化合物LXB4 PGE1(±)12-HETE±5(6)DiHET PGE2标示浓度[ρ/(ng·mL-1)]5.000 50.000 400.000 5.000 50.000 400.000 5.000 50.000 400.000 5.000 50.000 400.000 5.000 50.000 400.000测得浓度[ρ/(ng·mL-1)]4.951 ± 0.470 53.128 ± 3.227 381.295 ± 48.286 4.938 ± 0.381 50.389 ± 5.229 402.506 ± 26.958 4.957 ± 0.395 51.134 ± 3.026 397.357 ± 41.768 5.081 ± 0.463 49.947 ± 4.537 363.299 ± 30.095 4.884 ± 0.227 47.769 ± 5.028 408.560 ± 40.111回收率(p/%)99.02 106.26 95.32 98.75 100.78 100.63 99.14 102.27 99.34 101.62 99.89 90.82 97.67 95.54 102.14 sR/%9.50 6.07 12.66 7.71 10.38 6.70 7.96 5.92 10.51 9.10 9.08 8.28 4.64 10.53 9.82
表9 基质效应考察结果Table 9 The results of matrix effect ( ± s,n = 6)

表9 基质效应考察结果Table 9 The results of matrix effect ( ± s,n = 6)
化合物LXB4 PGE1(±)12-HETE±5(6)DiHET PGE2标示浓度[ρ/(ng·mL-1)]5.000 50.000 400.000 5.000 50.000 400.000 5.000 50.000 400.000 5.000 50.000 400.000 5.000 50.000 400.000测得浓度[ρ/(ng·mL-1)]5.169 ± 0.662 49.475 ± 5.305 412.456 ± 19.250 5.132 ± 0.451 49.591 ± 2.847 425.809 ± 19.964 5.337 ± 0.378 50.113 ± 4.296 396.538 ± 52.049 5.243 ± 0.237 46.305 ± 2.259 425.273 ± 48.700 5.161 ± 0.415 48.330 ± 4.537 385.689 ± 37.530回收率(p/%)103.39 98.95 103.11 102.63 99.18 106.45 106.73 100.23 99.13 104.86 92.61 106.32 103.22 96.66 96.42 sR/%12.81 10.72 4.67 8.78 5.74 4.69 7.08 8.57 13.13 4.52 4.88 11.45 8.04 9.39 9.73
3 讨论
关节康片是以熟地、补骨脂、杜仲、枸杞子、丹参、川芎、红花等中药配伍而成的制剂,旨在补肾壮骨,活血止痛,以治疗膝骨关节炎等膝关节损伤疾患[11]。本研究结果显示,关节康片可明显加速小鼠膝关节损伤的康复,缩短其恢复正常行走的时间。

图3 各组血浆和膝关节匀浆液中IL-6相关炎症因子含量比较(n = 6)( ± s)Figure 3 Comparison of the contents of IL-6-related inflammatory factors in plasma and knee joint homogenate in various groups(n = 6)( ± s)
IL-6 是参与骨髓间充质干细胞软骨定向分化的重要调节因子,有研究表明,IL-6 与膝骨关节炎的发生相关[23-24]。本研究结果亦显示,IL-6表达与膝关节损伤之间存在关联性。当机体发生膝关节损伤时,血浆与膝关节匀浆液IL-6 表达被激活,抑制膝关节损伤部位坏死;在手术后和自然修复过程中,IL-6 水平逐渐降低至正常;服用关节康片后,IL-6 水平出现上升,停药后恢复正常。说明该制剂可能通过刺激IL-6 释放和在膝关节损伤部位富集促进膝关节损伤修复,故认为该指标可以作为评价膝关节损伤及修复的重要参考。
针对IL-6指标,目前主要采用ELISA法或RTPCR法进行测定,但此2种方法存在准确度不够的问题,而基于该指标成分的理化特性,目前尚无更为精密、准确的仪器方法可对其进行分析。为解决上述问题,基于文献调研结果[13-15],笔者提出测定IL-6 相关体内炎症因子用于评价不同实验组IL-6水平的方法,所选取的指标成分既有市售对照品,又可使用LC-MS 进行同时、快速、准确的测定。
本研究选择的5 个炎症因子与体内IL-6 水平密切相关。既往代谢组学研究结果[21]显示,拔罐后实验动物血液和周围皮肤组织中,上述内源性代谢物水平明显高于对照组。且这些成分均为文献报道较多的调控炎症脂质介质,在其水平显著变化时,IL-6 水平也会随之出现明显变化,上述情况在病变/损伤部位尤为明显[22-23]。因此选择LXB4等5个炎症因子作为本研究的疗效评价指标具有较好的科学性和针对性。
本研究对不同基质(血浆、膝关节匀浆液)中各炎症因子水平的测定结果表明,其变化趋势基本相同。产生上述情况的原因,可能与损伤修复的机制有关,即可将损伤修复看作代谢反应,血液则在其中扮演了中介和传输管道的作用,IL-6则通过血液循环到达受体产生反应。在临床实践中,由于患者膝关节组织和关节液取样极为困难,血液中炎症因子水平的指向性作用,可以大幅降低病程和疗效评价的难度,实现对治疗全过程更为精准的把控。
综上所述,本研究阐释了血浆与膝关节匀浆液中的IL-6 水平与膝关节损伤及其修复的关联性,并以此说明了关节康片促进膝关节损伤修复的机制。同时通过测定IL-6 相关炎症因子探讨了产生这一机制的生物学基础,并建立了快速、准确、可量化的评价方法,可以为膝关节损伤和修复过程以及关节康片的功效评价提供研究经验和科学依据。

