杜仲极细粉与传统饮片有效成分溶出行为及大鼠药动学比较研究
林上阳 周雅倩 谢辉 李伟东
摘要 目的:研究杜仲Eucommia ulmoides Oliv.極细粉与传统饮片的体外溶出度及其在大鼠体内的生物利用度,揭示杜仲极细粉碎后主要活性成分的体内外溶出的变化,为杜仲极细粉的质量标准的制定提供科学依据。方法:激光粒度分析仪测定杜仲极细粉的粒径;HPLC法测定杜仲极细粉与传统饮片有效成分在不同溶出介质中溶出度。UPLC-MS/MS测定杜仲京尼平苷酸的血药浓度变化。结果:杜仲极细粉有效成分溶出总量都显著高于杜仲传统饮片(P<0.05),杜仲传统饮片有效成分的溶出度和溶出速率均低于极细粉(P<0.05)。京尼平苷酸在大鼠体内的血药浓度-时间数据符合二室模型,权重为1,高剂量极细粉组和高剂量水煎液组的主要药动学参数为MRT(0-t)=(241.498±20.678)min和(135.084±13.571)min;Tmax=(132±26.833)min和(65±12.247)min;Cmax=(231.8±80.111)μg/L和(435.167±208.696)μg/L;AUC(0-t)=(61 947.696±27 073.105)μg/(L·min)和(63 212.803±31 981.087)μg/(L·min);AUC(0-∞)=(62 327.808±27 079.977)μg/(L·min)和(63 910.596±31 686.357)μg/(L·min)。结论:杜仲极细粉碎后能显著增加有效成分的溶出度和显著提高有效成分的溶出速率,且可以增加京尼平苷酸在大鼠体内的停留时间。杜仲传统饮片制备成极细粉具备可行性。
关键词 杜仲;极细粉;传统饮片;溶出度;生物利用度;京尼平苷酸;高效液相色谱法;超高效色谱-串联质谱
Abstract Objective:To study the in vitro dissolution rate of Eucommia ulmoides Oliv.ultrafine powder and traditional decoction pieces and its bioavailability in rats,and to reveal the changes in the in vivo and in vitro dissolution of the main active ingredients of Eucommia ulmoides Oliv.The formulation of quality standards provides a scientific basis.Methods:Laser particle size analyzer was used to determine the particle size of Eucommia ulmoides ultrafine powder; HPLC method was used to determine the dissolution of the effective components of Eucommia ulmoides ultrafine powder and traditional decoction pieces in different dissolution media.UPLC-MS/MS was used to determine the blood concentration of Eucommia geniposide.Results:The total dissolution of active ingredients of Eucommia ulmoides extra-fine powder was significantly higher than that of traditional eucommia ulmoides(P<0.05).The dissolution rate and dissolution rate of active ingredients of eucommia ulmoides traditional decoction pieces were lower than those of ultrafine powder(P<0.05).The plasma concentration-time data of geniposide in rats conformed to the two-compartment model,with a weight of 1.The main pharmacokinetic parameters of the high-dose ultrafine powder group and the high-dose decoction group were MRT(0-t)=(241.498±20.678)and(135.084±13.571)min; Tmax=(132±26.833)and(65±12.247)min; Cmax=(231.8±80.111)and(435.167±208.696)μg/L; AUC(0-t)=(61 947.696±27 073.105)and(63 212.803±31 981.087)μg/(L·min); AUC(0-∞)=(62 327.808±27 079.977)and(63 910.596±31 686.357)μg/(L·min).Conclusion:Eucommia ulmoides can significantly increase the dissolution rate of the active ingredients and the dissolution rate of the active ingredients after extremely fine pulverization,and can increase the residence time of geniposide acid in rats.Traditional decoction pieces of Eucommia ulmoides can be prepared into very fine powder.
Keywords Eucommia ulmoides; Ultra-fine powder; Traditional decoction pieces; Dissolution; Bioavailability; Geniposide acid; High performance liquid chromatography; Ultra performance chromatography-tandem mass spectrometry(Chinese keywords please use Chinese)
中图分类号:R284.1文献标识码:Adoi:10.3969/j.issn.1673-7202.2020.21.006
杜仲为杜仲科植物杜仲Eucommia ulmoides Oliv的干燥树皮,是我国一种名贵珍稀的滋补类药材,有补肝肾、安胎、强筋骨等功效[1-2]。杜仲作为一种皮类药材,其皮中独有的细密、富弹性的橡胶丝决定其有效成分比较难于溶出[3],超微粉碎技术是一种利用机械或流体动力的方法,把原材料加工成微米级甚至纳米级的超微粉的技术方法,使药材比表面积增加,孔隙率增大,使有效成分的溶出速度和溶出率提高,从而加快起效速度并增强疗效[4];利用超微粉碎技术,用小于原处方的药量即可获得原处方的疗效[5]。本实验运用HPLC法测定杜仲极细粉与传统饮片中的有效成分京尼平苷酸(GPA)、京尼平(GP)和松脂醇二葡萄糖苷(PDG)在3种不同溶出介质中的溶出行为[6],采用UPLC-MS/MS测定大鼠体内京尼平苷酸的血药浓度,比较杜仲级细分和传统饮片在大鼠体内的药代动力学参数,以期揭示杜仲经极细粉碎后主要成分在体外和体内的变化规律及其生物利用度,为杜仲极细粉的临床应用提供科学依据。
1 仪器与试药
1.1 仪器 贝利微粉机(济南倍力粉技术工程有限公司,型号:BFM-T6BI);超声波清洗器(昆山市超声仪器有限公司,型号:KQ-500E);多功能粉碎机(永康市铂欧五金制品有限公司,型号:2000Y);万分之一天平(日本岛津公司,日本,型号:ATY 124);激光粒度分析仪(贝克曼库尔特有限公司,美国,型号:LS 13320);高效液相色谱仪(配备PDA检测器,Waters公司,美国,型号:Waters e2695);智能溶出试验仪(天津天大天发科技有限公司,型号:ZRS-8G);旋转蒸发仪(Buchi有限公司,瑞士,型号:R100);离心机(美国Thermo公司,美国,型号:Mirocl 17);电热鼓风干燥箱(上海精宏实验设备有限公司,型号:DHG-9140A);旋蒸仪(Buchi有限公司,瑞士,型号:R210);试管振荡器(Heidolph有限公司,德国,型号:Multi Reax);真空离心浓缩仪(Labconco CentriVap,美国,型号:CentriVap Complete Vacuum Concentrators);液相色谱输液泵(日本岛津公司,日本,型号:LC-10ATvp);MS系统三重四级杆色谱仪(AB Sciex公司,美国,型号:AB5500)。
1.2 试剂 京尼平苷酸对照品(质量分数为98%,南京世洲生物科技有限公司,批号:27741-01-1);京尼平对照品(质量分数为98%,南京世洲生物科技有限公司,批号:6902-77-8);松脂醇二葡萄糖苷对照品(质量分数为98%,南京世洲生物科技有限公司,批号:63902-38-5);葛根素(质量分数为98%,南京世洲生物科技有限公司,批号:20180203);胃蛋白酶(酶活力1∶10 000,100 g,福建飞净生物科技有限公司,批号:181015);胰蛋白酶(酶活力1∶250,100 g,福建飞净生物科技有限公司,批号:181015);氢氧化钠(分析纯,500 g,南京化学试剂有限公司,批号:10091721035);磷酸二氢钾(分析纯,500 g,广东光华科技股份有限公司,批号:20140520);盐酸(分析纯,4 L,上海凌峰化学试剂有限公司,批号:20140220);甲醇(色谱純,4 L,Tedia Company,美国,批号:20035159);甲酸(色谱纯,500 mL,Acslabchem,美国,批号:C10332080)。
1.3 分析样品 杜仲药材(采购于四川成都,经南京中医药大学陈建伟教授鉴定为杜仲科植物Eucommia ulmoides Oliv.的干燥树皮),生产日期分别为2017年2月4日(第1批批号:20170204)、2017年4月22日(第2批批号:20170422)、2017年6月5日(第3批批号:20170605)。
1.4 实验动物 雄性SD大鼠,SPF级,体质量180~220 g,购于南京中医药大学实验动物中心,许可证号:SCXK(浙)2004-0001。动物饲养在饲养温度为20 ℃,相对湿度为60%,每天光照12 h的环境中。本实验动物饲养于南京中医药大学药物安全评价中心,所有动物相关研究均符合南京中医药大学动物伦理委员会的管理准则(伦理审批号:201903A011)。
2 方法与结果
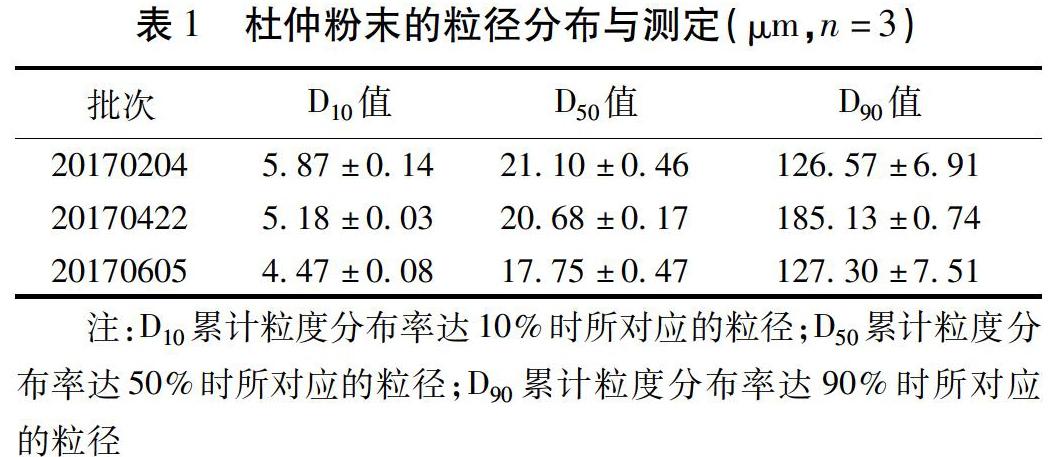
2.1 杜仲极细粉的制备及粒度测定 利用超微粉碎机将经预粉碎后的杜仲普通粉体进行粉碎,得到杜仲极细粉。实验中为探究极细粉与传统饮片体外溶出差异而设置了3个不同批次,分别为20170204、20170422和20170603。利用激光粒度仪测定上述3批杜仲极细粉的粒径,绘制出以体积为基准的粒径频率分布图,得到各极细粉的D10值、中位径D50值和D90值,各粒径结果如表1。
2.2 杜仲极细粉有效成分溶出总量的测定
2.2.1 色谱条件 Kromasil 100-5-C18色谱柱(250 mm×4.6 mm,5 μm);流动相:0.1%甲酸(A)-甲醇(B),梯度洗脱(0~5 min,95%~82%A;5~15 min,82%~81%A;15~28 min,81%~77%A;28~44 min,77%~75%A;44~54 min,77%~74%A);流速1 mL/min;柱温30 ℃;进样量10 μL;京尼平苷酸和京尼平的检测波长为250 nm,松脂醇二葡萄糖苷的检测波长为277 nm。在上述色谱条件下,各色谱峰分离度良好。
2.2.2 对照品溶液的制备 分别精密称取京尼平苷酸、京尼平和松脂醇二葡萄糖苷的对照品各1.78、0.96、3.48 mg,置于10 mL的量瓶中,再加甲醇定容为分别含京尼平苷酸0.178 mg/mL、京尼平0.096 mg/mL、松脂醇二葡萄糖苷0.348 mg/mL的溶液,制得对照品溶液。
2.2.3 供试品溶液的制备 取3个不同生产批次分别编号为(20170204、20170422、20170603)的杜仲极细粉和传统饮片,一式3份,精密取1 g粉末,置于50 mL具塞圆底烧瓶中,精密加入纯水20 mL,称重,将烧瓶放在温度为100 ℃的恒温水浴锅中回流提取1 h,放冷,再称重,用纯水补足减失的重量,摇匀,滤过,取续滤液,即得供试品溶液,按“2.2.1”项下的色谱条件进行测定。
2.2.4 专属性试验 分别取对照品溶液和供试品溶液进行HPLC检测,记录色谱图并对专属性进行比较,结果显示京尼平苷酸、京尼平和松脂醇二葡萄糖苷均有良好的专属性。混合对照品(含有京尼平苷酸、京尼平和松脂醇二葡萄糖苷)和供试品的HPLC。见图1。
2.2.5 线性关系考察 取“2.2.2”项下配制的混合对照品溶液适量,甲醇稀释2、4、16、32倍。在“2.2.1”项色谱条件下,分别测定京尼平苷酸峰面积。以京尼平苷酸的质量浓度(g/L)为横坐标,峰面积为纵坐标,绘制标准曲线,计算线性回归方程。提示京尼平苷酸内线性关系良好。以同样的方法分别绘制京尼平和松脂醇二葡萄糖苷的標准曲线。见表2。
2.2.6 中间精密度试验 分别精密吸取京尼平苷酸、京尼平和松脂醇二葡萄糖苷的对照品溶液10 μL,连续进样6次,在“2.2.1”项色谱条件下测定,记录峰面积,测得京尼平苷酸、京尼平、松脂醇二葡萄糖苷峰面积的RSD分别为0.31%,0.38%和0.06%,结果表明HPLC仪器精密度良好。
2.2.7 供试品溶液稳定性试验 取第2批杜仲极细粉供试品溶液(批号:20170422),在“2.2.1”项色谱条件下,分别在配置后0、2、4、8、12、24 h进样测定,记录各成分峰面积,计算得到京尼平苷酸、京尼平、松脂醇二葡萄糖苷峰面积RSD依次为:1.93%、1.04%、0.21%。表明供试品溶液在24 h内稳定性良好。
2.2.8 重复性试验 精密取6份第2批杜仲极细粉供试品溶液(批号:20170422),按上述“2.2.1”色谱条件进行测定,计算得到京尼平苷酸、京尼平、松脂醇二葡萄糖苷峰面积RSD分别为1.71%,1.83%,1.10%,表明该方法重复性良好。
2.2.9 回收率试验 取6份第2批杜仲极细粉供试品(批号:20170422),精密称定,置具塞锥形瓶中,一式6份,分别精密加样京尼平苷酸、京尼平和松脂醇二葡萄糖苷的对照品,按照“2.2.3”项下的方法操作,回流提取1 h,制得供试品溶液,在“2.2.1”项色谱条件下测定得到各有效成分的峰面积,分别计算它们的回收率,结果表明京尼平苷酸的平均回收率(n=6)为100.9%,RSD为1.81%;京尼平的平均回收率为98.73%,RSD为0.63%;松脂醇二葡萄糖苷的平均回收率为98.94%,RSD为0.58%。说明加样回收率良好,符合要求。见表3。
2.2.10 杜仲极细粉饮片与传统饮片溶出总量的比较 取样品粉末或传统饮片,按照“2.2.3”项下方法制备供试品溶液,在“2.2.1”项的色谱条件进样测定,标准曲线法分别计算含有量。通过两样本间均值t检验比较同一批杜仲药材2种不同饮片形式在相同有效成分上的差异,结果杜仲极细粉中京尼平苷酸、京尼平和松脂醇二葡萄糖苷的质量分数分别在2.58~3.46 mg/g,0.64~0.74 mg/g和2.67~3.53 mg/g,而杜仲传统饮片3种有效成分的质量分数分别在0.65~1.65 mg/g,0.07~0.23 mg/g和1.63~1.81 mg/g,杜仲极细粉中3种有效成分含量都显著高于杜仲传统饮片(P<0.05)。见表4。
2.3 累积溶出率的测定
分别取“2.1”项下制备的杜仲传统饮片和极细粉各约15 g,精密称定,投入溶出杯中,按照2015版《中华人民共和国药典》(二部)附录的溶出度浆法测定法[7],以已经经过10 h超声脱气的900 mL蒸馏水为溶剂,浆法,转速为100 r/min,温度(37.0±0.5)℃,分别于5、10、15、30、45、60、80、120、240 min时各取样2 mL,在取样的同时向溶出杯中补充相同体积和温度的蒸馏水,再将取出的样品溶液滤过,取续滤液过0.22 μm的微孔滤膜,得到以蒸馏水为溶出介质的供试品溶液[8]。以同样的方法,按照2015版《中华人民共和国药典》(四部)通则项下制备人工胃液、人工肠液[9],在进行与上述以蒸馏水为溶出介质的实验步骤相同的溶出实验,最后分别得到了以人工胃液、人工肠液为溶出介质的供试品溶液。取“2.3”项下制备的供试品溶液,按照“2.2.1”项下的色谱条件测得不同时间京尼平苷酸、京尼平和松脂醇二葡萄糖苷的溶出量。以“2.2.10”项所测得的各有效成分的质量分数为100%,计算各时间点的累积溶出率[累积溶出率=(溶出量/含有量)×100%]。以累积溶出率为纵坐标,时间为横坐标作图,绘制累积溶出率变化曲线,见图2。将图2中不同时间点各有效成分的累积溶出率数据按威布尔分布函数进行处理,拟合参数,求出溶出度参数T50、Td[10]。其相应的威布尔参数见表5~7。
2.3.1 以人工胃液为溶出介质的杜仲极细粉和传统饮片的溶出度比较
2.3.1.1 溶出量的比较 杜仲极细粉3种有效成分都高于传统饮片,以240 min为溶出终点,杜仲极细粉饮片京尼平苷酸、京尼平和松脂醇二葡萄糖苷溶出率分别为97%、72%和41%,而杜仲传统饮片分别为50%、35%和19%,其中,与传统饮片比较,杜仲极细粉京尼平苷酸和京尼平差异均有统计学意义(P<0.05)。见图2。
2.3.1.2 溶出速率的比较 杜仲极细粉京尼平苷酸溶出速率常数T0.5和Td分别在4.47~10.37 min和9.21~17.85 min,其传统饮片京尼平苷酸T0.5和Td分别在68.18~262.02 min和141.31~589.17 min,传统饮片与极细粉饮片比较差异有统计学意义(P<0.05)。
2.3.2 以人工肠液为溶出介质的杜仲极细粉和传统饮片的溶出度比较
2.3.2.1 溶出量的比较 以240 min为溶出终点,杜仲极细粉饮片京尼平苷酸、京尼平和松脂醇二葡萄糖苷溶出率分别为90%、75%和94%,而杜仲传统饮片分别为48%、42%和45%,杜仲极细粉饮片与传统饮片比较,3种有效成分差异均有统计学意义(P<0.05)。
2.3.2.2 溶出速率的比较 杜仲极细粉京尼平苷酸、京尼平和松脂醇二葡萄糖苷溶出速率常数T0.5分别为2.72~10.68 min、4.62~17.41 min和4.25~12.47 min,而传统饮片3种有效成分T0.5分别为188.94~385.26 min、167.64~529.64 min和202.41~503.47 min,杜仲极细粉饮片与传统饮片比较,3种有效成分差异均有统计学意义(P<0.05),说明杜仲经极细粉碎后有效成分溶出速率显著提高,平均在30 min达到了溶出饱和,相反,传统饮片组在240 min还未达到溶出饱和。
2.4 药动学研究
2.4.1 色谱条件 BEH-C18色谱柱(100 mm×2.1 mm,1.7 μm,Waters公司);预柱C18保护柱(10 mm×2.1 mm,1.7 μm,Waters公司);流速为0.3 mL/min,柱温40 ℃;进样量为2 μL;离子源为ESI源。流动相:0.1%甲酸(A)-乙腈(B),梯度洗脱(0~1 min,95%~95%A;1~1.5 min,95%~13%A;1.5~2.4 min,13%~10%A;2.4~3.0 min,10%~5%A;3~3.5 min,5%~95%A;3.5~4 min,95%~95%A。
2.4.2 标准曲线制备 取大鼠空白血浆90 μL,分别加入京尼平苷酸标准系列溶液10 μL和10 μL内参(1 210 ng/mL)制成相当于浓度为1、5、10、50、100、500、1 000 ng/mL的血浆样品,其余按下文“2.4.8”项下血浆样品的处理方法操作,在“2.4.1”项色谱质谱条件下分离测定,分别以京尼平苷酸溶度为横坐标,京尼平苷酸与内标物的峰面积比值为纵坐標,求得的直线回归方程Y=0.002 99X+0.031 66(r=0.999 2)
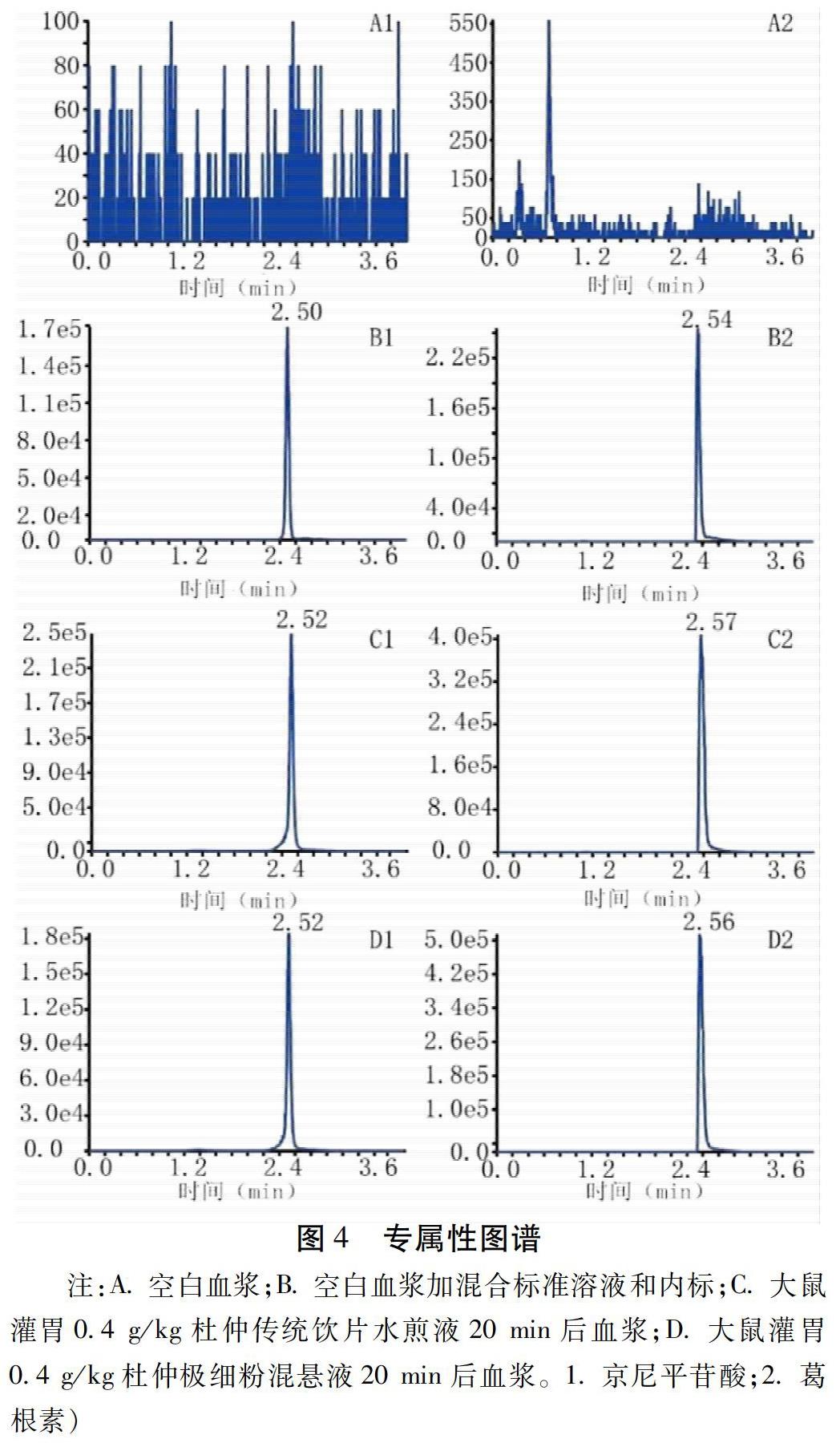
2.4.3 方法专属性 分别取空白血浆、空白血浆加混合对照品溶液及内标、灌胃给药后20 min的血浆样品按“2.4.8”项下血浆样品的处理方法操作,在“2.4.1”项色谱质谱条件下分离测定,考察方法的专属性;各成分间在此色谱条件下互不影响,且大鼠血浆中内源性物质不干扰各组分的测定。结果见图4。京尼平苷酸及内标溶液在此质谱色谱条件下互不影响,且大鼠血浆中的内源性物质不干扰京尼平苷酸的测定。
2.4.4 线性关系考察 取大鼠空白血浆90 μL,分别加入京尼平苷酸标准系列溶液10 μL和10 μL内参(1 210 ng/mL)制成相当于浓度为1、5、10、50、100、500、1 000 ng/mL的血浆样品,其余按“2.4.8”项下血浆样品的处理方法操作,在“2.4.1”项色谱质谱条件下分离测定,分别以京尼平苷酸溶度为横坐标,京尼平苷酸与内标物的峰面积比值为纵坐标,求得的直线回归方程Y=0.002 99X+0.031 66(r=0.999 2),即为标准曲线,在1~1 000 ng/mL范围内线性关系良好,定量下限为1 ng/mL。
2.4.5 精密度试验 取空白血浆90 μL,按“2.4.2”项下操作制成1、50、800 ng/mL 3个浓度的质量控制(QC)样品,每个质量浓度重复6样本分析,连续测定3 d,记录峰面积,计算准确度和精密度。结果显示,京尼平苷酸的日内精密度的RSD分别为5.63%、6.55%、2.55%;准确度分别为107.06%、102.54%、100.63%;日间精密度的RSD分别为7.23%、4.42%、1.84%;准确度分别为103.08%、106.42%、101.06%;该方法的精密度和准确度良好,符合生物样品分析方法的要求。
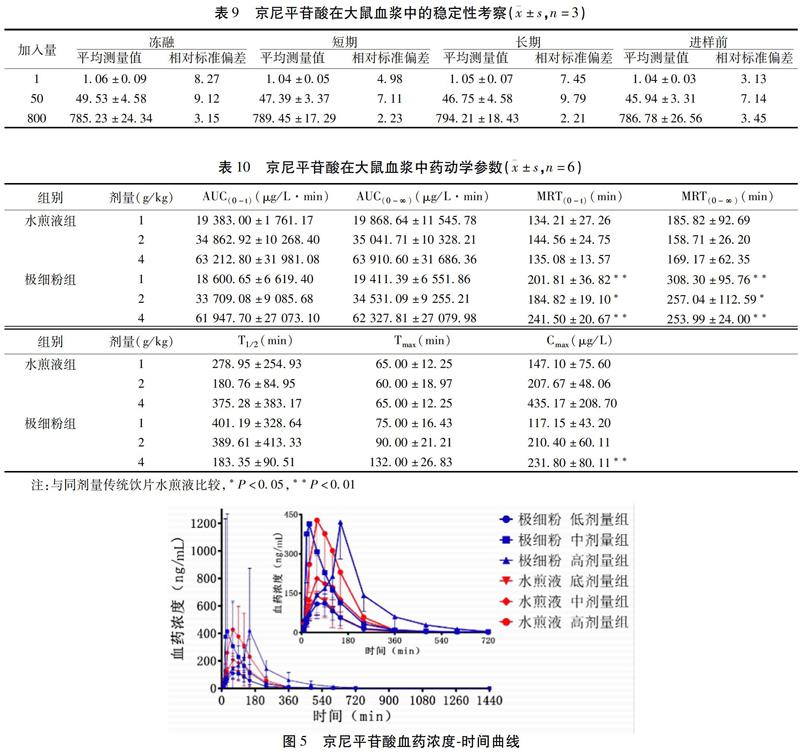
2.4.6 稳定性试验 按“2.4.2”项下操作配制1、50、800 ng/mL 3个浓度的QC样品,每个浓度3样本,考察短期稳定性、长期稳定性和冻融稳定性,即血浆样品室温放置4 h,-20 ℃冻藏30 d和经历3次冻融循环周期后的稳定性。见表9。由表可知,含有京尼平苷酸的血浆样品在以上条件下,都具有较好的稳定性。
2.4.7 提取回收率和基质效应 精密吸取京尼平苷酸对照品溶液10 μL加入90 μL空白血浆,按“2.4.2”项下分别配制成1、50、800 ng/mL 3个浓度的QC样品,每一个浓度进行6样本分析,记录其峰面积。以提取后的色谱峰面积与未经提取直接进样的色谱峰面积之比,考察样品提取回收率;将提取后的空白血浆样品加入对照品溶液所测得的峰面积与同浓度标准溶液测得的峰面积之比,即为基质效应,结果显示,京尼平苷酸提取回收率的RSD分别为7.29%、5.11%、7.84%;基质效应分别为3.35%、5.93%、5.27%。该方法提取回收率和基质效应良好,符合生物样品分析方法的要求。
2.4.8 血浆样品处理 从冰箱取出待测样品,充分解冻后涡旋60 s混合均匀。取90 μL的血浆样品,加10 μL内标,涡旋10 s混合均匀。加入甲醇300 μL,涡旋3 min,静置3 min后,以12 000 r/min离心半径8.60 cm,转速离心10 min,取上清液200 μL,常温真空干燥。待样品挥干后,加入100 μL甲醇,涡旋3 min,以12 000 r/min离心半径8.60 cm,转速离心10 min,取上清,取2 μL用于UPLC-MS/MS分析。药动学参数通过DAS2.0软件进行处理[12]。
2.4.9 给药方法与血浆采集 杜仲水煎液的制备:取杜仲生品50 g,置于砂锅之中,精密加入水500 mL,武火煎煮至沸腾,文火煎煮20 min后,煎煮2次,用双层纱布过滤后,合并2次煎煮滤液,使用旋转蒸发仪蒸发浓缩至含药量为0.4 g/mL,即得传统饮片组灌胃给药所需的高剂量水煎液,以同样的方法制备含药量分别为0.2 g/mL和0.1 g/mL的水煎液,即中剂量与低剂量水煎液,备用。杜仲极细粉混悬液的制备:精密称取杜仲极细粉16 g,放入研钵中,加入0.5%羧甲基纤维素钠40 mL研磨成混悬液,即得含药量为0.4 g/mL的高剂量流体,以同样的方法制备含药量分别为0.2 g/mL和0.1 g/mL的极细粉混悬液,备用。雄性的SD大鼠36只,随机分为杜仲传统饮片组和极细粉组,每组18只,每组又分别分为高、中、低3个剂量组,每组6只。实验前12 h禁食,实验期间自由饮水,杜仲生药材的剂量分别为1 000、2 000、4 000 mg/kg(根据2015版《中华人民共和国药典》,杜仲药材的用量是6~10 g。根据体表面积换算法,折算成大鼠的用量),按照杜仲提取物2.0 mL/200 g的灌胃剂量进行给药。分别于给药后10 min、20 min、30 min、60 min、120 min、150 min、4 h、6 h、8 h、10 h、12 h、24 h经大鼠眼球后静脉丛采血约0.5 mL,置肝素化试管中,4 000 r/min,离心半径8.60 cm,离心10 min,分离血浆,-20 ℃冷冻保存,备用。
2.4.10 动力学参数计算 血药浓度-时间结果见图5,并用DAS 2.0药动学软件拟合,计算药动学参数,结果见表10。由图5和表10可知,大鼠灌胃给药后,水煎液3个剂量组达峰时间(Tmax)平均在63 min,而极细粉由低剂量到高剂量的Tmax分别为75、90、132 min,在相同剂量下,极细粉组分别是水煎液组的1.15、1.50、2.03倍,说明传统饮片水煎液相较于极细粉混悬液跟有利于有效成分的吸收,而底、高剂量极细粉组与相应的传统饮片组的MRT(0-t)差异有统计学意义(P<0.01),说明极细粉中京尼平苷酸在体内消除缓慢。
3 讨论
实验数据表明,杜仲极细粉2(X2)与杜仲传统饮片2(C2)京尼平苷酸的溶出总量分别为3.34 mg/g和1.52 mg/g,京尼平的溶出總量分别为0.74 mg/g和0.23 mg/g,松脂醇二葡萄糖苷的溶出总量分别为3.53 mg/g和1.63 mg/g,杜仲极细粉2(X2)3种有效成分的溶出总量相较于杜仲传统饮片2(C2)分别增加了54.49%、68.91%和53.82%,表明杜仲传统饮片经超微粉碎成极细粉后可以显著提高有效成分的溶出(P<0.05),理论上植物细胞中的化学成分可能受细胞屏障的影响,有效成分不易与提取溶剂接触,较难溶解完全,而超微粉碎技术破除了这种障碍,比如,将细胞屏障之一的杜仲胶微粉化,因而增加了有效成分的溶出[11]。
药时曲线的溶出总量上,以240 min为终点,通过比较同批杜仲药材同一有效成分在2种不同剂型的溶出行为,发现3批杜仲极细粉京尼平苷酸在人工胃液和人工肠液中的溶出总量显著高于3批传统饮片(P<0.01),极细粉组京尼平在3种溶出介质中都显著高于传统饮片组(P<0.05),且传统饮片组京尼平在蒸馏水中未检出,可能是由于苷元极性较低,使其在水中较难溶出;松脂醇二葡萄糖苷在人工肠液和蒸馏水中极细粉组显著高于传统饮片组(P<0.05),而在人工胃液中,差异无统计学意义(P>0.05);说明杜仲传统饮片经超微粉碎后可以显著提高有效成分在胃肠道的溶出,从而增强药效;通过比较同一种剂型的有效成分在3种溶出介质溶出总量,发现松脂醇二葡萄糖苷在人工肠液中的溶出总量都明显高于人工胃液和蒸馏水(P<0.05),说明肠道可能为松脂醇二葡萄糖苷的主要吸收部位。
根据溶出曲线和威布尔分布函数的拟合参数可知,杜仲极细粉组有效成分平均在30 min达到了溶出饱和,达到了溶出总量的90%,相反,传统饮片组在240 min还未达到溶出饱和,只达到溶出总量的45%,说明杜仲极细粉可以显著提高有效成分的溶出速率和溶出总量。原因可能是极细粉碎过程破坏了杜仲的细胞壁,药材比表面积增大,导致其溶出速率增大。表明了杜仲选取极细粉入药更有利于有效成分的溶出,从而减少用药剂量,达到节约药材的目的。
虽然在相同剂量下,杜仲极细粉组AUC(0-t)与传统饮片组比较差异无统计学意义(P>0.05),传统饮片组的Tmax低于相应的极细粉组,但极细粉高、低剂量组的平均驻留时间MRT(0-t)与传统饮片高、低剂量组差异有统计学意义(P<0.01),说明杜仲极细粉碎后减缓了京尼平苷酸在体内的消除速率,从而延长其在体内的作用时间,其原因可能是极细粉颗粒吸附在胃肠壁上,延长极细粉排除体外所需要的时间[13],从而有助于药效的持久发挥。杜仲极细粉与传统饮片比较,生物利用度没有提高,原因可能是极细粉的给药方式与其正常的用法不同,通常极细粉用法为热水冲服,而本实验给药方式为羧甲基纤维素钠混悬液,与热水比较混悬液中杜仲极细粉有效成分未在短时间内快速溶出,导致曲线下面积和达峰时间差异无统计学意义。
细胞级粉碎是对中药材进行超微粉碎的目的,即打破中药材的细胞壁,从而减小细胞内的有效成分的溶出阻力,加快一般药材的浸润、溶胀、渗透和扩散[7,9,14]。将中药材进行超微粉碎之后,其粉体的色泽变得均匀,质感变得细腻,颗粒感会逐渐消失,药物的有效成分利用度提高,同时微细化的中药物料会有比较强的溶解性、表面吸附力、分散性和亲和力,从而同时增大了中药材的溶出量和溶出率,最终有利于药物的吸收与利用[14-15]。杜仲粉体临床用药疗效的水平一定程度上受有效成分的溶出度的影响,将其制成极细粉入药,提高溶出速率的同时[16],也有利于保证杜仲在复方应用中发挥出最大的疗效并减少贵重药材的用量[17]。
参考文献
[1]王志宏,彭胜,雷明盛,等.杜仲主要生物活性研究进展[J].天然产物研究与开发,2013,25(9):1302-1309.
[2]邬晓臣,欧阳辉,张近宝,等.杜仲多糖对兔心肌缺血再灌注损伤的保护作用[J].药物评价研究,2014,37(1):34-36.
[3]肖芳,覃艺,范润勇,等.杜仲及盐杜仲饮片的均匀化分析[J].中国实验方剂学杂志,2017,23(4):9-14.
[4]李德成,刘庆燕,韩传伟.中药超微粉碎技术在中药制剂中广泛应用的优越性[J].世界中医药,2010,5(6):430-431,439.
[5]蔡璐,梁少瑜,戴开金,等.人参超微粉与细粉的体外溶出度比较[J].南方医科大学学报,2013,33(10):1547-1550.
[6]蔡萍,李跃辉,肖娟,等.铁包金按摩膏中铁包金超微粉与饮片质量对比研究[J].世界中医药,2015,10(11):1771-1773.
[7]国家药典委员会.中华人民共和国药典(二部)[M].北京:中国医药科技出版社,2015:121-122.
[8]梁兆昌,褚洪标,肖琳,等.杜仲超微粉体理化特性及体外溶出性能研究[J].中草药,2015,46(11):1609-1614.
[9]国家药典委员会.中华人民共和国药典(四部)[M].北京:中国医药科技出版社,2015:325-326.
[10]邹龙,桂卉,周春湘,等.雄黄超微粉体与常规粉体的体外溶出研究[J].世界中医药,2009,4(1):53-54.
[11]丁志平,蔡光先,唐正平,等.灵芝的常规粉与超微粉中多糖溶出度比较实验[J].湖南中医杂志,2010,26(6):105-107.
[12]高倩倩,翁泽斌,赵根华,等.盐炙对杜仲中京尼平苷酸体内药代动力学的影响[J].南京中医药大学学报,2015,31(5):453-456.
[13]马玉芳,林雪玲,俞道进,等.黄连解毒散超微粉有效成分小檗碱在家兔体内的药代动力学研究[J].中国农业科学,2008,41(3):875-879.
[14]闫丹,江敏瑜,张传辉,等.基于多成分測定的血竭三七接骨膏中粉体粒径与溶出度的相关性研究[J].中草药,2017,48(21):4432-4439.
[15]李德成,刘庆燕,韩传伟.中药超微粉碎技术在中药制剂中广泛应用的优越性[J].世界中医药,2010,5(6):430-431,439.
[16]梁绪中,余志银,孙利国.黄芪破壁饮片研究进展[J].世界中医药,2019,14(8):2220-2224.
[17]王姗姗,施崇精,刘小妹,等.基于有效成分的溶出性与粉末分散性构建通脉大生片的粉末分散体[J].中草药,2018,49(13):3017-3025.
(2019-11-02收稿 责任编辑:王明)

