一株沙门菌裂解性噬菌体的分离鉴定与生物学特性研究
李帅华,易开放,杨影影,贺丹丹,潘玉善,苑 丽,胡功政
(河南农业大学 牧医工程学院,河南 郑州 450000)
沙门菌(Salmonella)属于肠道致病菌,其感染人和动物后可引起伤寒、急性胃肠炎以及败血症等疾病,是全球范围内引起食物中毒的常见病原菌之一[1];同时沙门氏菌感染与食品种类繁多有关,其污染源从人类到食品加工设施不等[2]。目前沙门氏菌共有超过2600个血清型,在我国报道的已有292个[3]。沙门菌对畜牧养殖业产生了巨大的影响,已经在全球范围内造成了巨大的经济损失,并对公共卫生安全构成严重威胁。
以往由于过于依赖抗生素对沙门菌病进行治疗与防控,以及抗生素长期的不合理使用及滥用,致使细菌耐药性问题逐渐加剧,导致或诱导病原菌产生变异,甚至产生多重耐药或泛耐药的“超级细菌”。另外,抗生素的种类有限,且新抗生素的研发速度无法赶上细菌产生耐药性的速度,有研究证实:一种新的抗生素从发现到应用至少需要5年时间,而细菌产生耐药性一般仅需要2年时间[4],因此针对沙门菌防控的新策略和产品亟待研究。
噬菌体(bacteriophage, phage)是一种细菌性病毒,广泛存在于自然界,是生物圈中最丰富的物种。噬菌体是细菌的天敌,能够天然杀灭细菌,在细菌治疗方面较抗生素具有不可比拟的优势:严格的宿主特异性、增殖速度快、研发时间短、成本低、安全无污染等,使得噬菌体有望成为一种防控沙门菌的新型武器。本试验以沙门菌SA209为宿主菌,分离得到了1株沙门菌噬菌体,并对其生物学特性进行了研究,以期为噬菌体抗菌制剂的开发提供理论依据,为沙门菌的防控提供新的思路和方法。
1 材料与方法
1.1 细菌菌株与样品采集
宿主菌株SA209以及其它试验所用菌株均由本实验室保存,样品采自河南省安阳市某规模化养猪场。
1.2 主要试剂及培养基
琼脂糖、DNase I、RNase A(TaKaRa)、SM缓冲液(北京百奥莱博科技有限公司)、SS琼脂、LB肉汤、LB琼脂均购于北京奥博星生物技术有限责任公司。
1.3 噬菌体的分离与鉴定
噬菌体的分离方法参照文献[5]并有所改进。将适量的粪便样品完全溶解在SM缓冲液中,室温静置8 h,以10000 r/min离心10 min;上清液用0.48 μm的一次性无菌过滤器过滤,再次以10000 r/min离心10 min,再用0.22 μm的一次性无菌过滤器过滤。污水样品以10000 r/min离心10 min,上清液用0.22 μm的一次性无菌过滤器过滤,即获得噬菌体原液。将5 mL噬菌体原液和20 mL宿主菌液混合,37 ℃培养过夜。在培养物中加入适量的氯仿,振荡20 min,以10000 r/min离心10 min,上清液即为噬菌体溶液。
将宿主菌液均匀涂布在LB平板上,滴加10 μL噬菌体溶液,对照组滴加等量的无菌水,待平板干燥后置于37 ℃培养12 h,观察是否出现噬菌斑。
1.4 噬菌体的纯化与保存
通过双琼脂平板法纯化噬菌体:将噬菌体溶液以10倍梯度稀释5次;将200 μL细菌液和100 μL噬菌体溶液加入到5 mL半固体培养基中,混合均匀后倒在LB平板上,将平板干燥后,在37 ℃下培养12 h。在双板上形成斑块后,用无菌牙签挑取形状规整、大而透亮的单个噬菌斑,加入1 mL SM溶液,于4 ℃放置6 h。重复上述操作,将单个噬菌体重复纯化5~7次,以获得纯化后的噬菌体。
在5 mL宿主细菌溶液中加入100 μL噬菌体纯化液,在37 ℃静置30 min。然后,将培养物在37 ℃恒温摇床中培养6 h。加入50 μL氯仿,剧烈振动15 min,再以7000 r/min离心20 min。将噬菌体溶液与80%甘油溶液(甘油终浓度为30%)混合,在-80 ℃下长时间保存,或在4 ℃下适时保存,备用。
1.5 噬菌体的效价计算
取纯化后的噬菌体溶液100 μL,加入900 μL SM缓冲溶液,以10倍梯度倍比稀释6次,使用双层平板法测定噬菌体的滴度,试验重复3次,取平均值。计算公式为:噬菌体滴度(PFU/mL)=稀释倍数×噬菌斑个数×10。
1.6 噬菌体核酸类型的鉴定
取纯化后的噬菌体颗粒,参考《分子克隆实验指南》中的λ噬菌体颗粒PEG沉淀提取法[7]制备噬菌体浓缩液,用Virus DNA/RNA Kit试剂盒提取噬菌体的基因组,用DNase I、RNase A进行酶溶鉴定。试验组:12 μL基因组+2 μL DNase I/RNase A+6 μL ddH2O。对照组:12 μL基因组+8 μL ddH2O。于37 ℃恒温金属浴30 min,通过1%琼脂糖凝胶电泳验证。
1.7 最佳感染复数
感染复数(multiplicity of infection, MOI)是指初始感染时加入噬菌体的数量与宿主菌数量的比值,也称感染倍数。本试验设定0.001、0.01、0.1、1、10、100等6个不同的感染复数,将噬菌体纯培养物和宿主菌按照不同感染复数的比例混合,补加液体LB培养基使各试管的总体积相同;将各试管置于37 ℃摇床上,以180 r/min振荡4 h,离心取上清,适当稀释后利用双层平板法测定各个感染复数下噬菌体的效价,以确定噬菌体的最佳感染复数。
1.8 一步生长曲线
噬菌体的一步生长曲线是定量描述毒性噬菌体生长规律的实验曲线。实验方法参照文献[8],将对数生长期的宿主菌液以5000 r/min离心10 min,弃上清,用新鲜的LB肉汤重悬菌液,将菌液浓度定值到109cfu/mL;按最佳感染复数加入相应的噬菌体量,在37 ℃下以180 r/min在摇床上培养15 min;再冰浴30 s,然后以10000 r/min离心10 min,用新鲜的LB肉汤洗涤两次,除去未吸附的噬菌体;再用37 ℃预热的LB肉汤进行重悬,然后置于37 ℃、220 r/min的摇床培养并开始计时;分别在培养0、5、10、20、30、......、150 min时取样500 μL,冰浴30 s,于4 ℃下以10000 r/min的转速离心10 min,收集上清液,测定噬菌体的滴度(PFU/mL)。以感染时间t为横坐标,以噬菌体滴度为纵坐标,绘制一步生长曲线,得出噬菌体的潜伏期、裂解期,并计算裂解量,其计算公式为:裂解量=裂解末期噬菌体的滴度/感染初期的宿主菌浓度。
1.9 噬菌体的pH稳定性
用HCI和NaOH溶液调节SM缓冲液的pH值,设置其pH值梯度为2、3、4、5、6、7、8、9、10、11、12。分别取各pH值的SM缓冲液0.9 mL和噬菌体纯培养物0.1 mL于无菌的EP管中,混匀,于37 ℃恒温水浴2 h。然后对各梯度的混合培养液取样,稀释后测定噬菌体的效价;设置3次平行实验,求平均值。以pH值为横坐标,以噬菌体的效价为纵坐标作图。
1.10 噬菌体的热稳定性
将适量的噬菌体纯培养物分别静置于40、50、60、70、80 ℃的恒温水浴锅内,开始计时,分别在20、40、60 min时取样,测定不同温度不同时刻的噬菌体滴度;设置3个平行实验,计算平均值。以时间为横坐标,以噬菌体的滴度为纵坐标作图。
1.11 噬菌体的宿主谱初测
宿主谱测定采用点滴法:取100 μL测试菌液,将其均匀涂布在LB平板上,静置干燥后,取20 μL噬菌体纯培养物滴在平板的相应区域,待其晾干后于37 ℃倒置过夜培养。观察是否有裂解斑,若有裂解斑出现则证明噬菌体可裂解此株菌。
2 结果与分析
2.1 噬菌体的分离纯化
本研究从污水样品中分离纯化得到1株沙门菌噬菌体,将其命名为SA-1。采用双层平板法纯化该噬菌体,可见SA-1的噬菌斑呈圆形,大而透亮,直径为3~5 mm,边缘清晰,无晕环(如图1)。
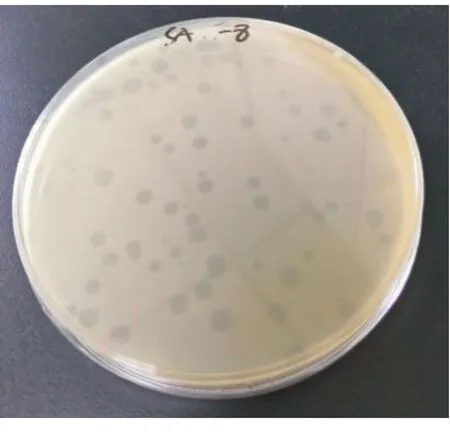
图1 噬菌体SA-1的纯化噬菌斑
2.2 噬菌体的效价测定
将噬菌体SA-1纯化后,测定其效价,为1.15×1010PFU/mL。
2.3 噬菌体核酸酶切鉴定
如图2所示:噬菌体SA-1基因组阴性对照组、RNase A酶溶组均有明亮的条带,条带大小、位置基本一致;只有DNase I酶溶组没有条带。说明噬菌体SA-1基因组对DNA酶敏感,可以被DNA酶溶解,由此可判定噬菌体SA-1基因组的核酸类型为DNA。

M: Marker; 1: SA-1阴性对照;2: DNase I酶溶组; 3: RNase A酶溶组。
2.4 最佳感染复数
由图3可见,噬菌体SA-1在MOI=0.001时,噬菌体的滴度最高,达1.3×1012PFU/mL。因此,可确定噬菌体SA-1的最佳感染复数为0.001。

图3 噬菌体SA-1的感染复数
2.5 一步生长曲线
由图4可知:噬菌体SA-1在感染宿主菌后的10 min内效价变化不明显,表明其潜伏期为10 min;在感染后10~30 min内噬菌体的效价急剧升高,在感染30 min之后趋于平稳,表明其裂解期时长为20 min,在30 min之后进入稳定期。根据裂解量的计算公式,可以计算出噬菌体SA-1的裂解量为108 PFU/cell。

图4 噬菌体SA-1的一步生长曲线
2.6 噬菌体的pH稳定性
由图5可知:噬菌体SA-1的效价在pH为2和12时为0,表明其不能生长;在pH为4~8时,其效价变化不明显,而且维持在较高水平;在pH为8~11时,其效价稍微下降,但幅度较小,依然维持在较高的数量级。总体表明,噬菌体SA-1在较大的pH范围内依然可以保持活性,说明其对酸碱有着良好的耐受性。

图5 噬菌体SA-1的pH稳定性
2.7 噬菌体的热稳定性
由图6可知:噬菌体SA-1在40 ℃和50 ℃下,其效价随着时间的增加而出现升高或降低的现象,但都维持在较高的数量级,说明其在40~50 ℃下能维持良好的活性;在60、70、80 ℃条件下,噬菌体的效价处于直线下降状态,在20 min时其效价均为0,说明其在60~80 ℃的环境中会丧失活性。所以噬菌体SA-1的最适生长温度为40~50 ℃。

图6 噬菌体SA-1的热稳定性
2.8 噬菌体的宿主谱初测
本次实验采用点滴法测定噬菌体SA-1的宿主范围。从实验室保存菌株中选取30株菌株:沙门氏菌临床分离株17株、大肠杆菌临床分离株11株、沙门氏菌JS标准菌株,以及大肠杆菌ATCC25922标准菌株。研究发现:在JS和17株沙门菌临床分离株中有7株对该噬菌体敏感;在ATCC25922标准菌株和11株大肠杆菌临床分离株中有4株对该噬菌体敏感。说明噬菌体SA-1对沙门菌有较强的裂解能力,同时对大肠杆菌也表现出一定的裂解能力。
3 讨论
沙门菌病是由沙门菌引起的人和动物食源性疾病;某些血清型沙门菌例如鼠伤寒沙门菌感染畜禽后呈潜伏状态,虽无明显病症,但会持续排菌,以及污染其下游相关产品,是沙门菌引起食源性疾病的主要原因,不仅极大地提高了食源性致病菌扩散的风险,而且严重阻碍了养殖业的发展,危害了人类健康。
噬菌体在自然界分布广泛,可以说几乎有细菌存在的地方就有其相应的噬菌体存在。据Brussow H等[9]报道,地球大约有1032个噬菌体存在,其数量相当于细菌数量的十几倍。根据噬菌体的作用方式可以将其分为溶原性噬菌体和烈性噬菌体两大类,其中溶原性噬菌体在感染细菌后,其遗传物质会整合到细菌的遗传物质上,随细菌遗传物质复制而复制,在正常情况下不会大量繁殖,故而达不到裂解宿主菌的效果;而烈性噬菌体在感染宿主细菌后,会在其内部迅速大量繁殖,从而裂解宿主菌。烈性噬菌体虽然会对细菌造成巨大的杀伤,但是对人和动物是安全的,不会产生威胁[10]。
本研究从河南省安阳市某规模化养殖场污水样品中分离到沙门菌噬菌体SA-1;纯化后,其在平板上形成的噬菌斑大而透亮,边缘清晰,无晕环,直径在3~5 mm。在本研究中,噬菌体SA-1的初始效价测定为1.15×1010PFU/mL,高于陈义宝等[11]测定的肠炎沙门氏菌噬菌体SP01的效价1.2×109PFU/mL、仇笑笑等[12]测定的沙门菌噬菌体CR5的效价109PFU/mL,说明SA-1属于高效价噬菌体,对沙门菌具有更高的杀伤力。噬菌体SA-1经DNase I酶、RNase A酶酶切分析后,判定其遗传物质为DNA。本研究测定发现,噬菌体SA-1的最佳感染复数为0.001,说明SA-1在感染宿主沙门菌时,很小的数量级就能发挥出良好的裂解性能,这也是在实际抗菌应用中噬菌体相对于抗生素的优势体现。SA-1的生长曲线显示:其潜伏期为0~10 min,裂解期为10~30 min,在30 min后进入稳定期,裂解量高达108 PFU/cell。与Tang F等[5]和Cai R P等[13]分离的噬菌体相比,噬菌体SA-1的潜伏期短,暴发期更短,能够更快地杀灭细菌。SA-1的裂解量达108 PFU/cell,高于江艳华等[14]报道的沙门菌裂解性噬菌体的裂解量(51 PFU/cell)、包红朵等[15]报道的肠炎沙门菌的裂解量(22 PFU/cell)。SA-1对温度和pH表现出较强的耐受性,在pH为3~11区间内活性稳定,在50 ℃内活性稳定,在60 ℃及更高温度下其活性会逐渐降低,比赵影等[16]报道的鼠伤寒沙门氏菌噬菌体ΦBLCC8-0050-3(其适宜温度为30~50 ℃,适宜pH值为5~10)和Imam M等[17]报道的噬菌体MIJ3(其适宜温度为30~60 ℃,适宜pH值为3~10)的适应范围广。噬菌体SA-1能够裂解沙门氏菌JS标准菌株、多株除宿主沙门菌外的沙门菌临床分离株,以及几株大肠杆菌临床分离株,说明SA-1对沙门菌具有良好的裂解性能。尽管噬菌体自身具有较强的特异性,但在本实验中涉及的几株大肠杆菌临床分离株也对噬菌体SA-1表现出了敏感性,此现象有待于进一步研究。
综上所述,噬菌体SA-1属于裂解性噬菌体,不仅对沙门菌有较强的裂解能力,还具有较强的温度及酸碱耐受性,体现出很高的应用价值,有希望成为一种新型的治疗沙门菌病的武器,值得进一步研究。

