鸡肉中硝基咪唑类药物残留量检测
张瑜 王斌 牛记者 董丹丹 王莲芳 毛红骞 郭柏坤 李岗

摘 要:利用高效液相色谱-串联质谱法测定鸡肉中硝基咪唑类药物残留。采用乙腈(含体积分数0.2%甲酸)进行样品提取,然后经过Oasis Prime HLB固相萃取小柱净化处理,目标物在液相系统进行洗脱分离,并使用质谱电喷雾电离源正离子扫描模式进行检测。结果表明:在优化所得色谱流动相条件下,4 种硝基咪唑类药物在一定质量浓度范围内(1.0~15.0 ng/mL)线性关系良好,相关系数≥0.991;在0.25、0.50、2.50 μg/kg 3 个水平的加标实验中,回收率分别为79.4%~105.8%、88.4%~104.6%、88.6%~101.3%,相应的标准偏差分别为≤11.9%、≤4.8%、≤2.8%,表明该方法准确度和精密度良好,能够满足日常快速检验的需求;4 种硝基咪唑类药物均有不同程度的基质效应,其中洛硝达唑的基质效应最明显,且同一种物质加标水平越低,基质效应越明显。
关键词:鸡肉;硝基咪唑类药物;高效液相色谱-串联质谱法;基质效应
Abstract: The objective of this study was to establish and optimize a quick method for the determination of nitroimidazole residues in chicken by high performance liquid chromatography-tandem mass spectrometry (HPLC-MS/MS). The samples were extracted using 0.2% formic acid in acetonitrile, and then the extract was purified using an Oasis Prime HLB solid phase extraction column. The mass spectrometer was operated using an electrospray ionization source in the positive ion mode. Under the optimal conditions, good linear relationships were obtained for four nitroimidazoles in the concentration range of 1.0–15.0 ng/mL, with correlation coefficients no less than 0.991. The recoveries at three spiked concentration levels of 0.25, 0.50 and 2.50 μg/kg were 79.4%–105.8%, 88.4%–104.6%, 88.6%–101.3%, respectively, with relative standard deviations (RSD) equal to or less than 11.9%, 4.8%, and 2.8%, respectively. The method had good accuracy and precision, could meet the requirements for rapid detection. This method had different matrix effects for all four nitroimidazoles. The matrix effect for ronidazole was more obvious than that for the other three nitroimidazoles. The lower the spiked concentration level, the more obvious of the matrix effect for each analyte.
Keywords: chicken; nitroimidazoles; high performance liquid chromatography-tandem mass spectrometry; matrix effect
DOI:10.7506/rlyj1001-8123-20200811-195
中圖分类号:TS207.3 文献标志码:A 文章编号:1001-8123(2020)10-0058-06
硝基咪唑类药物在咪唑环的第5位上有一个-NO2基团[1-2],该类化合物对某些由原生生物或厌氧细菌引起的疾病有治疗作用,尤其是针对常见滴虫病、寄生虫感染及出血性疾病等[3-4],该类药物主要代表物质有甲硝唑(metronidazole,MNZ)、地美硝唑(dimetridazole,DMZ)、羟基甲硝唑(hydroxymetronidazole,MNZOH)及洛硝哒唑(ronidazole,RNZ)等[5-7]。硝基咪唑类药物具有“三致”性[1,8],进入人体会造成不利影响。许多国家和地区已禁止在食源性动物中使用该类药物[9],我国对于该类药物在动物养殖及动物源性食品生产过程中的应用也进行了严格控制[10-12],明确了MNZ、DMZ等兽药不得在动物性食品中检出[13]。
目前,国内外研究中,硝基咪唑类药物及其代谢产物的检测方法有气相色谱法[14]、气相色谱-质谱法[15]、高效液相色谱法[16-17]、酶联免疫吸附法[18]、毛细管电泳法[19]、生物传感器法[20]及高效液相色谱-串联质谱法[21-23]等。
近年来在药物残留检测领域,各检测方法均有一定的优缺点,如气相色谱法具备分离效率高、分析速率快、定量准确等优点,但存在前处理较复杂且衍生后部分硝基咪唑因衍生产物相同而不能分离、定性能力较差等缺点[24];液相色谱法具备定量准确、分析速率快、分离效率高等优点,但同样存在定性能力不足等缺点[25-26];酶联免疫吸附法具备特异性强、设备要求低等优点,但存在定量误差大、检测效率低等问题[18,27];高效液相色谱-串联质谱法因具有较好的灵敏度和抗干扰性被广泛应用,也是我国现行动物源性食品中硝基咪唑类药物的主要检测方法[7,28-29]。本研究以鸡肉为研究对象,采用高效液相色谱-串联质谱法,在现有相关技术基础上,在前处理和实验条件上尝试创新,采用新型专用固相萃取小柱净化技术代替传统的凝胶色谱和固相萃取,进一步简化样品前处理步骤,对比不同流动相体系下硝基咪唑类药物的分离效果和质谱响应,优化检测流动相体系,建立鸡肉中代表性硝基咪唑类药物残留的检测方法,同时分析4 种硝基咪唑类药物代表物质在3 种不同浓度下的基质效应,为日常检测提供参考。
1 材料与方法
1.1 材料与试剂
MNZ(纯度99.8%)、DMZ(纯度99.4%)、MNZOH(纯度98.2%)、RNZ(纯度99.1%)标准品 德国Dr.Ehrenstorfer公司;乙腈、甲醇(均为色谱纯) 美国默克公司;甲酸(色谱纯) 美国Sigma公司;鸡肉 农贸市场;N-丙基乙二胺吸附剂、十八烷基键合硅胶吸附剂C18、无水硫酸镁 上海安谱实验科技股份有限公司;Oasis Prime HLB固相萃取小柱(200 mg/6 mL) 美国Waters公司。
1.2 仪器与设备
LC-30AD液相色谱仪 日本岛津公司;API 4000+质谱仪 美国AB Sciex公司;3-30K冷冻离心机 德国Sigma公司;MTN-2800W氮吹浓缩装置 天津奥特赛恩斯仪器有限公司;ZMQSJ0001超纯水器 美国Millipore公司;BS124S电子天平 德国赛多利斯公司。
1.3 方法
1.3.1 标准溶液配制
通过纯度折算,精确称取各硝基咪唑类药物标准品,用甲醇溶解稀释成质量浓度1 mg/mL的储备母液,冷冻避光保存(低于-18 ℃,保存时间不超过12 个月)。用甲醇将各母液混合,稀释成质量浓度为10 μg/mL的中间储备液,冷藏保存(0~4 ℃,保存时间不超过6 个月)。使用前再稀释成不同质量浓度的标准工作液。
1.3.2 样品前处理
参考丁燕玲等[4]的方法稍作调整,准确称取制备好的鸡肉样品5 g(精确至0.01 g)于洁净离心管中,准确加入10 mL体积分数0.2%甲酸-乙腈溶液,10 000 r/min均质1 min,用高速冷冻离心机在4 ℃、8 000 r/min条件下离心10 min,取上清液,备用。
QuEChERS净化组:取全部上清液,向其中加入QuEChERS试剂(N-丙基乙二胺吸附剂100 mg、十八烷基键合硅胶吸附剂40 mg、无水硫酸镁600 mg),涡旋混匀2 min,在4 ℃、8 000 r/min條件下离心5 min,收集上清液。
固相萃取小柱净化组:取全部上清液,过Oasis Prime HLB固相萃取小柱,控制过柱后流速约为1 滴/s,收集流出液。
1.3.3 样品净化液的浓缩和定容
将上述流出净化液在45 ℃条件下氮吹至近干,准确加入1 mL体积分数20%甲醇水溶液复溶。旋涡混匀1 min,然后静置10 min,取上清液过聚醚砜水相针式滤膜(孔径0.22 μm)后,待上机检测。
1.3.4 仪器条件
1.3.4.1 色谱条件
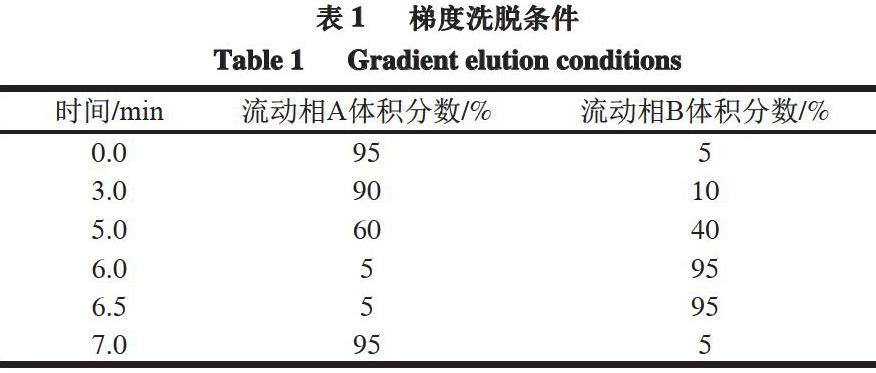
色谱柱:Waters Acquity UPLC BEH C18柱(2.1 mm×100 mm,1.7 μm);流动相A:一级纯水(含体积分数0.1%甲酸);流动相B1:甲醇(含体积分数0.1%甲酸);流动相B2:乙腈(含体积分数0.1%甲酸);柱温40 ℃;进样量5 μL;流速0.4 mL/min;梯度洗脱程序见表1。
1.3.4.2 质谱条件
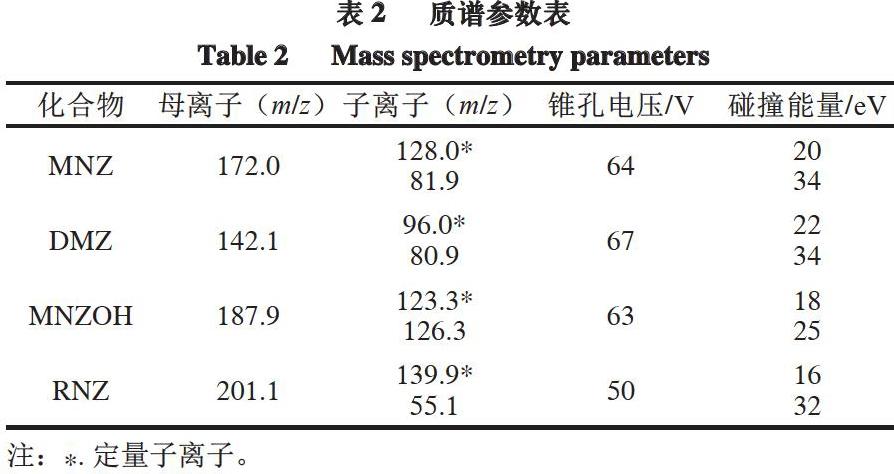
离子源:电喷雾电离离子源;喷雾电压5 500 V;雾化器压力379 kPa;气帘气压力172 kPa;辅助气压力379 kPa;离子源温度550 ℃;多反应监测模式。
经优化后4 种硝基咪唑类药物的主要质谱参数见表2。
1.3.5 结果计算
1.3.5.1 样品中目标物含量计算
样品中目标物残留量按式(1)计算。
式中:X为样品中目标物残留量/(μg/kg);ρ为工作液中目标物质量浓度/(ng/mL);V为样液最终定容体积/mL;m为样品质量/g。
1.3.5.2 基质效应计算
基质效应按式(2)计算。
式中:A为经过前处理的空白基质中添加已知质量浓度目标物的响应值;B为等质量浓度目标物纯溶液的响应值。
1.4 数据处理
色谱图原始检测数据由Analyst Software采集并导出,后续用Microsoft Excel 2010软件作图。
2 结果与分析
2.1 流动相体系的选择
王蕊[30]研究蜂蜜中抗生素残留检测时发现,流动相中添加甲酸可有效防止拖尾。本研究为提高化合物的离子化效率,改善峰形和分离度,增强响应信号,在流动相中添加体积分数0.1%甲酸。甲醇和乙腈是常用的有机流动相,由于2 种有机物在极性、强度、黏度等方面存在差异,对各物质的分离能力也有区别。对比体积分数0.1%甲酸-甲醇溶液和体积分数0.1%甲酸-乙腈溶液分别作为有机流动相体系时的分离效果,得到各物质(5.0 ng/mL)
[2] 王春, 顾传坤, 马强, 等. 超分子溶剂分散液液微萃取/超高效液相色谱-串联质谱法测定鱼血中13 种硝基咪唑类药物残留[J]. 分析测试学报, 2019, 38(3): 263-269. DOI:10.3969/j.issn.1004-4957.2019.03.001.
[3] CRONLY M, BEHAN P, FOLEY B, et al. Rapid confirmatory method for the determination of 11 nitroimidazoles in egg using liquid chromatography tandem mass spectrometry[J]. Journal of Chromatography A, 2009, 1216(46): 8101-8109. DOI:10.1016/j.chroma.2009.04.074.
[4] 丁燕玲, 陈彤, 黄婷, 等. 超高效液相色谱-串联质谱法测定鸡肉中甲硝唑、二甲硝唑及其代谢物的方法研究[J]. 广东化工, 2018, 45(13): 245-248; 252. DOI:10.3969/j.issn.1007-1865.2018.13.112.
[5] 张丽媛, 周剑, 王敏, 等. 液相色谱-串联质谱法测定鸡肉和鸡蛋中3 种硝基咪唑类药物[J]. 食品安全质量检测学报, 2019, 10(14): 4508-4514. DOI:10.3969/j.issn.2095-0381.2019.14.012.
[6] 于敏, 张美娟, 张河霞, 等. 高效液相色谱法测定牛奶中硝基咪唑类残留量[J]. 食品安全质量检测学报, 2018, 9(2): 447-451. DOI:10.3969/j.issn.2095-0381.2018.02.037.
[7] AIRADO-RODR?GUEZ D, HERN?NDEZ-MESA M, GARC?A-CAMPA?A A M, et al. Evaluation of the combination of micellar electrokinetic capillary chromatography with sweeping and cation selective exhaustive injection for the determination of 5-nitroimidazoles in egg samples[J]. Food Chemistry, 2016, 213: 215-222. DOI:10.1016/j.foodchem.2016.06.056.
[8] 张弛, 潘家荣, 帅瑞琪, 等. 动物性食品中硝基咪唑类兽药多残留酶联免疫检测方法的建立[J]. 核农学报, 2016, 30(2): 323-331. DOI:10.11869/j.issn.100-8551.2016.02.0323.
[9] MITROWSKA K, POSYNIAK A, ZMUDZKI J. Multiresidue method for the determination of nitroimidazoles and their hydroxy-metabolites in poultry muscle, plasma and egg by isotope dilution liquid chromatography-mass spectrometry[J]. Talanta, 2010, 81(4/5): 1273-1280. DOI:10.1016/j.talanta.2010.02.020.
[10] 方力, 邱凤梅, 余新威, 等. 基质分散固相萃取-液相色谱-串联质谱法检测动物源性食品中硝基咪唑药物及其代谢物[J]. 色谱, 2018, 36(5): 431-438. DOI:10.3724/SP.J.1123.2017.12028.
[11] 励炯, 孙岚, 王红青, 等. 分散固相萃取净化/高效液相色谱-串联质谱法测定水产品中的5 种硝基咪唑类药物残留[J]. 分析测试学报, 2017, 36(11): 1357-1362. DOI:10.3969/j.issn.1004-4957.2017.11.011.
[12] 高海榮. 二氧化锆QuEChERS-高效液相色谱-串联质谱测定鱼肉中2 种硝基咪唑及代谢产物[J]. 食品工业科技, 2019, 40(4): 266-270. DOI:10.13386/j.issn1002-0306.2019.04.044.
[13] 中华人民共和国农业农村部, 中华人民共和国国家卫生健康委员会, 国家市场监督管理总局. 食品中兽药最大残留限量: GB 31650—2019[S]. 北京: 中国标准出版社, 2019.
[14] WANG Jianhua. Determination of three nitroimidazole residues in poultry meat by gas chromatography with nitrogen-phosphorus detection[J]. Journal of Chromatography A, 2001, 918(2): 435-438. DOI:10.1016/S0021-9673(01)00779-8.
[15] HO C, SIN D W M, WONG K M, et al. Determination of dimetridazole and metronidazole in poultry and porcine tissues by gas chromatography-electron capture negative ionization mass spectrometry[J]. Analytica Chimica Acta, 2005, 530(1): 23-31. DOI:10.1016/j.aca.2004.09.004.
[16] SUN Hanwen, WANG Fengchi, AI Lianfeng. Simultaneous determination of seven nitroimidazole residues in meat by using HPLC-UV detection with solid-phase extraction[J]. Journal of Chromatography B, 2007, 857(2): 296-300. DOI:10.1016/j.jchromb.2007.07.039.
[17] HERN?NDEZ-MESA M, CARBONELL-ROZAS L, CRUCES-BLANCO C, et al. A high-throughput UHPLC method for the analysis of 5-nitroimidazole residues in milk based on salting-out assisted liquid-liquid extraction[J]. Journal of Chromatography B, 2017, 1068/1069: 125-130. DOI:10.1016/j.jchromb.2017.10.016.
[18] HAN Wei, PAN Yuanhu, WANG Yulian, et al. Development of a monoclonal antibody-based indirect competitive enzyme-linked immunosorbent assay for nitroimidazoles in edible animal tissues and feeds[J]. Journal of Pharmaceutical and Biomedical Analysis, 2016, 120: 84-91. DOI:10.1016/j.jpba.2015.12.017.
[19] LIN Yingyun, SU Yan, LIAO Xiulin, et al. Determination of five nitroimidazole residues in artificial porcine muscle tissue samples by capillary electrophoresis[J]. Talanta, 2012, 88(15): 646-652. DOI:10.1016/j.talanta.2011.11.053.
[20] THOMPSON C S, TRAYNOR I M, FODEY T L, et al. Improved screening method for the detection of a range of nitroimidazoles in various matrices by optical biosensor[J]. Analytica Chimica Acta, 2009, 637(1/2): 259-264. DOI:10.1016/j.aca.2008.09.040.
[21] 魏云计, 朱臻怡, 冯民, 等. 高效液相色谱-串联质谱快速测定饲料中硝基咪唑类药物及其代谢物残留[J]. 分析测试学报, 2017, 36(3): 377-381. DOI:10.3969/j.issn.1004-4957.2017.03.014.
[22] 周萍, 李英华, 徐权华, 等. 高效液相色谱-串联质谱联用测定蜂王浆中硝基咪唑类药物残留[J]. 中国蜂业, 2012, 63(增刊3): 59-64.
[23] CHEN D M, DELMAS J M, PESSEL D H, et al. Development of a multi-class method to determine nitroimidazoles, pharmacologically active dyes and chloramphenicol in aquaculture products by liquid chromatography-tandem mass spectrometry[J]. Food Chemistry, 2020, 311: 125924. DOI:10.1016/j.foodchem.2019.125924.
[24] 劉波, 黄为红, 王金中. 气相色谱-电子捕获检测器同时测定硝基咪唑类药物[J]. 分析科学学报, 2008(5): 586-588.
[25] 王扬, 郑重莺, 何丰, 等. 高效液相色谱法测定罗非鱼肌肉中硝基咪唑类多组分残留量[J]. 食品科学, 2011, 32(20): 197-199.
[26] 刘奇琳, 黄祥晖, 廖素兰. 高效液相法测定牛奶中4-硝基咪唑抗生素残留[J]. 武夷学院学报, 2017, 36(3): 17-20. DOI:10.14155/j.cnki.35-1293/g4.2017.03.004.
[27] 王亚宾. 检测硝基咪唑类药物、莱克多巴胺和安定残留的酶联免疫法的建立[D]. 济南: 山东大学, 2011: 1-11.
[28] 中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. 动物源性食品中硝基咪唑残留量检测方法: GB/T 21318—2007[S]. 北京: 中国标准出版社, 2007.
[29] 中华人民共和国吉林出入境检验检疫局, 中华人民共和国山东出入境检验检疫局. 进出口动物源性食品中硝基咪唑残留量检测方法 液相色谱-质谱/质谱法: SN/T 1928—2007[S]. 北京: 中国标准出版社, 2007.
[30] 王蕊. 基于液质联用技术分析蜂蜜中抗生素残留的检测方法研究[D]. 上海: 上海应用技术大学, 2017: 34-41. DOI:10.27801/d.cnki.gshyy.2017.000002.
[31] 冷凯良, 孙伟红, 王志杰, 等. HPLC-APCI(+)MS/MS内标法测定水产品中的3 种硝基咪唑类药物残留量[J]. 渔业科学进展, 2009, 30(5): 88-93. DOI:10.3969/j.issn.1000-7075.2009.05.015.
[32] 中华人民共和国深圳出入境检验检疫局, 中华人民共和国上海出入境检验检疫局, 深圳大学. 出口动物源食品中多类禁用药物残留量检测方法 液相色谱-质谱/质谱法: SN/T 3235—2012[S]. 北京: 中国标准出版社, 2012.
[33] 王嘉琦, 马立利, 曹英华, 等. 动物源性食品中56 种兽药残留物的UPLC-MS/MS高通量分析[J]. 分析试验室, 2018, 37(3): 306-310. DOI:10.13595/j.cnki.issn1000-0720.2018.0055.
[34] 中华人民共和国浙江出入境检验检疫局, 中国合格评定国家认可中心. 实验室质量控制规范 食品理化检测: GB/T 27404—2008[S]. 北京: 中国标准出版社, 2008.
[35] 卞愧, 林涛, 刘敏, 等. 气相色谱-质谱法测定猪可食性组织中3 种β-兴奋剂残留的基质效应[J]. 色谱, 2014, 32(2): 162-168. DOI:10.3724/SP.J.1123.2013.08031.
[36] 刘进玺, 秦珊珊, 冯书惠, 等. 高效液相色谱-串联质谱法测定食用菌中农药多残留的基质效应[J]. 食品科学, 2016, 37(18): 171-177. DOI:10.7506/spkx1002-6630-201618028.

