微泡破坏及间充质干细胞治疗大鼠心肌损伤模型的有效性研究*
徐艳娟 张英强 王 婧 陈芡茹 王红霞 顾明霞*
阿霉素是一种蒽环类的抗肿瘤药物,其可抑制肿瘤细胞核糖核酸(ribonucleic acid,RNA)合成,应用于多种恶性肿瘤的治疗[1]。随着阿霉素剂量增加,其不良反应也相应增加,可导致心肌毒性[2]。因此,寻找有效的心肌毒性防治措施具有重要意义。干细胞移植治疗可促进受损心肌局部结构与功能的恢复,改善心功能。超声微泡介导可以显著促进骨髓间充质干细胞(bone marrow-mesenchymal stem cells,BMMSC)归巢,改善心功能[3]。近年来,对于超声微泡介导干细胞移植治疗阿霉素心肌病的研究较少,为此,本研究通过对大鼠进行体内和体外实验,观察超声微泡介导干细胞移植治疗阿霉素心肌病的作用。
1 材料和方法
1.1 实验动物
选取体重为120~150 g的36只雄性SD大鼠(南京医科大学动物实验中心),建立阿霉素心肌病模型,采用随机数表法将其分为磷酸盐缓冲液(phosphate buffer solution,PBS)组、单纯MSC组和超声微泡+MSC组,每组12只。
1.2 仪器与试剂
(1)仪器设备。JH-930型超声仪(江苏佳华电子设备有限公司);Sorvall Legend Micro 17型离心机(美国Thermo Fisher Scientific公司);FACSCalibur流式细胞仪(美国Becton Dickinson公司)。
(2)药物与试剂。阿霉素(深圳万乐药业有限公司,国药准字H10930106);10%胎牛血清(杭州四季青生物工程材料有限公司);Ficoll-Hypaque淋巴细胞分离液(美国Sigma公司);胰酶(美国Sigma公司);PBS(美国Hyclone公司);二甲基亚砜(dimethylsulfoxide,DMSO)(美国Sigma公司);碳菁荧光染料(carbocyanine fluorescent dye,CM-Dil)(美国Thermo Fisher Scientific公司)。
1.3 体外实验
1.3.1 大鼠BM-MSC的分离、培养和鉴定
将3组SD实验大鼠颈椎脱臼处死,无菌条件下取下肢长骨,用含10%胎牛血清的高糖培养基(dulbecco's modified eagle medium,DMEM)培养液冲洗骨髓腔获取骨髓细胞,离心后取沉淀,用Ficoll-Hypaque淋巴细胞分离液分离,收集中间的细胞层,洗涤后用含10%胎牛血清的DMEM培养液混匀后接种于培养瓶中。原代细胞生长至90%融合时,用0.125%胰酶消化后按1∶3的比例传代。
1.3.2 超声微泡对大鼠MSC的干预与检测
(1)超声微泡对大鼠MSC的干预。将MSC以100μl/孔,约5×104个细胞加入培养板。培养24 h后进行干预实验。超声参数选择频率1 MHz,输出功率1.0 W/cm2,持续辐照90 s,微泡浓度为90 μmmol/L,在超声微泡组+MSC组中加入5 μl微泡约106个。培养板固定在保持37 ℃双蒸水水槽表面,超声探头垂直置于培养板上方约8 cm处进行1.0 W/cm2、2.0 W/cm2、3.0 W/cm2的超声强度干预,为避免超声波对邻近孔细胞的影响,隔孔接种细胞,每组8个复孔。
一杭不肯死心。抽屉里为什么会有钢笔和墨水,而且墨水是新买的。如果他记下过什么,他会放在哪里?一杭又到床上翻找了一阵,枕头里,席子下,都找过了,没有找到想要的东西。
(2)干预后MSC结构、细胞生长与凋亡检测。采用1.0 W/cm2、2.0 W/cm2和3.0 W/cm2强度的超声干预,采用四甲基偶氮唑(methyl thiazolyl tetrazolium,MTT)比色法检测MSC活性,观察超声微泡干预对MSC活性的影响,观察存活和凋亡情况,获得不影响MSC活性的最佳参数。具体操作严格参照试剂盒说明书。
1.4 体内实验
1.4.1 大鼠阿霉素心肌病模型的建立
对3组SD大鼠腹腔注射阿霉素,每次2.5 mg/kg,每周一次,用药10周,动态检查大鼠体表心电图及血清肌钙蛋白、肌酸激酶等证实成功阿霉素建立心肌病模型。
1.4.2 荧光标记MSC
采用含超顺磁性氧化铁(superparamagnetic iron oxide,SPIO)和荧光标记方法对MSC进行SPIO标记。MSC移植前采用磁探针标记培养的MSC。
(1)SPIO标记。将SPIO转染剂结合物纳米粒子的胶体溶液加入细胞培养液中,置于37 ℃、5%CO2培养箱中培养12 h,弃去培养液,用PBS(pH=7.14,0.01 mol/L)冲洗4次,洗掉游离的四氧化三铁(Fe3O4)纳米粒子。MSC移植前使用胰酶消化收集标记后的MSC,使MSC再次悬浮成单个细胞,调节细胞浓度至1×108/L备用。
(2)荧光标记。用二甲基亚砜(dimethylsulfoxide,DMSO)将CM-Dil配成2 mg/ml的母液,用PBS将其稀释为1μg/ml。将培养至第三代的生长良好的骨髓MSC消化后用培养液稀释成浓度为1×109/L,1 ml培养液中加入5μl的CM-Dil(1μg/ml)染液,吹匀,置于37 ℃孵育5 min,4 ℃孵育15 min,以1 500 r/min离心5 min,去上清,PBS洗涤两次。通过荧光显微镜观察标记效率。
(1)MSC移植。建模10周后进行干细胞移植(经尾静脉注入法),同时采用超声仪辐照大鼠心前区,参数采用体外实验探索的最佳照射强度及照射时间。
(2)MSC移植后情况分析。①MSC移植后的24 h行心脏超声测量左室舒张末期容积与收缩末期容积、室壁厚度,计算左室的射血分数和室壁增厚率,评判心功能;②Tunnel染色测凋亡,MSC移植24~48 h后处死动物,取出心脏制成切片,于荧光显微镜下观察Tunnel染色阳性细胞数;③处死动物取适量心肌组织置于灭酶的离心管后放入-80 ℃冰箱中保存,采用蛋白质印迹(Western blot)法检测bcl-2、bax蛋白表达。
1.5 统计学方法
采用SPSS22.0统计学软件进行数据分析。符合正态分布的计量资料以均值±标准差()表示,组间比较采用独立样本t检验,对于重复观察测量资料,采用方差分析来进行组间比较,以P<0.05为差异有统计学意义。
2 结果
2.1 不同超声强度对MSC活性的影响
1.0 W/cm2辐射90 s/d、120 s/d辐射后即刻、辐射后24 h及48 h的MSC吸光度水平比较,差异有统计学意义(F=9.314,P<0.05),且均显著高于2.0 W/cm2和3.0 W/cm2超声强度。2.0 W/cm2和3.0 W/cm2辐射90 s/d、120 s/d辐射后即刻、辐射后24 h及48 h的MSC吸光度水平比较,差异有统计学意义(F=8.584,F=9.026;P<0.05)。空白对照辐射90 s/d、120 s/d辐射后即刻、辐射后24 h及48 h的MSC吸光度水平比较,差异无统计学意义(F=1.616,P>0.05),见表1。
表1 不同超声强度及辐射时间对MSC活性吸光度影响的比较()
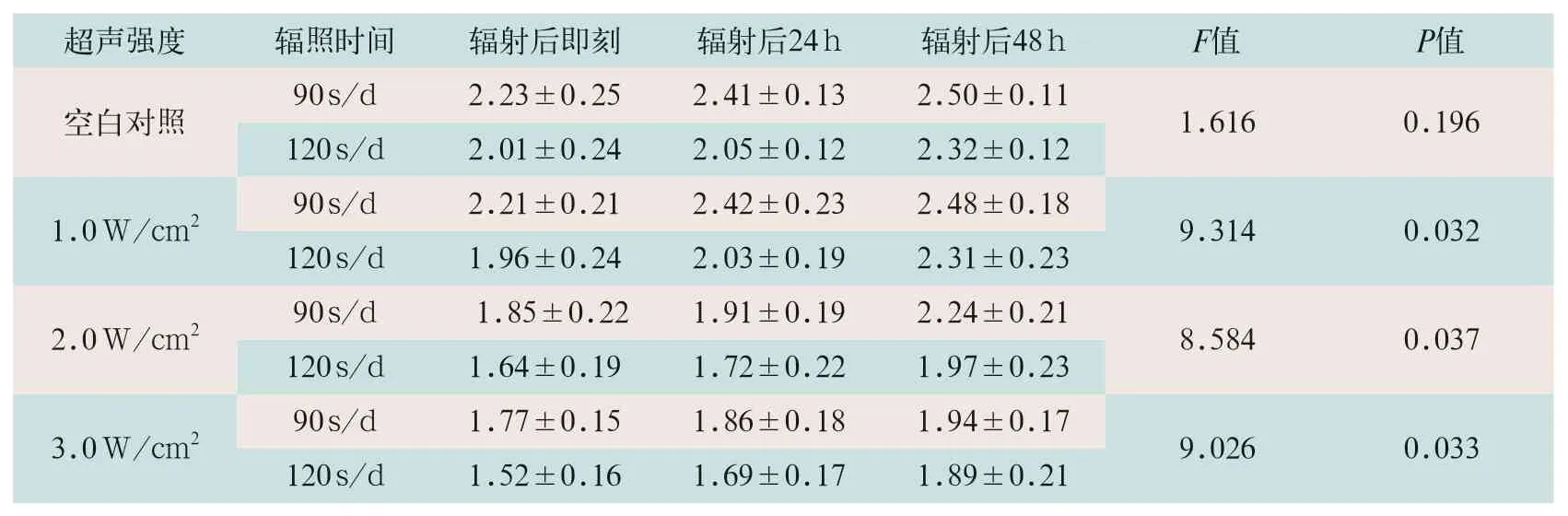
表1 不同超声强度及辐射时间对MSC活性吸光度影响的比较()
2.2 三组大鼠心肌归巢情况比较
超声微泡+MSC组小鼠移植部位毛细血管数、荧光标记细胞数最高,三组大鼠移植部位毛细血管数、荧光标记细胞数比较差异均有统计学意义(F=25.043,F=36.697;P<0.05),见表2。
表2 三组大鼠移植部位心肌组织学检查结果比较()
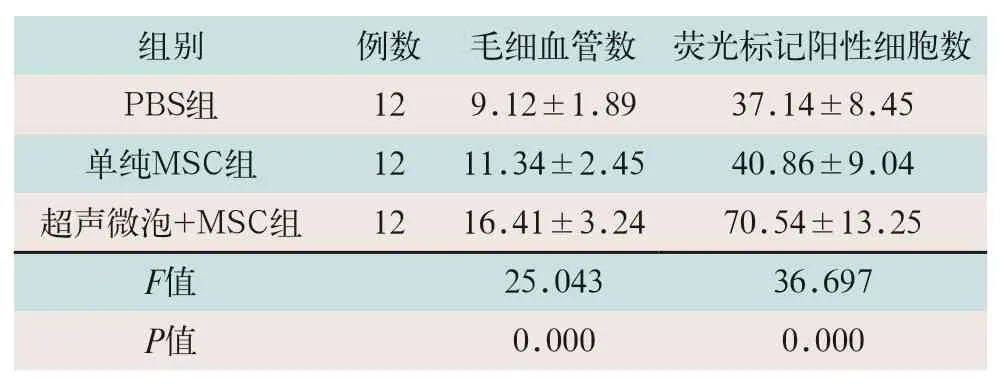
表2 三组大鼠移植部位心肌组织学检查结果比较()
2.3 三组大鼠心功能情况比较
三组大鼠的心功能左室舒张末期容积、左室收缩末期容积、室壁厚度和射血分数比较,差异均有统计学意义(F=9.075,F=27.529,F=3.594,F=62.175;P<0.05),见表3。
左室舒张末期容积、左室收缩末期容积以PBS组最高;室壁厚度、射血分数以超声微泡+MSC组最高,见图1。
表3 三组大鼠心功能情况比较()

表3 三组大鼠心功能情况比较()

图1 三组大鼠心脏M型超声图像比较
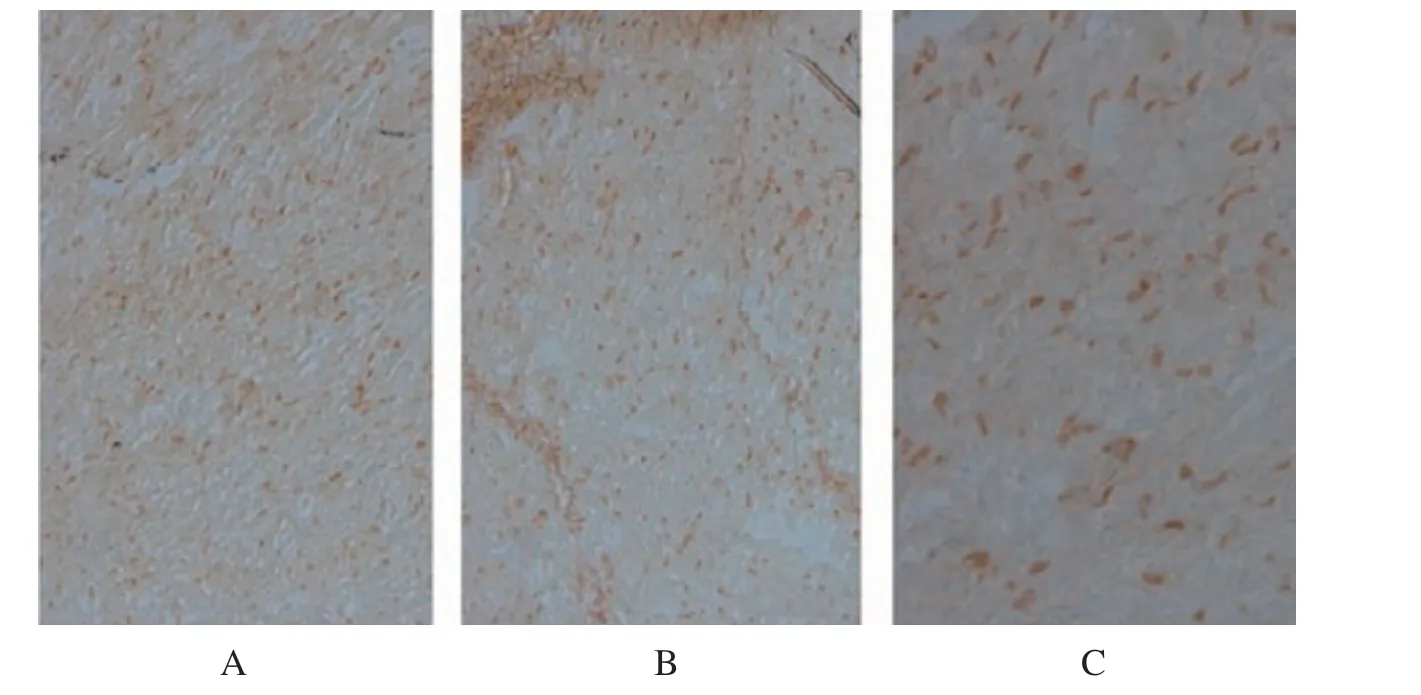
图2 三组大鼠心肌Tunnel染色
2.4 三组大鼠心肌组织学结果
Tunnel染色结果:PBS组Tunnel阳性细胞计数较MSC组、超声微泡+MSC组增多,超声微泡+MSC组Tunnel阳性细胞计数较MSC组减少,见图2。
2.5 三组大鼠心肌bax与bcl-2蛋白表达变化
三组大鼠的bax蛋白、bcl-2蛋白以及bcl-2/bax表达水平比较,差异均有统计学意义(F=9.333,F=7.962,F=29.514;P<0.05),见表4。
表4 三组大鼠心肌bax与bcl-2蛋白水平比较()

表4 三组大鼠心肌bax与bcl-2蛋白水平比较()
bax蛋白以PBS组最高,bcl-2蛋白和bcl-2/bax以超声微泡+MSC组最高,Western-blotting检测各组大鼠心肌Bcl-2、Bax表达电泳见图3。
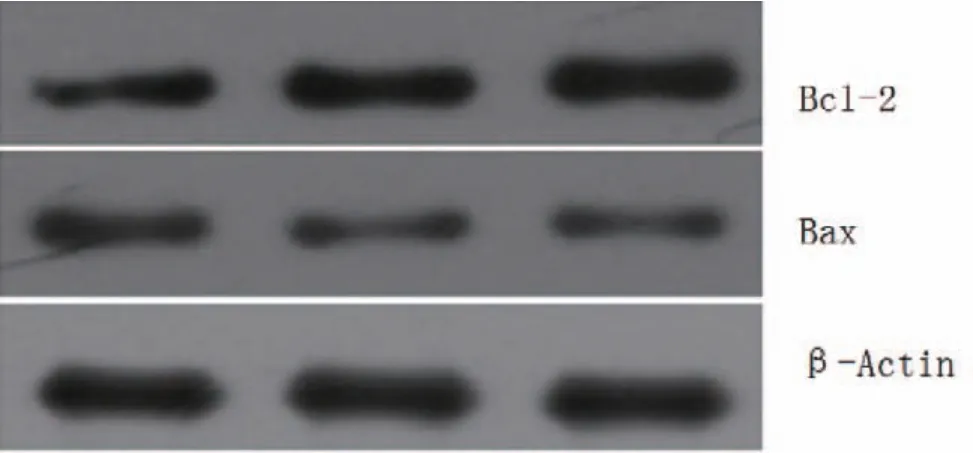
图3 Western-blotting检测三组大鼠心肌bcl-2、bax表达
2.6 三组大鼠移植后MSC心肌归巢阳性比率比较
三组大鼠移植前MSC心肌归巢阳性比率相比差异无统计学意义(F=0.020,P>0.05)。移植后24 h,PBS组、单纯MSC组和超声微泡+MSC组MSC心肌归巢阳性比率均显著高于移植前,差异有统计学意义(t=3.462,t=5.014,t=7.568;P<0.05)。移植后24 h三组的MSC心肌归巢阳性率比较,差异有统计学意义(F=166.411,P<0.05),见表5。
3 讨论
阿霉素产生心肌毒性的机制主要包括自由基、线粒体损伤、细胞凋亡、阿霉素继发性代谢物等,各种因素共同推动阿霉素心脏毒性的发生和发展[4]。陈飞等[5]研究表明,骨髓间充质干细胞移植可以改善心梗后心功能。超声微泡介导可以显著促进骨髓MSC归巢,其机制可能与微泡空化效应使血管内皮细胞间隙增宽,毛细血管通透性增加,改善缺血心肌的灌注有关[5]。
表5 三组大鼠移植后MSC心肌归巢阳性比率的比较(%,)

表5 三组大鼠移植后MSC心肌归巢阳性比率的比较(%,)
本研究结果显示,超声微泡干预下,超声微泡+MSC组毛细血管数量显著多于PBS组,表明超声微泡介导干细胞移植能够更加有效地促进心肌缺血区新生毛细血管的新生,进一步改善因阿霉素导致心肌血液供给不足的状况[5]。
MSC移植后可取代坏死的心肌细胞,分化为有收缩性的心肌样细胞,从而改善坏死心肌弹性,限制阿霉素心肌病区室壁变薄[6]。本研究发现,左室舒张末期容积、左室收缩末期容积以超声微泡+MSC组最小;室壁厚度、射血分数以超声微泡+MSC组最大,表明在超声微泡干预下,MSC移植可改善阿霉素心肌病的收缩功能,可能是MSC的新生细胞增加了心肌收缩力及改善心肌重构,与陈飞等[5]研究结论相似。
阿霉素能够通过促进bcl-2表达下调、bax表达上调引起心肌细胞凋亡,bcl-2/bax比值升高,bcl-2与bax形成异源二聚体时,则可以阻止bax蛋白的促细胞凋亡作用[7-8]。本研究发现,超声微泡+MSC组的bax蛋白表达水平显著低于其他组,bcl-2、bcl-2/bax蛋白表达水平显著高于其他组,表明超声微泡干预介导MSC移植能够增加bcl-2表达,降低bax表达,抑制阿霉素导致的心肌细胞凋亡,从而改善阿霉素心肌病大鼠心功能。本研究发现,移植后24 h MSC心肌归巢阳性比率以超声微泡+MSC组最高,表明超声微泡介导MSC移植的归巢特性明显,大部分MSC均成活,并且逐步分化为心肌细胞,从而提高SD大鼠心肌自我修复能力。
5 结论
超声微泡介导干细胞移植对阿霉素心肌病治疗效果明显,在超声微泡干预下,MSC移植可改善阿霉素心肌病的收缩功能,可能是MSC的新生细胞增加了心肌收缩力及改善心肌重构,有利于促进心肌细胞再生,改善因阿霉素心肌梗死而受损的心功能。

