枸杞叶多糖提取工艺优化及其缓解小鼠过敏性鼻炎的研究
赵嘉庆,肖静,史春丽,王立英, 何斌,高小平
1(宁夏医科大学总医院 耳鼻咽喉头颈外科,宁夏 银川,750004)2(宁夏回族自治区医学科学研究所,宁夏 银川,750004) 3(宁夏医科大学 基础医学院,宁夏 银川,750004)4(宁夏森淼枸杞科技开发有限公司,宁夏 银川 750000)
过敏性鼻炎(allergic rhinitis,AR)是世界上最常见的慢性炎症性疾病之一,严重影响个人生活质量。数据显示,过敏性鼻炎影响着世界上10%~40%的人口[1]。在一些西方国家,大约有900万人深受其害,它严重损害睡眠质量和认知功能,使人变得易怒和疲劳,降低人们的生活质量和工作学习表现[2-3]。作为一种过敏性疾病,AR是由免疫球蛋白E(immunoglobulins E,IgE)介导的适应性免疫应答引起的,淋巴细胞,肥大细胞,嗜酸性细胞之间复杂的相互作用在其发生发展中均发挥着作用,多种炎性细胞浸润为AR的主要特征[4-5]。Th1/Th2细胞比例失衡被认为是过敏性疾病发病的重要诱因之一[6]。当易感人群暴露于过敏原时,Th2细胞分泌IL-4,B细胞产生IgE,嗜酸性粒细胞活化释放一系列促炎因子引起以鼻部症状为特征的疾病,临床上主要表现为鼻塞、打喷嚏、鼻痒和流鼻涕等症状[7-8]。有研究表明糖皮质激素是控制这种过敏性疾病炎症方面最有效的药物,虽然激素在减轻炎症方面效果显著,但是它强大的抗炎作用往往也带来了严重的副作用[9]。故而在缓解炎症的同时寻求新的、温和的治疗手段来治疗AR尤为迫切。
枸杞是一种传统的中药,同时还作为食品补充剂普遍应用于人们的日常保健[10]。它富含枸杞多糖、甜菜碱、酚类、类胡萝卜素、脑苷、黄酮和维生素等多种物质,其中枸杞多糖是枸杞的主要活性成分[11]。有文献报道从枸杞果中提取的多糖可能与枸杞具有抗氧化、抗衰老、神经保护、细胞保护、免疫调节等多种生物活性有关[12]。在一项实验研究中表明LBP对环磷酰胺(cyclophosphamide,CTX)诱导的小鼠具有免疫调节作用,枸杞多糖能保护免疫器官(提高免疫器官指数,减轻免疫器官损伤),促进免疫相关细胞因子的产生,增强宿主免疫系统[13]。本实验主要以达到枸杞叶多糖最佳提取得率为目的,优化枸杞叶多糖的提取工艺,并探究LBP对过敏性鼻炎小鼠的免疫调节作用。
1 材料与方法
1.1 动物、材料与试剂
1.1.1 动物
30只雌性C57BL/6小鼠(购自北京维通利华实验动物公司),经过1周检疫期后,饲养于宁夏医科大学实验动物中心SPF级的动物房中,实验动物均符合动物伦理委员会的要求。
1.1.2 材料与试剂
宁杞9号天精菜,森淼公司;卵清蛋白(ovalbumin,OVA), Sigma公司;氢氧化铝凝胶, Thermo公司;HE染色试剂盒、PAS染色试剂盒、MPO染色试剂盒、甲苯胺蓝染色试剂盒,北京博奥拓达科技有限公司;红细胞裂解液、异硫氰酸荧光素(fluorescein isothiocyanate,FITC)标记的CD4、别藻蓝蛋白(allophycocyanin,APC)标记的CD3、藻红蛋白(phycoerythrin,PE)标记的IL-4、多甲藻黄素-叶绿素蛋白-花青素5.5(peridinin-chlorophyll-protein complex-cyanine 5.5,PerCP-Cy5.5)标记的IFN-γ,Biolegend。
1.2 仪器与设备
LDZX-75KBS蒸汽灭菌高压锅,山东博科科学仪器有限公司;SJ-CJ-2FD超净工作台,苏洁医疗有限公司;BX43光学显微镜,深圳市三利化学品有限公司;TS-NS-300中试水提醇沉设备,上海顺仪实验设备有限公司;710-ES等离子体发射光谱仪,美国瓦里安;UPT-I-40L超纯水器,成都优普;BD FACS Celesta流式细胞仪,美国BD Biosciences。
1.3 试验方法
1.3.1 枸杞叶多糖的提取工艺
本次实验以宁杞9号天精菜为原料,在前期对单因素筛查结果的基础上,以提取液料比、温度、时间作为影响因素,以枸杞叶多糖提取率作为衡量指标进行正交优化实验(3因素3水平)对枸杞叶多糖进行提取。
1.3.2 枸杞叶多糖含量
根据最优的提取工艺参数,以宁杞9号天精菜为原料,制备枸杞叶多糖并测定其多糖含量。
1.3.3 OVA诱导的过敏性鼻炎小鼠模型的构建
为构建疾病模型,每只小鼠1周腹腔注射1次200 μL OVA致敏液[内含100 μg OVA与4 mg Al(OH)3]致敏,连续3次;致敏结束一周后,每只小鼠用50 μL的OVA激发液(1 mg/mL)连续滴鼻一周激发,以完成过敏性鼻炎小鼠模型的构建。对于LBP干预组,在建立哮喘模型前2周开始先给小鼠每天灌胃LBP 300 μL(100 mg/kg)直至小鼠处死,对照组小鼠每天以生理盐水代替LBP。
1.3.4 实验分组
将30只雌性C57BL/6小鼠随机分为3组,分别为对照组,过敏性鼻炎模型组,LBP干预过敏性鼻炎组。
1.3.5 小鼠鼻部症状评分
末次滴鼻致敏后观察小鼠30 min内抓鼻、打喷嚏的次数以及流涕症状进行小鼠鼻部症状评分,总分>5认为造模成功。记分标准[14]如下:(1)搔鼻1~2次,记为1分;剧烈挠鼻不止,记为3分;介于二者之间,记为2分。(2)喷嚏,1~3个,记为1分;4~10个,记为2分;>11个,记为3分。(3)流涕,流至前鼻孔,记为1分;超出前鼻孔;记为2分;涕流满面,记为3分。
1.3.6 鼻黏膜炎症细胞染色
将小鼠鼻前部组织用40 g/L多聚甲醛固定,多层脱水后制作石蜡切片,同时进行苏木精-伊红(hematoxylin-eosin,HE)染色、过碘酸-希夫(periodic acid-schiff stain,PSA)染色、甲苯胺蓝染色、髓过氧化物酶(myelpoperoxidasedficiency,MPO)染色后观察鼻黏膜组织结构,以及杯状细胞,肥大细胞,嗜酸性粒细胞浸润。
1.3.7 脾脏细胞悬液Th细胞比例
向小鼠腹腔注射戊巴比妥钠麻醉后,取小鼠脾脏,加完全培养基经300目尼龙网膜研磨过滤得单细胞悬液。随后将得到的细胞悬液用红细胞裂解液处理去除残留的红细胞,PBS洗涤2次后,牛鲍式计数板计数并调整浓度为1×107个/mL,并加入胞内因子刺激剂37 ℃,5%(体积分数)CO2培养5 h。取100 μL细胞悬液加入1 μL FITC标记的抗小鼠CD4抗体,2 μL APC标记的抗小鼠CD3冰上避光孵育30 min,加入PerCP-Cy5.5标记的IFN-γ以及PE标记的IL-4边破膜边染色,室温孵育30 min,经染色缓冲液洗涤后,100 μL多聚甲醛重悬细胞并用流式细胞仪分析Th1细胞(CD3+CD4+IFN-γ+)和Th2细胞(CD3+CD4+IL-4+)百分比。
1.3.8 统计学分析
使用GraphPad Prism 5.0 软件进行统计学分析,各组实验数据均用均数±标准差表示,组间差异显著性判断采用单因素方差分析,若有统计学意义,则进行组间比较,采用LSD-t检验,P<0.05 为差异有统计学意义。
2 结果与分析
2.1 枸杞叶多糖的提取工艺研究
通过开展以提取时间、温度、料液比作为影响因素,以枸杞叶多糖提取率作为衡量指标进行正交优化实验(3因素3水平)对枸杞叶多糖进行提取,最终确定的枸杞叶多糖最优提取工艺为提取时间8 h,提取温度50 ℃,料液比1∶25(g∶mL)。此条件下得到的枸杞叶多糖提取率最高达到9.61%。正交实验结果如表1所示。

表1 枸杞多糖提取率正交实验结果以及方差分析Table 1 Orthogonal experiment and variance analysis of extraction rate of LBP
由表2可知,极值R(B)>R(C)>R(A),从而得出影响枸杞叶多糖提取率的主次因素依次为提取温度、料液比、提取时间。正交实验结果表明,各因素不同水平的最佳配比为A1B2C2。即提取时间为8 h,提取温度为50 ℃,料液比为1∶25(g∶mL)。此条件下得到的枸杞多糖提取率最高,质量较优。
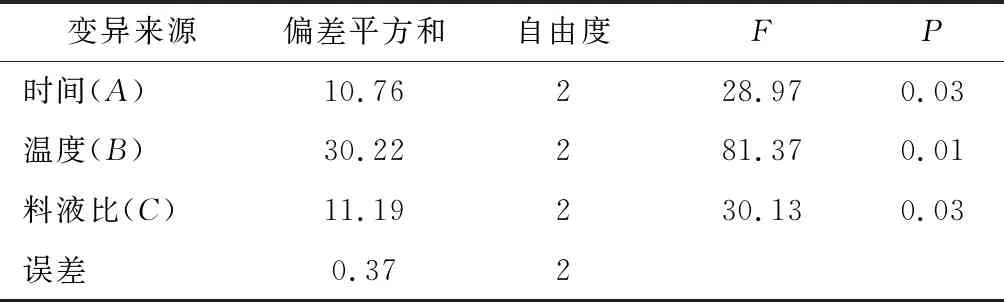
表2 枸杞叶多糖提取率方差分析Table 2 Analysis of variance of extraction rate of LBP
2.2 枸杞叶多糖成分测定
2.2.1 枸杞叶中多糖的测定
根据最优的提取工艺参数,制备枸杞叶多糖,并对其中标志性有效活性成分进行含量测定。结果表明枸杞叶多糖中多糖的含量为61.27%,其含量测定标准曲线方程及测定结果见表3和表4。
2.2.2 枸杞叶多糖中甜菜碱含量测定
同样以最优提取工艺参数,对枸杞叶多糖中甜菜碱含量进行测定,结果表明枸杞叶多糖中甜菜碱的平均含量约为2.71%。具体的含量测定标准曲线方程及测定方法见表5和表6。

表3 枸杞叶多糖中多糖含量测定标准曲线方程Table 3 Standard curve equation for the determination of polysaccharide content in LBP

表4 枸杞叶多糖中多糖含量测定结果 Tab.4 Determination of polysaccharide content in LBP

表5 枸杞叶多糖中甜菜碱含量测定标准曲线Table 5 Standard curve for determination of betaine content in LBP

表6 枸杞叶多糖中甜菜碱含量测定结果Table 6 Determination of betaine content in LBP
2.2.3 枸杞多糖中氨基酸、矿物质含量测定
本课题组对枸杞多糖中氨基酸、矿物质测定的详细结果已有报道,其中常量元素Ca、P、Mg、K、Na的含量分别为0.095%、2.57%、2.89%、4.39%、1.00%,天冬氨酸以及谷氨酸分别为1.86%和1.17%[15]。
2.3 LBP改善过敏性鼻炎小鼠的常规状态
经过OVA诱导的致敏组小鼠频繁挠鼻,烦躁好动。3组小鼠的行为生物学表明:与对照组相比,过敏性鼻炎模型组的小鼠挠鼻次数明显增加,多次出现喷嚏及水样鼻涕,并且出现呼吸频率加快的现象,这些现象均表明模型构建成功;LBP干预过敏性鼻炎组与过敏性鼻炎模型组相比,LBP干预后小鼠的挠鼻次数减少,出现水样鼻涕及喷嚏的次数减少,呼吸频次相对缓和,以上现象说明LBP可以缓解过敏性鼻炎小鼠的过敏性症状。综上所述,从小鼠的行为生物学来看,过敏性鼻炎模型组小鼠的鼻炎症状最重,经过LBP干预后,小鼠的常规状态明显好于过敏性鼻炎模型组,这提示LBP可改善过敏性鼻炎小鼠的过敏状态。同时对小鼠的鼻部症状进行评分如表7所示。

表7 各组小鼠鼻部症状评分Table 7 Nasal symptom score in each group
2.4 LBP减轻过敏性鼻炎小鼠鼻黏膜炎症细胞浸润
2.4.1 LBP减轻鼻黏膜炎症水平
鼻黏膜固有层为疏松结缔组织,包括肥大细胞,嗜酸性粒细胞,淋巴细胞等多种炎症细胞,还有丰富的血管和腺体,鼻黏膜静脉丛发达[16-18]。正常情况下静脉丛呈收缩状态,受刺激后可反射性扩张充血引起鼻塞,静脉丛破裂还有可能引起鼻部出血;腺体的分泌物可以润滑鼻黏膜,黏附细菌和异物,在病理条件下,腺体分泌增加临床上可表现为清涕。HE染色3组鼻黏膜的结果见图1,对照组的鼻黏膜假复层纤毛柱状上皮细胞核呈2层或者3层,排列整齐,黏膜下少量淋巴细胞浸润,黏膜下腺体呈正常生长状态。与对照组相比,哮喘模型组的鼻黏膜假复层纤毛柱状上皮明显增厚,且黏膜下大量炎症细胞浸润,毛细血管扩张,有大量空泡状胞浆疏松区域,为黏膜下腺体增生从而分泌的黏液或者浆液。与过敏性鼻炎模型组相比,LBP干预组的鼻黏膜假复层纤毛柱状上皮增厚程度明显减轻,黏液腺体增生程度减少。

a-对照组;b-过敏性鼻炎模型组;c-LBP干预过敏性鼻炎组图1 三组小鼠鼻黏膜HE染色Fig.1 HE staining of nasal mucosa in three groups
2.4.2 LBP减轻鼻黏膜杯状细胞浸润
鼻黏膜上皮主要由柱状细胞,杯状细胞和基细胞组成,杯状细胞增生会引起黏液分泌过多[19]。用PAS将杯状细胞染成紫红色,3组PAS染色的结果如图2所示(杯状细胞如下图箭头所示),杯状细胞一般呈散在分布,当有炎症发生时杯状细胞胞内充满黏原颗粒,局部增大,当黏原颗粒释放后可参与上皮表面黏液毯的形成。与对照组形成相比,过敏性鼻炎模型组有大量散在分布的杯状细胞,且细胞呈典型的高脚杯状,胞核位于底部,胞质充满紫红色黏液颗粒,且黏液呈喷射状向腔面隆起。杯状细胞作为黏膜免疫的一种“哨兵”可以分泌黏液来维持黏膜稳态和抵御感染,是免疫系统不可或缺的细胞[20-21]。然而过多的黏液分泌会造成临床上以鼻塞等为特点的过敏性症状,采取一定的措施降低过敏性鼻炎患者杯状细胞的数量会一定程度缓解病人的痛苦。在经过LBP干预后,观察过敏性鼻炎小鼠鼻黏膜中阳性杯状细胞的数量明显减少,这为我们在治疗过敏性鼻炎策略上提供了新思路。

a-对照组;b-过敏性鼻炎模型组;c-LBP干预过敏性鼻炎组图2 三组小鼠鼻黏膜PAS染色Fig.2 PAS staining of nasal mucosa in three groups
2.4.3 LBP减轻鼻黏膜肥大细胞浸润
肥大细胞是炎症细胞因子、蛋白酶、血管内皮生长因子和肥大细胞特异性介质的丰富来源,在炎症中促进组织结构重塑[22]。有研究表明,在哮喘这种过敏性疾病中,肥大细胞是处于“激活”状态的,这种不当的激活会使肥大细胞重新分布到特定的部位从而介导有害性的组织重塑过程[23]。在过敏反应的早期和急性阶段,肥大细胞被认为是过敏反应的效应细胞,特异性IgE与肥大细胞表面IgE受体结合促进肥大细胞释放组胺等过敏性介质使得血管通透性增加、平滑肌收缩和黏液分泌[24]。肥大细胞是异染细胞,其胞质内含有肝素和组胺等异色物质遇到甲苯胺蓝可呈异染性紫红色[25]。3组甲苯胺蓝染色结果见图3(肥大细胞如下图箭头所示):对照组黏膜下层和黏膜间质中基本没有肥大细胞浸润。过敏性鼻炎模型组黏膜下可见染成紫红色的肥大细胞,有些肥大细胞胞膜不完整,有些细胞呈空泡状,胞质着色不均匀,肥大细胞周围可见脱出的颗粒物质。与过敏性鼻炎模型组相比,LBP干预组肥大细胞数量减少,由此可见LBP可以减少肥大细胞在小鼠鼻黏膜中的浸润,具备改善小鼠过敏性炎症的潜能。

a-对照组;b-过敏性鼻炎模型组;c-LBP过敏性鼻炎干预组图3 三组小鼠鼻黏膜甲苯胺蓝染色Fig.3 Toluidine blue staining of nasal mucosa in three groups
2.4.4 LBP减轻嗜酸性粒细胞浸润
嗜酸性粒细胞在先天性免疫和获得性免疫中均发挥重要的作用,它可以作为抗原提呈细胞处理抗原,通过产生T细胞极化细胞因子刺激T细胞,通过与B细胞相互作用促进体液免疫反应,由此可见嗜酸性粒细胞具有免疫调节能力[26]。作为一种终末效应细胞,嗜酸性粒细胞可以释放阳离子蛋白、细胞因子、趋化因子发挥作用,然而过多的效应细胞会造成组织损伤[27-29]。对嗜酸性粒细胞进行MPO染色,细胞内阳性颗粒呈棕黄色或者蓝黑色,3组MPO染色结果如图4所示(嗜酸性粒细胞细胞如下图箭头所示):过敏性鼻炎组鼻黏膜固有层可见大量的嗜酸性粒细胞浸润,经过LBP干预后,小鼠鼻黏膜中棕黄色的阳性细胞数明显减少。嗜酸性粒细胞是重要的免疫效应细胞和炎性细胞,是介导炎症反应的主要细胞因子之一[30]。经过LBP干预后鼻黏膜嗜酸性粒细胞减少这表明LBP可以减轻过敏性鼻炎小鼠的炎症反应,实现对小鼠过敏性鼻炎的缓解作用。

a-对照组;b-过敏性鼻炎模型组;c-LBP干预过敏性鼻炎组图4 三组小鼠鼻黏膜MPO染色Fig.4 MPO staining of nasal mucosa in three groups
2.4.5 脾脏Th1/Th2细胞比例变化
在机体免疫系统细胞中,T淋巴细胞的子集辅助性T(Th)细胞是免疫调节的关键调节点,Th1/Th2细胞平衡紊乱在过敏性疾病以及多种自身免疫病中均有报道,主要表现为Th2细胞相关的细胞因子升高[31-32]。Th细胞可以根据其细胞因子谱进行区分从而赋予Th亚型不同的功能特性,Th1细胞相关的细胞因子是IFN-γ和TNF;Th2相关的细胞因子是IL-4、IL-5和IL-13[33]。脾脏是机体重要的免疫器官,以CD3+细胞画门,对小鼠脾脏淋巴细胞Th1(CD4+、IFN-γ+),Th2(CD4+、IL-4+)细胞进行流式细胞术分析如图5、图6所示(Th1/Th2细胞比例如图5、图6右侧),在过敏性鼻炎模型组中Th1细胞比例为1.1%,Th2细胞比例为1.7%,与对照组Th1细胞比例3.8%,Th2细胞比例0.8%相比具有显著差异。在过敏性鼻炎模型组中Th2细胞比例增高,Th1细胞比例下降这与其他报道中过敏性疾病Th1/Th2细胞比例失衡一致[6]。经过LBP干预后Th1细胞比例为5.5%,Th2细胞比例为0.6%,上述结果表明LBP具有调节Th细胞免疫应答的功能。

a-对照组;b-过敏性鼻炎模型组;c-LBP干预过敏性鼻炎组图5 三组小鼠脾脏Th1细胞比例Fig.5 Proportion of Th1 cells in spleen of mice in the three groups注:*代表每组分别与b组相比P<0.05(下同)

a-对照组;b-过敏性鼻炎模型组;c-LBP干预过敏性鼻炎组图6 三组小鼠脾脏Th2细胞比例Fig.6 Proportion of Th2 cells in spleen of mice in the three groups
3 结论
本次实验以提取时间8 h,提取温度50 ℃,料液比1∶25(g∶mL)为条件得到的枸杞叶多糖提取率最高。观察小鼠的生存状态发现,经过LBP干预后过敏性鼻炎小鼠的挠鼻次数,打喷嚏的次数较过敏性鼻炎模型组均减少。对小鼠的鼻黏膜进行组织化学染色后发现,LBP干预后可以减少小鼠鼻黏膜炎症细胞的浸润,初步证实了LBP可以缓解过敏性鼻炎小鼠。流式细胞术分析Th1/Th2细胞比例同时证实了LBP可以纠正Th细胞的失衡,具有调节小鼠免疫系统的功能。过敏性鼻炎和过敏性哮喘均属于过敏性疾病,有研究表明LBP可以从减轻气道炎症和调节肠道菌群这两个方面来改善过敏性哮喘[15]。这与我们此次实验得到的结论是相吻合的,在本次实验中我们虽然证实了LBP可以缓解过敏性鼻炎,但是其作用机制目前仍然不清楚,有待进一步的研究。

