动物源食品中噻菌灵残留分析的净化方法比较
陈丽霞,许丽建
(琼台师范学院 数理系,海南 海口,571100)
动物源食品是人体补充蛋白质的主要来源,生活中常见的动物源食品包括肉类、蛋类和奶类等[1-2]。近年来动物源食品中各类农药残留引起的质量安全问题被广泛关注[3],一方面,农药在农作物中使用以后,其残留可能通过食物链进入到动物源食品中[4-5];另一方面,部分农药可以直接作为动物源食品生产中的杀虫剂、消毒剂等[6],引发残留风险。因此,为保障动物源食品的质量安全,迫切需要开展动物源食品中农药残留的检测分析方法相关的研究。
液相色谱-串联质谱法具有灵敏度高、分析速度快等优点,可同时测定多种农药残留,近年来被广泛应用于各类植物源和动物源食品的检测分析[7-9]。动物源食品通常包括肉类、内脏、蛋类和奶类等,其脂肪、蛋白质等营养成分含量较高,在农药残留分析时需要净化处理以减少其干扰。我国国家标准《GB/T 20772—2008 动物肌肉中461种农药及相关化学品残留量的测定 液相色谱-串联质谱法》等报道中使用凝胶渗透色谱(gel permeation chromatography,GPC)法对样品进行净化处理[10-12],此外,固相萃取(solid phase extraction,SPE)法[13-15]、QuEChERS法[16-18]在动物源食品检测中也表现出很好的净化效果。
噻菌灵(thiabendazole)属苯咪唑类杀菌剂,是一种内吸性植物杀菌剂[19],也是动物生长中的广谱性抗寄生虫药[20-21]。本实验选择噻菌灵及其代谢物5-羟基噻菌灵(5-hydroxythiabendazole),分子结构式见图1。对比研究GPC、SPE和QuEChERS 3种净化方法在猪肉、鸡蛋、牛奶、猪肝和鸡肉中的净化效果,为动物源食品的前处理方法提供技术支持。

图1 噻菌灵和5-羟基噻菌灵的分子结构式Fig.1 Molecular of thiabendazole and 5-hydroxythiabendazole
1 材料与方法
1.1 仪器、试剂与样品
实验仪器:超高压液相色谱系统,Waters公司;AB SCIEX API4000+质谱系统,AB公司;ACQUITY UPLC®BEH C18色谱柱(100 mm×2.1 mm×1.7 μm)Waters公司;GPC VARIO凝胶渗透色谱仪,德国LCTech;高速匀浆机,IKA公司;多管旋涡混合器,北京同德创业科技公司;高速离心机,日本日立公司;旋涡混合仪,上海沪西分析仪器厂。
实验用水均为超纯水,Millipore,USA公司;乙腈、甲醇(色谱纯),Fisher Scientific试剂公司;PSA吸附剂(N-丙基乙二胺,分析纯),Biocomma公司;C18吸附剂(40~63 μm),上海Anpel公司;NaCl、无水MgSO4(分析纯),广州化学试剂厂。
噻菌灵和5-羟基噻菌灵农药标准品,购自德国Dr.Ehrenstorfer公司。
猪肉(瘦肉)、鸡蛋、牛奶、猪肝和鸡肉,均购自海口本地市场,猪肉、猪肝和鸡肉使用绞肉机粉碎,鸡蛋使用匀浆机搅匀,制成待测样。
1.2 分析方法
1.2.1 样品的提取
准确称取猪肉、鸡蛋、牛奶、猪肝或鸡肉样品各5.00 g(精确到0.01 g)放入50 mL离心管中,加入25.0 mL乙腈溶剂进行提取,使用高速匀浆机在15 000 r/min下匀浆1 min。为降低样品中的蛋白质等杂质的影响,在样品中再加入2~3 g NaCl,继续在15 000 r/min下匀浆1 min。将离心管在4 000 r/min下离心5 min,使液体和固体相完全分离,同时使有机相与水相分层,取上层乙腈相溶液待净化。
1.2.2 样品的净化
(1)GPC法
取10 mL乙腈提取液在50 ℃减压蒸干,用乙酸乙酯+环己烷(体积比1∶1)溶液定容至5 mL,使用GPC净化。GPC选择Bio-BeadsS-X3(38~75 μm)作为填料,规格为400 mm×25 mm;使用乙酸乙酯+环己烷(体积比1∶1)作为流动相,流速为5 mL/min;淋洗的预冲时间为15 min,收集时间为10 min。GPC样品在收集后,于50 ℃减压蒸干,用乙腈溶液定容至10.0 mL溶解后,过0.22 μm微孔有机滤膜后上机测定。
(2)SPE法
取5 mL乙腈提取液在50 ℃减压蒸干,用固相萃取小柱进行净化。分别用100 mg的C18吸附剂和100 mg的PSA吸附剂装填固相萃取小柱,并在上下方别装入250 mg无水MgSO4吸水。分别用5 mL超纯水和5 mL甲醇活化萃取小柱,用2 mL甲醇溶解样品后上样,用10 mL甲醇溶液分3次进行淋洗。收集淋洗液在50 ℃减压蒸干,用乙腈溶液定容至5.0 mL,过0.22 μm微孔有机滤膜后上机测定。
(3)QuEChERS法
取5 mL乙腈提取液于25 mL离心管中,依次加入500 mg的无水MgSO4去除样品中的水分,同时加入100 mg的C18吸附剂和100 mg的PSA吸附剂进行协助净化。剧烈旋涡振荡2 min,将离心管在4 000 r/min转速下离心5 min,取乙腈相溶液过0.22 μm微孔有机滤膜后上机测定。
1.2.3 仪器分析条件
色谱条件:超高压液相色谱柱选择ACQUITY UPLC®BEH C18(2.1 mm×50 mm,1.7 μm),柱温设置为25 ℃。流动相分别为乙腈(A)和0.05%甲酸水溶液(B),流速为0.25 mL/min,以梯度洗脱模式对目标物进行洗脱,确保噻菌灵及5-羟基噻菌灵得到良好分离。洗脱程序:0~1 min,10%A变为60%A;1~3.5 min,60%A变为75%A;3.5~4.0 min,保持75%A;4.0~4.5 min,75%A变为10%A;4.5~5.0 min,保持10%A。
质谱条件:选择电喷雾质谱的正离子扫描和多反应监测模式,仪器的喷雾电压为5 000 V,雾化气压力为379.225 kPa,离子源温度为550 ℃。同时监测噻菌灵和5-羟基噻菌灵,定性、定量离子对及去簇电压、碰撞电压见表1。

表1 噻菌灵与5-羟基噻菌灵的主要质谱参数Table 1 Working parameter of MS for thiabendazole and 5-hydroxythiabendazole
2 结果与分析
2.1 标准曲线及方法检出限
以质量浓度1 000 μg/mL的噻菌灵与5-羟基噻菌灵标准溶液作为母液,使用甲醇逐级稀释法分别配制0.01、0.05、0.1、0.5、1.0 μg/mL系列标准溶液,以进样标准溶液中目标物的质量浓度(μg/mL)作为横坐标X,以定量离子的峰面积作为纵坐标Y,绘制标准曲线,外标法进行定量。方法的典型色谱图见图2,线性回归方程等相关数据见表2。为保证3种净化方法的可比性,在相同的提取体积和样品稀释倍数下,噻菌灵与5-羟基噻菌灵的定量限[limit of quantitaion(LOQ),S/N=10]分别为0.002和0.01 mg/kg。我国食品质量安全国家标准GB 2763—2019中规定动物源性食品中噻菌灵的残留定义为噻菌灵与5-羟基噻菌灵之和,其中最大残留限量值的最低值为0.05 mg/kg(禽肉类),最高值为1 mg/kg(牛肾),本方法可满足其检测分析的需求。
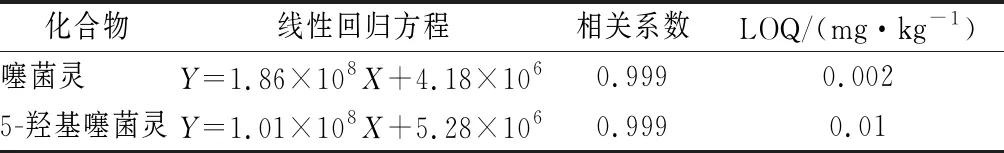
表2 噻菌灵与5-羟基噻菌灵的线性回归方程和定量限Table 2 Standard curves and LOQs of thiabendazole and 5-hydroxythiabendazole

a-1、a-2、a-3、a-4、a-5:噻菌灵在猪肉、鸡蛋、牛奶、猪肝和鸡肉样品中的加标 回收色谱图,b-1、b-2、b-3、b-4、b-5:5-羟基噻菌灵在猪肉、鸡蛋、牛奶、 猪肝和鸡肉样品中的加标回收色谱图,加标量均为0.01 mg/kg图2 噻菌灵与5-羟基噻菌灵的典型色谱图Fig.2 Typical chromatogram of thiabendazole and 5-hydroxythiabendazole
2.2 不同净化方法的填料
本实验选择GPC法、SPE法和QuEChERS法3种净化方法,其中GPC按照国家标准(GBT 20772—2008),使用Bio-BeadsS-X3填料,依靠分子质量(400~14 000)排阻层析,可以很好地去除脂肪等杂质。在SPE和QuEChERS 2种净化方法中,本实验对比了PSA、C18对样品的净化效果,实验结果见图3。可以看出,在均使用无水MgSO4的情况下,SPE和QuEChERS两种净化方法选择PSA与C18协助净化的效果优于单独使用PSA或C18,且样品上机液清透明亮,可以很好地保证噻菌灵和代谢物5-羟基噻菌灵的净化效果,有效避免仪器污染,其原因可能是动物源样品通常含有大量脂肪、蛋白质及非极性磷脂类干扰物等杂质,给噻菌灵及其代谢物带来干扰。C18吸附剂在硅胶上键合了十八烷基官能团,对非极性干扰物具有较好去除效果,PSA吸附剂在硅胶上键合了乙二胺-N-丙基官能团,可吸附酸性化合物[22]。当只使用PSA或C18,样品中杂质的净化效果较差,引起目标化合物回收率偏低。将C18和PSA混合使用,在SPE和QuEChERS两种方法均表现出较好的净化效果。但是与SPE法相比,QuEChERS法不需要额外装填萃取小柱,快速、简捷,回收率达到要求,可用于动物源食品中农药残留分析的快速净化处理。
2.3 不同净化方法的回收率
以不含噻菌灵和5-羟基噻菌灵的猪肉、鸡蛋、牛奶、猪肝和鸡肉空白样品,分别在0.01、0.05和1.0 mg/kg 3个质量浓度进行添加回收率实验,测试GPC法、SPE法和QuEChERS法3种净化方法的准确度,实验结果见表3。GPC法在实验的3个浓度时,5次重复的平均回收率为80%~108%;SPE法在实验的3个浓度时,5次重复的平均回收率80%~110%;QuEChERS法在实验的3个浓度时,5次重复的平均回收率82%~107%。我国农业行业标准NY/T 788—2018农作物中农药残留试验准则中规定,添加水平在0.01、0.05和1.0 mg/kg时,回收率应分别为60%~120%、70%~120%和70%~110%。本实验3种净化方法对噻菌灵和5-羟基噻菌灵的添加回收率均满足要求。
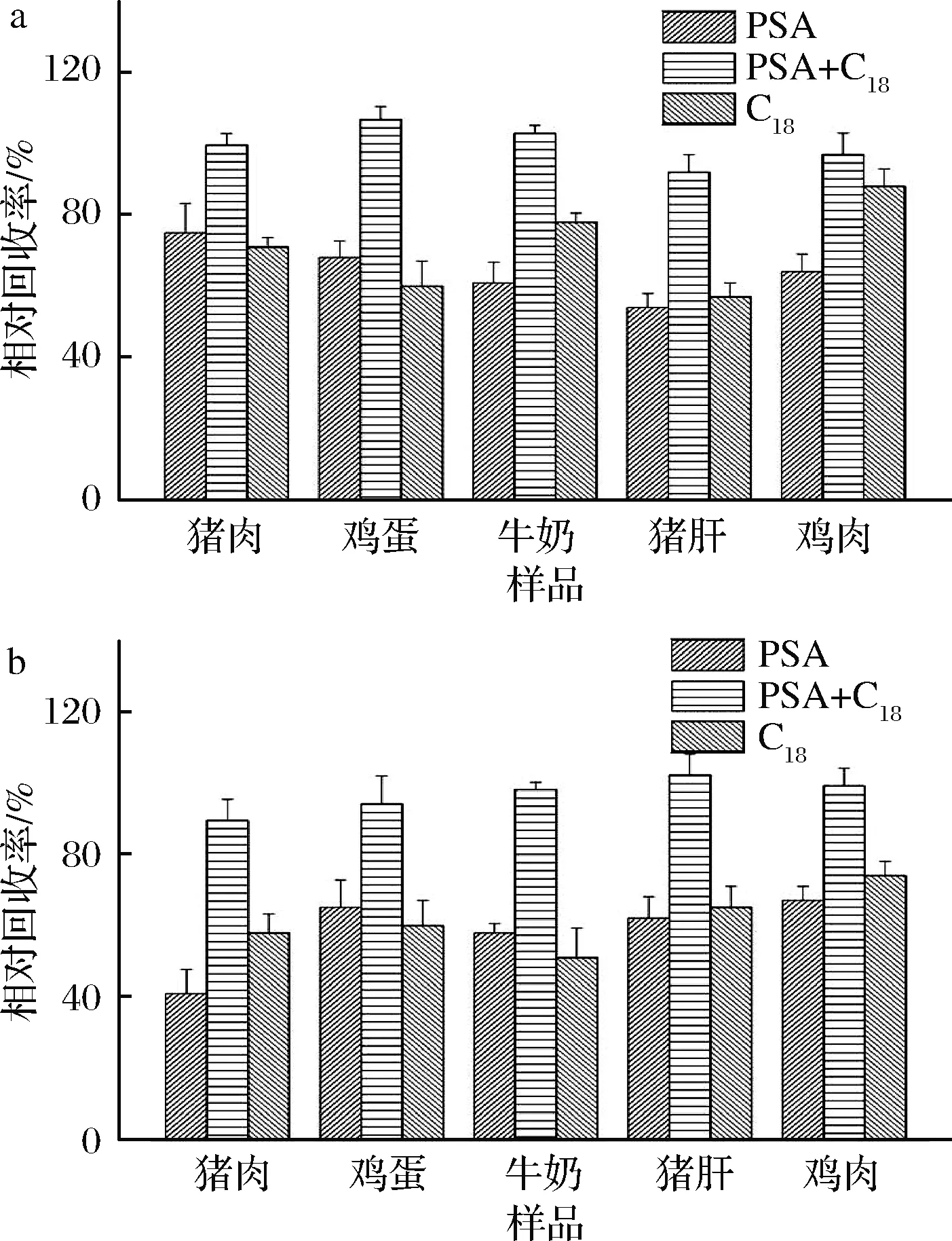
a-SPE法;b-QuEChERS法图3 SPE和QuEChERS使用不同吸附剂对比图Fig.3 Comparison of Purification between SPE and QuEChERS with different adsorbents
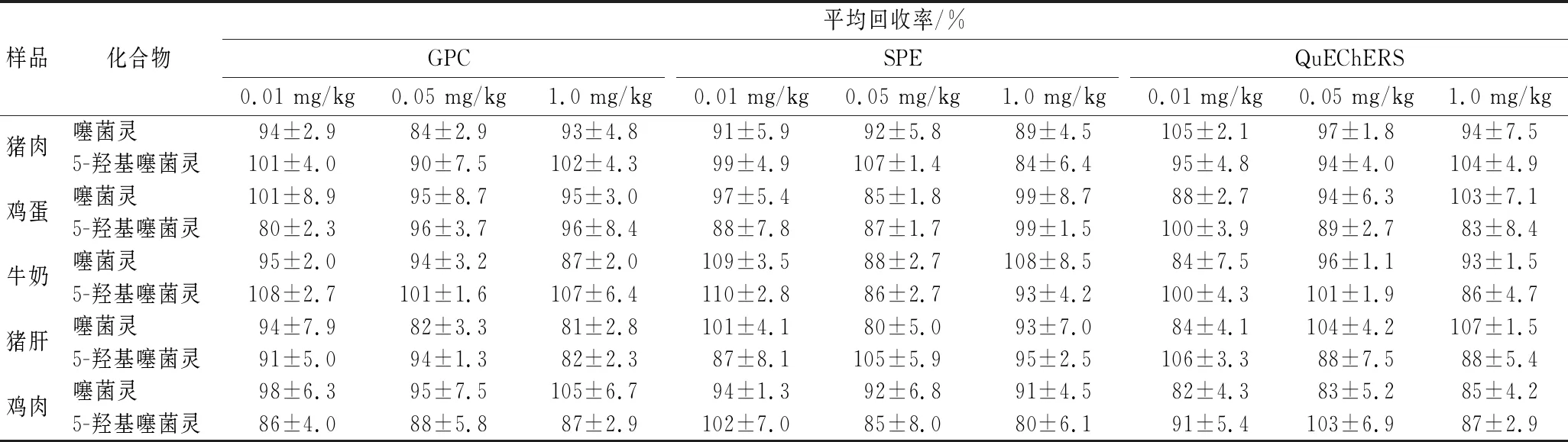
表3 噻菌灵与5-羟基噻菌灵在五种动物源食品中的添加回收率及相对标准偏差(n=5)Table 3 Recoveries and RSDs of thiabendazole and 5-hydroxythiabendazole in 5 food products of animal origin (n=5)
2.4 实际样品的检测
为了验证方法在实际样品分析中的适用性,本实验在海口本地市场抽取的猪肉、鸡蛋、牛奶、猪肝和鸡肉样品各30个,使用GPC法、SPE法和QuEChERS法3种净化方法进行前处理,并分别配制5种样品的基质标准溶液进行检测,所有样品中均未检出噻菌灵和5-羟基噻菌灵。方法具有良好的灵敏度和的重现性,可满足市场样品检测需求。
3 结论
动物源食品含有大量的脂肪等杂质,尤其是对于猪背膘、猪腩等部位,其脂肪含量可达50%以上,在前处理的净化过程需要进行脱脂及去除其他干扰杂质[23]。本实验中主要测试的样品为猪瘦肉、鸡蛋、牛奶、猪肝和鸡肉,脂肪含量较低,PSA与C18协助净化可以达到较好的效果,因此在提取后直接使用GPC法、SPE法和QuEChERS法3种净化方法处理。同时,在保证分析方法灵敏度满足需求的情况下,上机液的定容使用较大体积的溶剂,避免因浓缩带来的杂质干扰,大大简化了前处理过程,提高了分析效率。此外,当遇到猪背膘等脂肪含量高的动物源样品,可在提取时加入正己烷进行除油,其对本实验中的非脂溶性农药噻菌灵的提取率影响较小,但对于其它脂溶性农药可能会造成回收率偏低,其影响有待进一步研究。
本实验对比研究GPC法、SPE法和QuEChERS法3种净化方法在猪肉、鸡蛋、牛奶、猪肝和鸡肉等动物源食品中噻菌灵及其代谢物残留测定的净化效果。其中GPC法使用Bio-BeadsS-X3填料,SPE法和QuEChERS使用PSA与C18吸附剂协助净化,3种净化方法在样品分析时的回收率均满足要求。考虑到GPC法和SPE法需要特定的仪器或固相萃取柱,耗时费力,推荐使用快速、简捷的QuEChERS方法进行处理,可用作噻菌灵在动物源食品中的检测分析。

