秋茄幼苗生长生理及形态对不同潮汐处理的响应
代捷, 程皓, 由文辉, 王友绍,*
秋茄幼苗生长生理及形态对不同潮汐处理的响应
代捷1, 程皓2, 由文辉1, 王友绍2,*
1. 上海市城市化生态过程与生态恢复重点实验室, 华东师范大学生态与环境科学学院, 上海 200241 2. 热带海洋环境国家重点实验室, 中国科学院南海海洋研究所, 广州 510301
通过人工模拟潮汐研究了不同潮汐淹水(每天周期性水淹0 h、8 h、16 h、24 h)胁迫对秋茄幼苗茎长、生物量、茎根比、叶面积、气孔、抗氧化酶活性的影响。研究结果表明, 虽然短期的无潮水浸淹对植物正常的生长影响不大, 但是长时间的持续淹没以及无潮汐浸淹都十分不利于秋茄幼苗的生长发育。不同潮汐处理组中, 秋茄幼苗更适应16 h潮汐处理, 在四个潮汐处理中, 16 h潮汐处理的秋茄幼苗总生物量最大, 茎根比最小。我们还发现叶面积和叶片下表皮保卫细胞面积随淹水时间延长呈现出先增高后下降的趋势, 气孔参数随水淹时间延长持续升高, 以保证从外界吸收足够的氧气。另外, 叶片超氧化物歧化酶(SOD)和过氧化物酶(POD)随淹水时间延长活力增强, 清除逆境激发的过量活性氧, 以缓解水淹压力。综上, 虽然秋茄具备一定抗水淹性能, 但是周期性和适宜的潮汐作用对秋茄的生长发育至关重要。
模拟潮汐; 秋茄; 茎根比; 气孔; 活性氧
0 前言
红树林(Mangrove forest)是生长于热带、亚热带河口海湾潮间带, 受周期性潮水淹没、以红树植物为主的常绿乔灌木组成的木本植物群落。红树林是沿海岸典型的湿地生态系统, 在防风消浪、固岸护堤、发展渔业、保护生物多样性、调节局部小气候、提取海洋药物、以及发展旅游业等方面具备重大意义。但是, 近几十年来, 由于受全球气候变化与人类活动的双重影响, 红树林受损和退化严重。据FAO报道, 全球红树林正以约7 ‰的速度递减[1], 我国红树林面积历史上曾达25万hm2[2], 现存约2.2万hm2[3]。在全球变化的大背景下, 如何开展红树林的保护与恢复是全球红树林保护区及红树林工作者共同面临的挑战。
红树林作为海陆过渡带典型的湿地生态系统, 也是对全球气候变化最为脆弱的生态系统之一。全球变暖导致的海平面上升将严重威胁这一重要生态系统, 尤其是太平洋某些岛屿, 如萨摩亚群岛、斐济、图瓦卢等[4]。Duke等[5]认为到本世纪末地球上的大多红树林可能将消失殆尽。Lovelock等[4]根据其野外数据推测太平洋地区的红树林可能最早于2070年被淹没。养殖塘-海堤-红树林是我国红树林常见的景观格局。当海平面上升的速度大于沉积物堆积的速度时, 红树林分布区会朝陆地一方迁移, 然而我国的大部分红树林区陆岸都筑有海堤, 这将阻碍红树林向陆迁移。我国海南亚龙湾青梅港红树林自然保护区, 在2010年至2012年期间因为暴雨所导致的局部洪涝灾害,造成了红树林的大面积死亡[6]。
为应对水淹胁迫, 红树植物在形态结构、生理生化及分子调控等方面具有一系列的响应和适应机制, 如叶面积的变化[7]、根通气组织的发育[8]、抗氧化酶活性的提高[9]、乙醇脱氢酶的大量表达等[10]。陈鹭真等[7]模拟正规半日潮淹水的条件, 研究了淹水胁迫对秋茄幼苗的生长影响, 探究秋茄最佳及临界的淹水时间。廖宝文等[11]测定了在不同淹水时间下秋茄幼苗的生长、生物量积累及生理指标的变化; Ye等[9]探讨了渍水对木榄和秋茄光合作用、根系呼吸、养分利用和抗氧化等生理过程的影响, 发现秋茄具有更强的耐淹性。Srikanth等[12]强调了红树树植物根系在其适应潮间带环境中重要性。红树植物在水淹逆境下, 其形态结构、生长生理及代谢都会发生剧烈响应, 并逐渐适应逆境条件或者生存艰难而死亡。本文选取我国华南沿海广布种秋茄作为研究对象, 探讨人工模拟潮汐下秋茄幼苗叶片形态及生长生理的响应及差异机理, 为应对全球气候变化背景下海平面上升对为红树林保护与管理提供理论依据。
1 材料与方法
1.1 实验方法
2016年6月从广东省湛江红树林国家级自然保护区采集红树林底泥, 风干后研磨, 过2 mm不锈钢筛, 拌匀备用, 土壤性质如表1所示; 2017年3月于广东省湛江红树林国家级自然保护区采集秋茄胚轴, 鲜重差距在0.1 g以内。取干净河沙用自来水浇灌至培育出第一对叶, 即可移入盆装土中开展实验。
设计4种潮汐处理, 每天水淹0 h、8 h、16 h、24 h, 采用水泵和微电脑时控开关控制整个潮汐装置, 潮汐淹水的水层高度要求高出土表5 cm, 每周定量补充自来水, 实验培养20周。
1.2 植物生长指标的测定
实验开始后每隔7 d记录秋茄的茎长(胚轴以上伸长长度), 实验培养结束后测定植株的干重和茎根比。
1.3 植物叶片形态指标的测定
实验培养结束后, 参考姜兆玉等[13]的方法, 采用直接撕片法观察叶片气孔, 用Olympus荧光显微镜观察。观察及统计每个视野的气孔数、表皮细胞数和保卫细胞面积, 每个处理30张视野; 气孔密度=视野中的气孔数/视野的面积, 气孔指数=视野中气孔数/(视野中气孔数+表皮细胞数)×100%。叶面积的测定方法, 采集由植株顶端起数第三对叶片, 先用普通扫描仪扫描, 再以剪纸称重法[14]测定。

表1 供试土壤的基本性质
1.4 植物生理指标的测定
实验培养结束后, 测定红树幼苗的抗氧化酶活力: 超氧化物气歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)及抗坏血酸过氧化物酶(APX)[15], 其酶的活力测定参考Peng[16]和Song[17]的方法。
1.5 数据处理
所有数据结果以平均值和标准误差表示, 采用单因素方差分析评价处理间的差异, 若存在显著性差异(<0.05), 则采用Duncan检验法进行多重比较。用SPSS 22.0统计软件包进行分析, 以Origin 9.1程序作图。
2 结果与分析
2.1 浸淹时间对幼苗生长的影响
随着水淹时间的延长, 短期(57 d)内全天不淹水的幼苗的茎伸长最快, 但随后却急剧减缓, 从78 d到记录终止, 其茎长增幅不到0.5 cm。全天水淹24 h的幼苗的茎长度最小且伸长速度始终最慢, 而有潮汐作用的幼苗的茎的生长前期虽然不如不淹水处理的幼苗, 但后期表现出明显的生长优势且水淹16 h处理组幼苗的生长最优, 其最长茎长可达29.27 cm, 比最矮茎长长2.89倍(图1)。
生物量随周期性浸淹时间的加长先上升后在水淹24 h处理组下降, 且潮汐处理的幼苗干重显著大于没有潮汐作用的幼苗, 最大生物量可达22.9 g, 是不淹水处理幼苗最小干物质重的1.28倍。烘干后, 去除胚轴的地上部分与地下部分的干重, 即茎根比, 随淹水时间延长先下降后上升; 水淹16 h的秋茄茎根比值最小, 不水淹的幼苗茎根比最大, 是前者的2.17倍(图2)。

图1 不同潮汐处理下秋茄幼苗茎高增长动态
<
Figure 1 Growth dynamics of.seedings under different tidal treatments
2.2 浸淹时间对叶片形态的影响
从实际镜检中发现, 气孔主要分布于下表皮, 上表皮几乎无气孔分布。统计处理数据的分析结果显示, 气孔密度和气孔指数随水淹时间的延长而增大, 在水淹24 h处理下幼苗叶片下表皮气孔密度高达11.98个·mm-2, 且显著大于其它3种处理(图3B)。但由图3C可知, 保卫细胞的面积则水淹16 h处理的幼苗发育得最大, 水淹16 h保卫细胞的最大面积是全天不淹水处理的最小面积的2.01倍。潮汐处理的幼苗叶面积明显大于没有潮汐水淹的幼苗。
2.3 浸淹时间对秋茄生理的影响
SOD活力随淹水时间的加长先上升后下降(图4A), 水淹16 h处理组的幼苗表现出SOD酶活最强; POD活力随淹水时间延长而持续上升, 且4种处理之间差异显著, 水淹24 h处理组的幼苗出现最大值, 为78942.12 Unit·min-1·mg-1protein, 是不淹水处理幼苗最小值的2.83倍。APX与CAT的比活力随水淹时间的延长发生不同程度的波动(图4C和图4D), APX类似SOD在16 h处理的幼苗中表现出最强的活力, CAT类似POD在水淹24 h处理组的幼苗中表现最强的活性。
3 讨论
3.1 浸淹时间对幼苗生长的影响
土壤遭受水淹胁迫且随着淹水时间的延长, 土壤氧化还原电位下降[9], 土壤氧含量减少而呈还原态, 直接抑制植物的生长[18-20]。秋茄幼苗随每日淹水时间的延长, 生物量先升高后下降, 说明秋茄在周期性潮涨潮落的生境中生长良好, 且在水淹16 h处理组生长最好, 与叶面积规律一致; 幼苗在不淹水生境中生物量最低, 水淹16 h处理组的幼苗累积的干物质达到最大, 说明每日潮汐水淹16 h生长最优。此结果与廖宝文[11]研究秋茄幼苗单株生物量随水淹时间的规律不完全一致, 但与其达到一定水淹临界(如水淹16 h·d-1)后生物量急剧下降的结果符合, 本研究的研究结果表明, 秋茄不能忍受并持续忍耐超长时间的水淹环境, 否则势必引发红树林退化和大面积死亡。

图2 不同潮汐处理对幼苗生物量及茎根比的影响
<
Figure 2 Effects of different tidal treatments on the biomass and stem-root ratio of.seedings
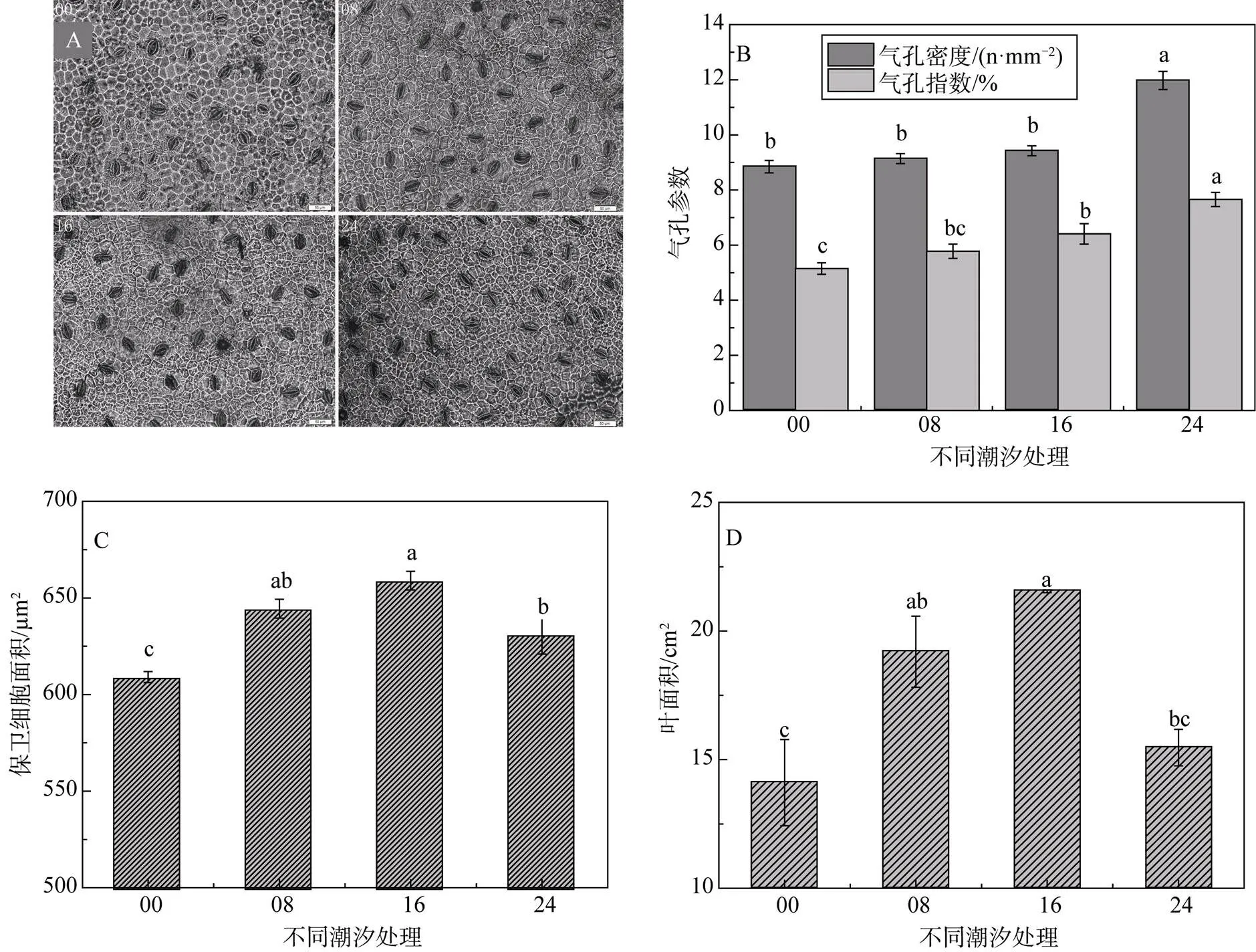
图3 不同潮汐处理下秋茄叶片形态参数
<
Figure 3 Leaf morphological parameters of.under different tidal treatments

图4 不同潮汐处理下秋茄叶片抗氧化酶活性的影响
<
Figure 4 Effects of different tidal treatments on antioxidant enzyme activities of.leaf
秋茄幼苗茎根比在水淹16 h处理组最小, 说明其根系发达, 植物体依靠其发达的根系从土壤中吸收充足的营养进行光合作用等新陈代谢活动, 支持其营养生长。茎长记录的数据显示, 秋茄受潮汐处理而生长良好; 即使不淹水处理的幼苗在短期内茎长伸长最快, 但后期生长几近停滞, 且伴随着叶片的大量脱落, 说明秋茄在短期内可以适应干旱, 长期则出现个体死亡; 永久性淹水的幼苗茎长始终生长最缓, 这与生物量和茎根比的规律完全符合。Monroy-Torres等[21]模拟人工潮汐探究黑皮红树、拉关木和美洲红树幼苗高度随不同水文处理的结果极为类似, 有潮汐作用处理的幼苗茎长表现出显著的生长优势。目前, 全球范围内的灾害性气候频发, 如干旱、洪涝天气多发和强有力的人为干扰以及海平面上升, 很有可能导致局部红树林区长期淹水, 致使红树植物的大量死亡, 尤其是导致幼苗的大量死亡。因此, 典型的红树植物如秋茄不能生存于没有周期性的潮汐作用的生境, 过短或者过长的淹水时间都不利于秋茄的生长发育, 即红树植物的生长必须要求一定的潮汐作用以促进(刺激)其生长发育[22]。
3.2 浸淹时间对秋茄叶片形态的影响
叶片的形态对不同潮汐作用发生强烈的响应差异, 叶片作为光合作用和蒸腾作用的主要器官, 直接决定植物的营养生长。实验观察中, 仅在叶片下表皮发现有气孔分布(称之为下生气孔), 上表皮几乎没有, 这与缪绅裕[23]等和李元跃[24]等观察秋茄叶片气孔的结果一致。而叶片气孔, 是植物幼苗从外界吸收氧气的主要通道。叶片下表皮气孔参数随水淹时间延长持续增大, 符合理论预期, 以应对严重缺氧的土壤生境, 叶勇[25]等也发现木榄幼苗随淹水时间延长气孔密度增加; 而保卫细胞随水淹时间延长先增大后减小, 但该处理的幼苗气孔密度最大且显著大于其它三种处理, 弥补了这一降低。叶片在水淹逆境下发生的解剖结构上的形态适应性变化, 以争取通过叶片气孔吸收足够的氧气供应缺氧的根系和严重缺氧的根际微环境, 避免根际土在厌氧状态下产生强还原态的毒性物质[26, 27], 保护根系免遭损伤。
叶面积与保卫细胞表现的规律一致, 先随淹水时间延长而增大至16 h处理达到最大, 后在24 h处理明显减小, 且该处理的幼苗叶片呈长椭圆形, 明显区别于野外倒卵形的秋茄叶片, 说明秋茄叶形在未来海平面持续上升的胁迫下, 叶片很可能适应性地加长、变窄。陈鹭真等[7]模拟正规半日潮研究了潮汐淹水时间对秋茄幼苗生长的影响, 其叶面积同样是潮汐作用的幼苗显著大于长时间淹水或者不被水淹的幼苗, 区别是最大叶面积出现在水淹8 h(4 h两次半日潮)的幼苗(培养70 d), 但本文潮汐处理周期长达150 d。从8 h和16 h处理的幼苗茎长伸长量在57d前后发生变化猜测, 叶面积在生长后期可能产生类似变化, 因此本研究需要深入探究秋茄幼苗随潮汐水淹的生长规律, 如幼苗萌发期、生长初期、幼苗旺盛期、生长稳定期等, 或者在8 h和16 h之间增设处理组, 如水淹10 h和或12 h。叶面积的变化在一定程度上是为了保证更多的氧气吸入, 潮汐处理的幼苗叶面积比没有潮汐作用幼苗的叶面积大, 叶片的形态适应得以更好的生长, 因而有潮水潮涨潮落的幼苗生长更旺盛。
3.3 浸淹时间对幼苗生理的影响
逆境条件导致植物体内源活性氧的大量累积[28], 过量的活性氧损伤生物膜系统、氧化蛋白质及核酸等。SOD作为抵御逆境的“首道防线”[29], 其活性随水淹时间先升高后降低, 及时缓解了植物生长的逆境胁迫压力, 将氧负离子催化生长成过氧化氢, 这与廖宝文[11]探究秋茄幼苗叶片中SOD活性随着水淹时间延长先小幅上升后呈下降、超过16 h后活性显著上升不一致, 但本实验设计与其实验有多方面区别, 主要表现在本实验对抗氧化酶的活力计算是比活力, 即每毫克可溶性蛋白中具有催化活性的酶的活力。POD活力随淹水时间延长活性持续增加, 说明幼苗产生大量的POD以清除过量的过氧化氢[30], 分解生成水和氧气, 保护机体免受活性氧的损害。APX活力在水淹16 h处理组最大, 说明APX在水淹16 h处理组的幼苗中起到了较大抗氧化功效, 而这种酶研究目前并不多见, 具体活力规律及其机制可进一步挖掘。CAT活性随淹水时间延长发生波动, 没有SOD和POD类似明显的规律, 谭芳林等[31]模拟潮汐探究秋茄幼苗叶片在盐度-淹水双胁迫的生理适应, 从淹水单一变量来看, CAT活力随淹水时间也没有表现出明显的规律。
生存环境适应的条件下, 植物体内活性氧的代谢处于动态平衡, 可作为信号分子参与植物的必要的代谢活动[32]。当植物处于逆境胁迫时, 如干旱、低温、高温、水淹、重金属、有机污染物等, 累积的过量活性氧激发植物体内的抗氧化防御系统, 包括抗氧化酶和抗氧化物。抗氧化酶有超氧化物歧化酶、过氧化物酶、过氧化氢酶、谷胱甘肽还原酶、脱氢抗坏血酸还原酶、单脱氢抗坏血酸还原酶等, 抗氧化物如还原型抗坏血酸、谷胱甘肽、脯氨酸等, 这些物质或分工或协同或交互发生抗氧化功效, 维持细胞正常的生理代谢。单方面简要探究某种物质水平随淹水时间发生的规律较为牵强, 且酶活的测定与当天取材时间(退涨潮前后)有极大的关系, 但植物抗氧化酶系统最终对逆境产生防御的结果都是缓解逆境的胁迫压力, 保证植物体正常的代谢运转。抗氧化酶防御系统在梯度逆境条件的表达规律及机制, 有待深入探究。
4 结论
不同潮汐处理组中, 秋茄幼苗更适应水淹16 h潮汐处理。为应对外界水分胁迫, 秋茄形态表现出较强的可塑性和生理上的适应性, 虽然短期的水淹对秋茄正常的生长影响不大, 但是长时间的持续淹没以及无潮汐浸淹都将不利于秋茄幼苗的生长发育。周期性潮涨潮落的水淹环境对红树林的生长与发育是十分重要的, 但是在全球气候变化灾难性气候频发、以及人为因素干扰(如大量的海堤、养殖塘、房地产建设等)的双重影响下, 易造成局部红树林的持续水淹, 其后果则导致红树林退化及引发生态系统功能的丧失, 这一严峻形势不容忽视。
[1] FAO. The world's mangroves 1980-2005[R]. FAO Forestry Paper 153, Rome, 2007.
[2] 王友绍.红树林分子生态学[M]. 北京: 科学出版社,2019.
[3] 但新球, 廖宝文, 吴照柏, 等. 中国红树林湿地资源、保护现状和主要威胁[J]. 生态环境学报, 2016, 25(7): 1237–1243.
[4] LOVELOCK C E, CAHOON D R, FRIESS D A, et al. The vulnerability of Indo-Pacific mangrove forests to sea-level rise[J]. Nature, 2015, 526(7574): 559–563.
[5] DUKE N C, MEYNECKE J O, DITTMANN S, et al. A world without mangroves?[J]. Science, 2007, 317(5834): 41–42.
[6] GUO Zixiao, LI Xinnian, HE Ziwen, et al. Extremely low genetic diversity across mangrove taxa reflects past sea level changes and hints at poor future responses[J]. Global Change Biology, 2018, 24(4): 1741–1748.
[7] 陈鹭真, 王文卿, 林鹏. 潮汐淹水时间对秋茄幼苗生长的影响[J]. 海洋学报, 2005, 27(2): 141–147.
[8] CHENG H, WANG Y S, FEI J, et al. Differences in root aeration, iron plaque formation and waterlogging tolerance in six mangroves along a continues tidal gradient[J]. Ecotoxicology, 2015, 24(7/8): 1659–1667.
[9] YE Yong, TAM N F Y, WONG Y S, et al. Growth and physiological responses of two mangrove species (and) to waterlogging[J]. Environmental and Experimental Botany, 2003, 49(3): 209–221.
[10] GUAN G F, WANG Y S, CHENG H, et al. Physiological and biochemical response to drought stress in the leaves ofand[J]. Ecotoxicology, 2015, 24(7/8): 1668–1676.
[11] 廖宝文, 邱凤英, 谭凤仪, 等. 红树植物秋茄幼苗对模拟潮汐淹浸时间的适应性研究[J]. 华南农业大学学报, 2009, 30(3): 49–54.
[12] SRIKANTH S, LUM S K Y, CHEN Zhong. Mangrove root: adaptations and ecological importance[J]. Trees, 2016, 30(2): 451–465.
[13] 姜兆玉, 余君彤, 王永飞, 等. 气孔在葱莲不同器官分布的初步研究[J]. 华北农学报, 2010, 25(S2): 140–143.
[14] 冯冬霞, 施生锦. 叶面积测定方法的研究效果初报[J]. 中国农学通报, 2005, 21(6): 150–152.
[15] 孙云. 茶叶抗坏血酸过氧化物酶(APX)的生理学与分子生物学研究[D]. 福州: 福建农林大学, 2009.
[16] PENG Y L, WANG Y S, FEI J, et al. Ecophysiological differences between three mangrove seedlings (,, and) exposed to chilling stress[J]. Ecotoxicology, 2015, 24(7-8): 1722–1732.
[17] SONG H, WANG Y S, SUN C C, et al. Effects of pyrene on antioxidant systems and lipid peroxidation level in mangrove plants,[J]. Ecotoxicology, 2012, 21(6): 1625–1632.
[18] 张洪鹏. 不同时期淹水胁迫对大豆生长和产量的影响及烯效唑调控效应[D]. 大庆: 黑龙江八一农垦大学, 2017.
[19] 李开江, 石鹤付, 史健, 等. 分蘖期淹水对水稻生长发育和产量的影响[J]. 安徽农学通报, 2007, 13(20): 64–65.
[20] 张凤, 王媛媛, 张佳蕾, 等. 不同生育时期淹水对花生生理性状及产量、品质的影响[J]. 花生学报, 2012, 41(2): 1–7.
[21] MONROYTORRES M, FLORESVERDUGO F, FLORESDESANTIAGO F. Growth of three subtropical mangrove species in response to varying hydroperiod in an experimental tank[J]. Ciencias Marinas, 2014, 40(4): 263–275.
[22] ELLISON A M, FARNSWORTH E J. Simulated sea level change alters anatomy, physiology, growth, and reproduction of red mangrove (L.)[J]. Oecologia, 1997, 112(4): 435–446.
[23] 缪绅裕, 王厚麟. 大亚湾红树林与海岸植物叶片气孔特征及其发育[J]. 台湾海峡, 2001, 20(2): 251–258.
[24] 李元跃, 林鹏. 三种红树植物叶片的比较解剖学研究[J]. 热带亚热带植物学报, 2006, 13(4): 301–306.
[25] 叶勇, 刘美龄, 卢昌义, 等. 木榄胚轴萌发及幼苗生长与生理对水渍和底质条件的响应[J]. 海洋与湖沼, 2007, 38 (1): 84–90.
[26] SORRELL B K. Effect of external oxygen demand on radial oxygen loss by Juncus roots in titanium citrate solutions[J]. Plant, Cell & Environment, 1999, 22(12): 1587–1593.
[27] YOUSSEF T, SAENGER P. Anatomical adaptive strategies to flooding and rhizosphere oxidation in mangrove seedlings.[J]. Australian Journal of Botany, 1996, 44(3): 421–426.
[28] BLOKHINA O B, CHIRKOVA T V, FAGERSTEDT K V. Anoxic stress leads to hydrogen peroxide formation in plant cells[J]. Journal of Experimental Botany, 2001, 52(359): 1179.
[29] BOWLER C, MONTAGU M V A, INZA D. Superoxide Dismutase and Stress Tolerance[J]. Annual Review of Plant Biology, 1992, 43(1): 83–116.
[30] DAS S K, PATRA J K, THATOI H. Antioxidative response to abiotic and biotic stresses in mangrove plants: A review[J]. International Review of Hydrobiology, 2016, 101(1-2): 3–19.
[31] 谭芳林, 游惠明, 黄丽, 等. 秋茄幼苗对盐度-淹水双胁迫的生理适应[J]. 热带作物学报, 2014, 35 (11): 2179– 2184.
[32] 田敏, 饶龙兵, 李纪元. 植物细胞中的活性氧及其生理作用[J]. 植物生理学通讯, 2005, 41(2): 235–241.
Responses of growth, physiology and morphology ofseedlings to different tidal treatments
DAI Jie1, CHENG Hao2, YOU Wenhui1, WANG Youshao2,*
1.Shanghai Key Laboratory of Urbanization and Ecological Restoration, College of Ecological and Environmental Sciences, East China Normal University, Shanghai 200241, China 2. State Key Laboratory of Oceanography in the Tropics, South China Sea Institute of Oceanology, Chinese Academy of Sciences, Guangzhou 510301, China
An artificial-tidal tank system was employed to investigate the effects of waterlogging time (0 h, 8 h, 16 h and 24 h·d-1) on stem length, biomass, stem-root ratio, leaf area, stoma and antioxidant enzyme activity in. The results showed that short-term non-tidal flooding environment had little negative effect on growth. Long-term non-tidal flooding conditions (e.g., continuous submergence and/or without flooding) would inhibit the growth of the seedlings. Among different tidal treatments, the optimal tidal cycle was 16 h·d-1, with the largest biomass and the smallest stem-root ratio. With the prolongation of waterlogging time, leaf area and the area of guard cells increased firstly and then decreased, while stomata parameters consistently increased to ensuring enough oxygen acquisition. In addition, the activities of superoxide dismutase (SOD) and peroxidase (POD) in leaves also increased, which may eliminate excessive accumulation of reactive oxygen species induced by flooding. In summary, periodic and appropriate tidal cycle is significant for the growth of, although a relative high waterlogging tolerance is often found in.
tide flooding;; stem-root ratio; stoma; reactive oxygen species
10.14108/j.cnki.1008-8873.2020.06.006
Q945.78
A
1008-8873(2020)06-038-07
2018-07-05;
2018-09-27
国家自然科学基金重点和面上项目(U1901211、41430966、41676086、41876126), 广东省科技计划项目(2016A020222011), 国家科技基础资源调查专项(2017FY100700), 中国科学院国际伙伴计划项目(133244KYSB20180012), 中国科学院A类战略性先导科技专项(XDA13010500、XDA13010503、XDA23050200)
代捷(1991—), 男, 湖北应城人, 硕士研究生, 主要从事红树林生态学研究
王友绍(1963—), 男, 二级教授, 主要从事海洋生态学研究, Email: yswang@scsio.ac.cn
代捷, 程皓, 由文辉, 等. 秋茄幼苗生长生理及形态对不同潮汐处理的响应[J]. 生态科学, 2020, 39(6): 38–44.
DAI Jie, CHENG Hao, YOU Wenhui, et al. Responses of growth, physiology and morphology ofseedlings to different tidal treatments[J]. Ecological Science, 2020, 39(6): 38–44.

