人CD137抗体促进NK细胞对乳腺癌细胞特异性杀伤作用的体外研究
刘鲁宁 陈雪梅 马恩奇 田清艳 刘倩倩 刘韬
乳腺癌是女性中最常见的恶性肿瘤之一。其中三阴性乳腺癌(trip-negative breast cancer,TNBC)具有侵袭性强、易复发、进展快、生存期短和预后差等临床特点[1-2]。乳腺癌的常规治疗手段对TNBC 通常无效[3]。研究显示,表皮生长因子受体(epidermal growth factor receptor,EGFR)在大约60%的TNBC患者中高表达[4]。EGFR 激活的信号通路在细胞增殖、分化、黏附、迁移和凋亡等过程中发挥重要作用,EGFR 的表达情况与乳腺癌的发生、发展、预后和转移密切相关[5-6]。晚期转移性乳腺癌患者的自然杀伤(natural killer,NK)细胞对肿瘤细胞的细胞毒功能受到严重损害[7-8]。NK细胞对乳腺癌的进展和预后尤为重要,NK细胞的功能受损可导致抗肿瘤免疫逃逸,一定程度上促进了乳腺癌的发展和转移[9]。
NK细胞是人体先天免疫的核心组成部分,在机体抗肿瘤免疫中发挥着重要作用。NK细胞具有主要组织相容性复合体(major histocompatibility complex,MHC)非限制性杀伤的特点[10]。NK细胞的表型是CD3-CD56+,根据NK细胞表面CD16 分子的表达情况,可将NK细胞进一步分为CD16neg、CD16dim和CD16brightNK细胞3个亚群[11]。CD16brightNK 可有效地发挥细胞毒作用,并能产生一定水平的细胞因子,而CD16neg和CD16dimNK细胞可产生高浓度的细胞因子,但是细胞毒性较低[12]。NK细胞对肿瘤细胞的杀伤主要包括以下4种途径:(1)穿孔素和颗粒酶介导的直接杀伤[13];(2)膜肿瘤坏死因子家族分子(如FasL、TRIAL)介导的肿瘤细胞凋亡[13];(3)通过分泌多种细胞因子,如干扰素(interferon,IFN)-γ 和肿瘤坏死因子(tumor necrosis factor,TNF)-α 等,协同抑制或杀伤肿瘤细胞[10];(4)NK细胞表面表达免疫球蛋白Fc 片段的低亲和力受体CD16 分子(FcγR Ⅲ),当它与抗体结合后,会诱导抗体依赖性细胞毒性作用(antibody-dependent cell-mediated cytotoxicity,ADCC),特异性杀伤与抗体IgG 结合的肿瘤细胞[14]。临床常用的单抗靶向药物(赫赛汀、西妥昔单抗、利妥昔单抗等)与NK细胞联用,可增强NK细胞的细胞毒性,实现对肿瘤细胞的特异性杀伤[15]。
CD137,又称4-1BB 或肿瘤坏死因子受体9(TNFR9),在活化的NK细胞和T细胞表面广泛表达。已知NK细胞中CD137 传导信号的激活可以促进NK细胞的增殖[16],提高其抗肿瘤活性[17],但对其具体作用机制仍知之甚少。本文研究了人CD137抗体是否能增强NK细胞通过ADCC 途径介导的对EGFR 高表达人乳腺癌细胞系的杀伤作用,同时初步阐明NK细胞的生物学特征和相关作用机制,为EGFR 阳性乳腺癌患者的治疗探索一种更有效、更安全的治疗方法。
材料与方法
一、材料
人乳腺癌细胞系MDA-MB-231(货号ZQ0118)、MDA-MB-453(货号ZQ0072)购自上海中乔新舟公司;L15 培养基(货号11415064)、胎牛血清(货号16140071)、10 % Blocker BSA(货号37525)购自美国Thermo公司;人淋巴细胞分离液(货号LTS1077)购自天津灏洋生物公司;NK细胞无血清培养试剂套装购自默赛尔生物(货号MCM002、MCF004);CD3-FITC(货号300306)、CD56-PE(货号318306)、CD16-APC(货号302012)、CD137- APC流 式 抗 体(货号309809)、人CD137抗 体(货号309802)均购自美国Biolegend公司;人EGFR 抗体(兔源,货号A11351)购自中国Abclonal公司;西妥昔单抗(Cetuximab,爱必妥)购自德国默克公司;Phalloidin-Atto 565(货号94072)、40%甲醛溶液(货号47608)购自美国Sigma公司;抗荧光淬灭封片剂(货号H-1000)购自美国Vector Laboratories公司;IFN-γ ELISA 检测试剂盒(货号430104)购自加拿大STEMCELL公司;TNF-α ELISA 检测试剂盒(货号PT518)购自中国碧云天生物公司;DyeLight 800 羊抗兔IgG(货号042- 07- 15-06)购自美国LI- COR公司;Alexa Fluor 488 标记山羊抗兔IgG(货号A0423)、β-actin 抗体(兔源,货号AF5003)、Tween-20(货号ST825)、Triton X-100(货号ST795)、乳酸脱氢酶细胞毒性检测试剂盒(C0016)购自中国碧云天生物公司。
二、方法
1.NK细胞的诱导培养:用人淋巴细胞分离液从健康志愿者来源的肝素钠抗凝外周血中分离外周血单个核细胞(peripheral blood mononuclear cell,PBMC),按照NK细胞处理试剂盒和NK细胞无血清培养基的说明书,培养NK细胞。后续根据NK细胞生长状况用NK细胞无血清培养基进行补液。在培养的第0、8、12、16 天,取样计数。培养16 d后,收获NK细胞,流式细胞仪检测CD3-CD56+NK细胞比例。
2.NK细胞表型的检测:取1×106个诱导培养16 d 的NK细胞,DPBS缓冲液洗1遍后,参照流式抗体使用说明书用CD3-FITC、CD56-PE、CD16-APC 或CD137-APC 进行染色,常温避光孵育30 min,DPBS 洗1遍后,用0.5 mL DPBS 重悬细胞。流式细胞仪检测分析NK细胞表型,每个样本至少分析10 000个细胞。
3.酶联免疫吸附测定(ELISA)法检测NK细胞分泌细胞因子:取1×106个培养第16 天的NK细胞,用10 μg/mL 人CD137抗体处理4 h后,300×g离心5 min后,吸取上清液,设为CD137抗体处理组,以未加入人CD137抗体的NK细胞培养上清作为阴性对照。根据使用说明书,利用ELISA 检测试剂盒对两组NK 培养上清中分泌的TNF-α、IFN-γ 浓度进行检测。
4.乳腺癌细胞EGFR 蛋白表达免疫荧光染色:分别在细胞爬片上接种5 000个乳腺癌细胞MDAMB-231、MDA-MB-453,37℃培养箱中继续培养过夜;吸弃培养孔中的培养基,DPBS 洗涤1遍,加入4 %甲醛溶液,室温孵育20 min;吸弃4 %甲醛溶液,加入DPBS 洗涤2次;加入0.1 % PBST(含0.1 % Triton X-100 的PBS 溶液)室温处理5 min后,用DPBS 洗涤3次;加入5 % BSA 封闭液,室温孵育1 h;吸弃封闭液,加入200 μL EGFR 抗体稀释液,放入4℃冰箱孵育过夜;吸弃一抗溶液,加入0.1 %PBST 溶液洗涤3次;加入200 μL Alexa Fluor 488 标记山羊抗兔IgG 及Phalloidin-Atto 565 稀释液,室温孵育1 h后,用0.1 % PBST 洗涤3次;用封片剂进行封片,避光放置,封片剂干燥后即进行荧光拍摄。
5.Western blot检测乳腺癌细胞EGFR蛋白表达:将在六孔板中培养的乳腺癌细胞MDA- MB- 231、MDA-MB-453 用含1 mmol/L 苯甲基磺酰氟(PMSF)的裂解液进行充分裂解后,14 000×g离心5 min,取上清,利用BCA 法对蛋白浓度进行定量。取含相同质量蛋白质的上清液,加入蛋白上样缓冲液后95℃以上煮蛋白10 min,使之变性后,- 80℃冰箱保存备用;用Biofuraw Precast Gel 预制胶进行上样、跑胶和转PVDF 膜;使用5 %脱脂牛奶对PVDF 膜进行封闭处理;用5 %脱脂牛奶按照1:1 000 的比例稀释EGFR 抗体和β-actin 抗体,充分混匀,4℃孵育PVDF 膜1 h;孵育结束后,用PBST 溶液洗膜3次;使用新配制5 %脱脂牛奶以1:10 000 的比例稀释对应的二抗,充分混匀,常温避光孵育PVDF 膜1 h;孵育结束后,用PBST 溶液洗膜3次;洗膜完成后,使用Odyssey 双色红外荧光扫描成像系统进行拍照。
6.乳酸脱氢酶(LDH)法检测NK细胞的细胞毒性:根据杀伤体系中NK细胞、人CD137抗体和西妥昔单抗的添加与否,将乳腺癌细胞杀伤实验分成8 组(表1)。用LDH 法检测各组条件下对乳腺癌细胞MDA- MB- 453 和MDA-MB-231 的杀伤比例。大致实验步骤如下:在96 孔细胞培养板中,按照NK细胞:乳腺癌细胞= 2.5:1 的效靶比设置反应体系,并按照分组加入10 μg/mL 相应抗体,每组设置3个复孔。37℃、5 %CO2培养箱中培养4 h。根据使用说明书,利用乳酸脱氢酶细胞毒性检测试剂盒分别检测a~h 组的靶细胞杀伤比例。细胞杀伤比例计算公式:
细胞毒性或死亡率(%)=(实验组样品吸光度-样品对照孔吸光度)/(样品最大酶活性的吸光度-样品对照孔吸光度)×100 %
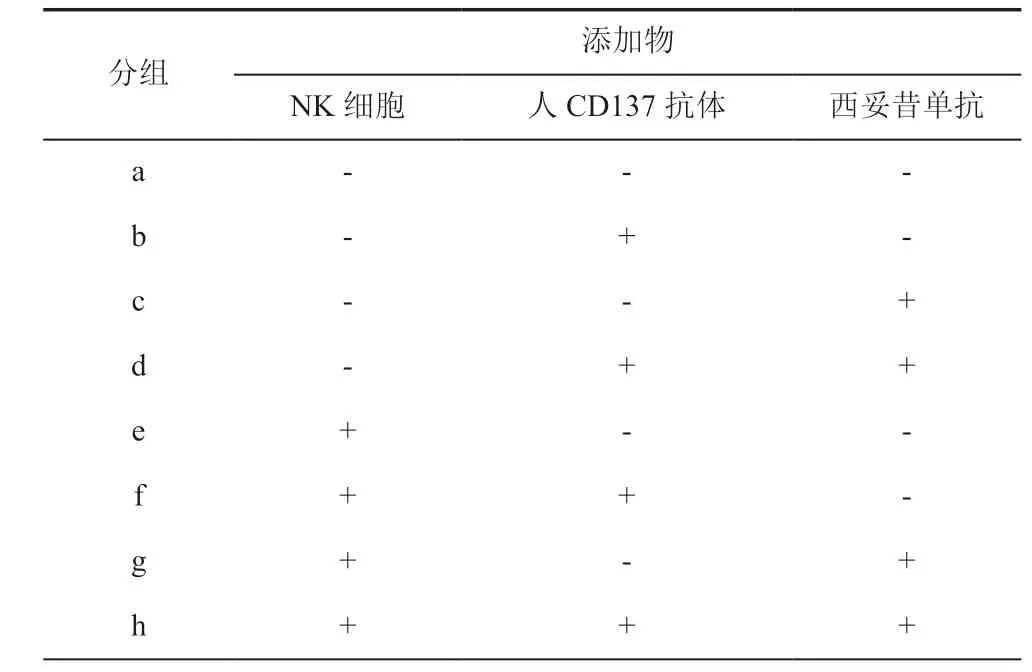
表1 乳腺癌细胞杀伤实验分组设计
三、统计学分析方法
采用Graphpad prism 5.0 和SPSS 13.0 软件对实验数据进行统计分析,其中CD16 阳性NK细胞比例、NK细胞培养上清液中TNF-α 和IFN-γ 浓度、乳腺癌细胞杀伤比例结果以x± s表示。两组NK细胞的细胞表型、细胞因子分泌量比较采用t检验;各组乳腺癌细胞杀伤比例的比较采用三因素两水平的析因分析。以P< 0.05 为差异有统计学意义。每组实验重复3次。
结 果
一、NK细胞的培养结果
显微镜下观察诱导培养至第8、16 天时NK细胞数量由培养第1 天时的3×106个细胞扩增到1.2×109个细胞,约扩增400倍(图1~2)。
二、培养第16 天的NK细胞表型检测结果
诱导培养第16 天时,CD3-CD56+NK细胞比例为85.01 %,其中77.21 %的NK细胞表面表达CD137 分子(图3)。
三、人CD137抗体促进NK细胞表面CD16 分子的表达结果
与阴性对照组比较,CD137抗体处理组CD16+NK细胞比例(79.57 % ± 0.92 % 比90.43 % ±0.67%)升高,差异有统计学意义(t= 62.029,P=0.010,图4)。
四、ELISA 技术检测人CD137抗体促进NK细胞分泌IFN-γ、TNF-α细胞因子的结果

图1 倒置显微镜下观察诱导培养的NK细胞(a、c 图×100,b、d 图×200)

图2 NK细胞诱导培养16 d 的生长曲线
与阴性对照组比较,CD137抗体处理组NK细胞培养上清中IFN-γ 浓度[(388.90±7.02)pg/mL比(523.90 ± 1.90)pg/mL],差异有统计学意义(t= 29.339,P= 0.001,图5a);CD137抗体处理组NK细胞培养上清中TNF-α 浓度升高[(20.59±4.09)pg/mL 比(47.22±2.14)pg/mL],差异有统计学意义(t= 8.290,P= 0.014,图5b)。
五、乳腺癌细胞中EGFR 蛋白表达水平的检测结果
免疫荧光染色图结果显示,MDA-MB-231细胞中高表达EGFR蛋白(绿色通道),而MDA- MB- 453细胞中EGFR 蛋白表达水平相对较低(图6)。Western blot 结果显示,MDA-MB-231细胞中高表达EGFR 蛋白,而MDA-MB-453细胞几乎不表达EGFR 蛋白(图7)。
六、人CD137抗体增强西妥昔单抗介导的NK细胞对EGFR 高表达乳腺癌细胞的杀伤作用结果
各组乳腺癌细胞的杀伤比例统计值见表2。MDA-MB-453细胞杀伤组的三因素析因分析结果显示:NK细胞、人CD137 和西妥昔单抗3个因素分别对MDA-MB-453细胞的杀伤都有作用(F=2260.154、42.837、9.846,P均 < 0.05);NK 细胞和人CD137抗体的一级交互作用有意义(F=25.891,P< 0.001),其他一级交互作用(F= 0.319、0.467,P=0.588、0.514)以及三因素的二级交互作用(F= 0.001,P= 0.981)均无意义(表3,图8)。

图3 培养第16 天NK细胞的流式检测

图4 两组NK细胞表面CD16表达比例检测

图5 NK细胞培养上清液中细胞因子浓度比较
表2 各组乳腺癌细胞的杀伤比例(± s)

表2 各组乳腺癌细胞的杀伤比例(± s)
分组 实验重复次数乳腺癌细胞杀伤比例(%)MDA-MB-453 MDA-MB-231 a 3 3.51±1.07 3.95±1.15 b 3 4.59±1.65 4.51±0.53 c 3 5.72±0.06 5.70±0.27 d 3 6.09±0.24 5.69±0.27 e 3 25.08±1.83 15.34±0.08 f 3 31.24±0.06 22.09±1.86 g 3 26.70±0.83 45.34±0.44 h 3 32.20±0.23 62.71±0.79

图6 倒置荧光显微镜观察乳腺癌细胞MDA-MB-453 和MDA-MB-231(免疫荧光染色,×400)

图7 Western blot 检测乳腺癌细胞中EGFR 蛋白水平

图8 乳腺癌细胞MDA-MB-453 的杀伤比例统计
MDA-MB-231细胞杀伤组的三因素析因分析结果显示:NK细胞、人CD137抗体和西妥昔单抗3个因素分别对MDA-MB-231细胞的杀伤都有作用(F值分别为5227.276、201.473、1792.242,P均 < 0.001)。3个因素两两之间的交互作用对MDA-MB-231细胞的杀伤也都有作用(F= 183.903、1517.187、33.483,P均 < 0.001)。3个因素的二级交互作用也有统计学意义(F= 41.505,P< 0.001)(表3,图9)。
讨 论
NK细胞能非特异性的直接杀伤肿瘤细胞,在机体抗肿瘤和免疫监视中具有重要作用[18]。与T淋巴细胞相比,将NK细胞应用于临床治疗肿瘤具有其独特的优势。首先,NK细胞的杀伤作用不需要抗原致敏,也不受MHC 的限制,可以使用异体来源的NK细胞而不会在体内引起排异反应[19];其次,NK细胞不会产生细胞因子风暴,临床应用安全性更高[20];最后,如果使用具有肿瘤杀伤能力的NK细胞系,则可以按需要提供质量均一性良好的产品,具有开发成通用型现成细胞药物的潜能[21]。因此,NK细胞在抗肿瘤免疫细胞治疗中受到了越来越多的关注。国内外已开展了多项NK细胞治疗血液肿瘤和实体瘤的临床试验[22]。目前NK细胞研究主要聚焦于NK细胞体外大规模培养技术[23]、如何促进NK细胞的活化[24]、促进NK细胞对实体瘤的浸润[25],以及通过肿瘤特异性抗原基因修饰提高NK细胞对肿瘤的识别和杀伤能力等[26]。最终达到克服体内肿瘤对NK细胞的抑制和免疫逃逸的目的[22]。
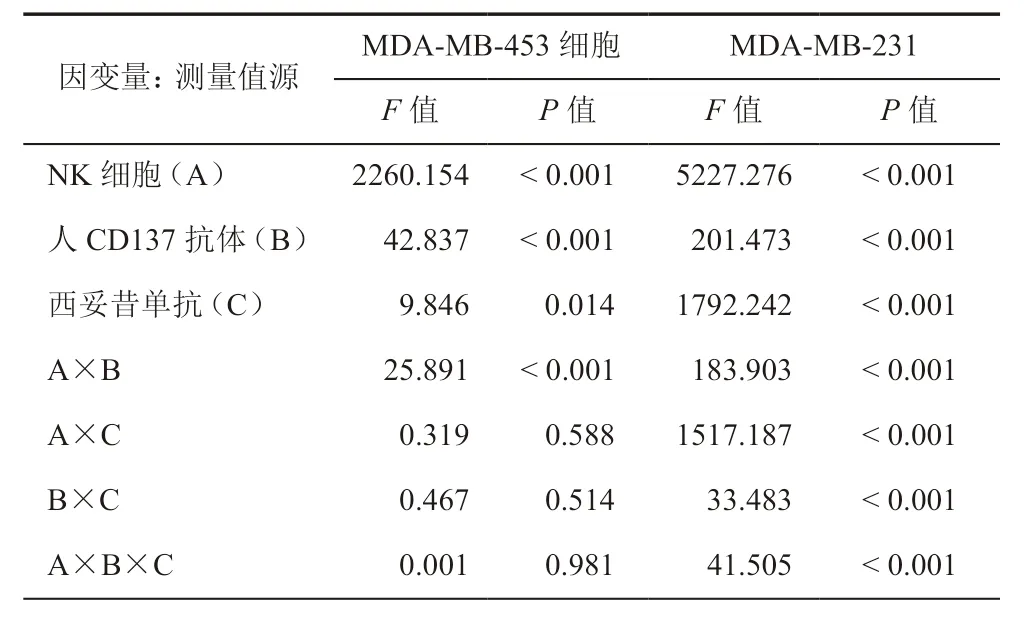
表3 乳腺癌细胞杀伤实验结果的三因素析因分析结果

图9 乳腺癌细胞MDA-MB-231 的杀伤比例统计图
本研究针对NK细胞表面的活化信号分子CD137,利用人CD137抗体处理NK细胞,以进一步增强体外扩增培养NK细胞的活化程度,提高其细胞毒性。实验结果显示:对体外诱导培养16 d 的NK细胞用10 μg/mL CD137抗体处理4 h后,可促进NK细胞表面CD16 分子的表达,增强NK细胞分泌细胞因子IFN-γ 和TNF-α 的能力。由于CD16分子是介导NK细胞ADCC 杀伤途径的关键分子,本研究还探讨了人CD137抗体处理的NK细胞与西妥昔单抗联用对乳腺癌细胞的体外杀伤效果。西妥昔单抗是作用于EFGR 的单克隆抗体,临床上常用于EGFR 阳性肿瘤的靶向治疗,能阻止EGFR 与其天然配体结合,打断肿瘤细胞自泌性无限增殖的恶性循环,抑制肿瘤细胞增殖,诱导细胞凋亡,增强细胞毒药物的抗肿瘤作用[27]。西妥昔单抗与NK细胞联用时,可充当NK细胞与肿瘤细胞之间的桥梁。西妥昔单抗的抗原结合片段(fragment of antigen binding,Fab)可与肿瘤细胞表面EGFR 蛋白特异性结合,另一端Fc 段可与NK细胞表面的CD16 分子(FcγR Ⅲ)相结合,从而进一步促进NK细胞的活化及对肿瘤细胞的特异性杀伤。本研究选取了EGFR高表达乳腺癌细胞系MDA-MB-231 和EGFR 低表达乳腺癌细胞系MDA-MB-453 作为靶细胞,检测NK细胞在CD137抗体和(或)西妥昔单抗作用下对靶细胞的杀伤作用,结果显示:(1)对MDAMB-453细胞,单用NK细胞与NK细胞和西妥昔单抗合用效果无差异,人CD137抗体与西妥昔单抗合用效果与单一用药均无差异,NK细胞和人CD137抗体合用效果杀伤作用优于单一用药;NK细胞、人CD137抗体以及西妥昔单抗3 者合用与NK细胞和人CD137抗体2 者合用效果无差异。(2)对MDAMB-231细胞,NK细胞、人CD137抗体以及西妥昔单抗任意二者合用,效果均优于单一用药,三者合用则效果最优。本研究还存在一定的不足和局限性,具体体现在以下几个方面:(1)仅针对乳腺癌细胞系进行了体外研究,还需通过荷瘤动物模型进一步验证其安全性和体内抗肿瘤效果;(2)仅选取了乳腺癌作为研究对象,还需对其他类型的EGFR 阳性肿瘤进行更广泛的研究;(3)还需对NK细胞进行更全面的分子机制和功能性分析,以实现对NK细胞的精细化调控,进一步提升NK细胞的功能。
综上所述,本研究初步证明了人CD137抗体可增强NK细胞分泌细胞毒性因子IFN-γ 和TNF-α 的能力;更重要的是,人CD137抗体还可上调NK细胞表面CD16 分子的表达,从而使得NK细胞可能通过西妥昔单抗介导的ADCC 作用增强对EGFR 高表达乳腺癌细胞的杀伤作用。人CD137抗体、西妥昔单抗与NK细胞的联合使用有望为EGFR 阳性乳腺癌患者的治疗提供一种更有效的特异性治疗措施。作为一种综合性肿瘤治疗措施,要将其广泛应用于临床还有很长一段路要走,如临床试验的实施方案、不良反应的处理预案、临床推广方案的制定等,需要研究机构和医院的多方努力。

