深海真菌Trichobotrys effuse DFFSCS021的次级代谢产物研究*
罗琴琴,陈子明,曾金凤,曾 玲,郑翠平,陆根兰,王锂韫,孙玉林**
(1.岭南师范学院化学化工学院,广东湛江 524048;2.岭南师范学院生命科学与技术学院,广东湛江 524048)
0 引言
深海微生物对深海特殊生境(高盐、高压、低温、寡营养等)的适应,造就了其区别于陆生微生物的生物合成途径和酶促反应体系,因而具备产生具有新颖化学结构和独特生物活性代谢产物的能力,是开发天然活性药物先导化合物的资源宝库[1]。据统计,2017年被报道的来自微生物的海洋天然产物占总报道化合物的57%[2]。2018年,张长生等[3]着眼于生态环境、物种多样性和应用领域等方面,指出海洋微生物的研究是一个充满着机遇和挑战的领域。真菌是海洋微生物中重要的类群之一,其代谢产物丰富,且具有新奇的化学结构以及显著的生物活性[4],具有巨大的发展潜力。2017年,高啸巍等[5]对深海真菌AcaromycesingoldiiFS121次级代谢产物进行分离得到化合物22-四烯-3-酮,该化合物在100 μg/mL浓度下,对SF-268、MCF-7、NCI-H460和HepG-2这4种肿瘤细胞株表现出显著的增殖抑制活性,其半数抑制率IC50值分别为5.3,6.5,12.2和6.1 μmol/L。2018年,马新华等[6]对南海深海沉积物来源真菌Aspergillussp.MCCC3A400414次级代谢产物的化学成分和生物活性进行研究,从中分离得到5个化合物,即(22E,24R)-麦角甾-5,7,22-三烯-3β-醇、WIN 64821、diorcinol、9-十八碳烯酸和9,12-十八碳二烯酸。WIN 64821对肿瘤细胞株PANC-1、MCF-7、HepG-2和A549表现出中等强度的细胞毒活性,其IC50值在7.14—15.78 μmol/L[6]。2019年,陈闪冲等[7]从深海真菌Phomopsistersa的次级代谢产物中分离得到5α,8α-表二氧麦角甾-6,22-二烯-3β-醇和麦角甾醇,这2个化合物对SF-268、MCF-7、HepG-2和A549 4种肿瘤细胞株具有一定的细胞毒活性。
虽然深海真菌的次级代谢产物结构丰富、活性广泛,但开发程度较低,仍存在较大的挖掘空间。真菌TrichobotryseffuseDFFSCS021分离自我国南海北部2 403 m深的海底沉积物中,纯菌株菌落呈绒状,展开,有凹沟,直径2—3 cm,中央淡粉色周围白色,中间有小气孔。2016年,Sun等[8]从该菌中分离得到3个新的大环内酯类化合物trichobotryside A、trichobotrysides B-C,其中trichobotryside A具有较强的抗生物污损活性,对草苔虫和藤壶幼虫的半数最大效应浓度(EC50)值分别为7.3和2.5 μg/mL。为进一步发掘结构新颖、活性显著的新型化合物,本实验对真菌TrichobotryseffuseDFFSCS021的次级代谢产物进行研究,以期丰富其次级代谢产物的结构类型,为海洋药物先导化合物的开发与利用提供物质基础。
1 材料与方法
1.1 仪器与材料
Bruker Avance DRX-500MHz型超导核磁共振仪(内标为TMS:德国布鲁克仪器有限公司)、N-1210B型(EYELA)旋转蒸发仪(上海爱郎仪器有限公司)、LC-20AD型高效液相色谱仪(岛津企业管理(中国)有限公司)、YMC-PACKODS-A型分析色谱柱(规格:150×4.6 mml.D.S - 5 μm,12 nm)、YMC-PACKODS-A型半制备色谱柱(规格:250×10 mml.D.S-5 μm,12 nm),Bruker microTOF-QⅡ高分辨电喷雾质谱仪(HR-ESI-MS)、Bruker amaZonSL低分辨电喷雾质谱仪(ESI-MS)(布鲁克(北京)科技有限公司),iMark酶标仪(美国BIO-RAD公司)、MCO-175型CO2培养箱(日本Sanyo公司)、SW-CJ-2FD型超净工作台(苏州净化设备公司)、ZF-7型三用紫外分析仪(上海顾村电光仪器厂)、CCA-1112A型冷却水循环装置(上海爱郎仪器有限公司)、SB-800DT型超声波清洗器(宁波新芝生物科技股份有限公司)、Direct-Q5UV-R型超纯水一体机(默克密理博(上海)实验设备科技有限公司)、JJ-2型组织匀浆机(常州澳华仪器有限公司),所用试剂均为分析纯。
深海真菌TrichobotryseffuseDFFSCS021,采自南海北部(112°30.203′E,18°1.654′N) 2 403 m深的海底沉积物中,经分离培养纯化后得到纯菌株保藏于中国科学院海洋微生物中心。
1.2 方法
1.2.1 菌株鉴定
深海真菌TrichobotryseffuseDFFSCS021的总DNA按照文献[9]方法提取,设计引物对总DNA中的ITS序列进行PCR扩增,回收纯化扩增产物并连接到PCR21载体(Invitrogen)中。16S rRNA基因序列送生工生物工程(上海)股份有限公司测定,将测得的16S rRNA基因序列进行BLAST分析,发现其与T.effusaisolate 1179 (accession No.KJ630313)相似度为99%。
1.2.2 菌株的发酵培养
从PDA固体培养基平板上,用接种环刮取2环该菌株的孢子,接种于盛有PDA液体培养基的三角锥形瓶中,置于摇床上180 r/min、28℃恒温培养3—7 d,待三角锥形瓶中菌丝体生长成球形黄豆粒大小时,将生长好的种子液接种到含80 g大米培养基的1 L三角瓶中,每瓶接种10 mL,共接种50瓶,28℃静置30 d。
PDA液体培养基:马铃薯 200 g,葡萄糖20 g,海盐36 g,蒸馏水溶解定容至1 000 mL。固体培养基在此基础上添加20 g琼脂。
大米培养基:大米 80 g,酵母膏 0.4 g,葡萄糖0.4 g,海盐 3.6 g,蒸馏水溶解定容至120 mL。
1.2.3 高效液相色谱(HPLC)分析及半制备
分析条件:流速为1 mL/min,流动相为MeOH/H2O体系,检测波长为210,254,280,360 nm,柱温箱温度为35℃,进样量为5 μL。半制备条件:流速为3 mL/min,流动相为MeOH/H2O体系,检测波长为210,254,280,360 nm,柱温箱温度为35℃,进样量为60 μL。分析时根据化合物的极性来调整MeOH/H2O的比例,以达到半制备的目的。
1.2.4 发酵产物的提取与分离
将发酵好的大米培养基用80%丙酮-水浸泡,接着用组织匀浆机破壁,之后超声30 min,用布氏漏斗抽滤,旋转蒸发除去丙酮,将剩下的水相再用乙酸乙酯进行萃取(V乙酸乙酯∶V水=2∶1),静置分层,取上层乙酸乙酯相进行浓缩称量,共得到浸膏30 g。
将乙酸乙酯萃取的浸膏30 g 经硅胶( 100—200目)柱层析,以氯仿/甲醇(体积比1∶0—0∶1)进行梯度洗脱,最后合并为7个流分( Fr 01—Fr 07)。
流分Fr 05 (4 g)经硅胶 (200—300目)柱层析,以氯仿/甲醇 (体积比20∶1—1∶1)梯度进行洗脱,得到4个亚流分 (Fr 0501—Fr 0504),亚流分Fr 0502 (280 mg)经Sephadex LH-20凝胶柱层析得到4个亚流分 (Fr 050201—Fr 050204),亚流分Fr 050204(80 mg)经半制备HPLC进一步纯化得到化合物1(V甲醇∶V水=10∶90,tR= 20.5 min,26 mg)。
流分Fr 03 (7.5 g)经硅胶 (200—300目)柱层析,以氯仿/丙酮 (体积比50∶1—0∶1)梯度进行洗脱,得到4个亚流分 (Fr 0301—Fr 0304),亚流分Fr 0302 (1 g)经Sephadex LH-20凝胶柱层析得到4个亚流分 (Fr 030201—Fr 030204),亚流分Fr 030201 (65 mg)经硅胶 (200—300目)柱层析,以氯仿/丙酮 (体积比20∶1)等度进行洗脱,得到化合物2(13.5 mg)。
流分Fr 04 (0.7 g)经硅胶 (200—300目)柱层析,以氯仿/甲醇 (体积比20∶1—0∶1)梯度进行洗脱,得到4个亚流分 (Fr 0401—Fr 0404),亚流分Fr 0401 (244.1 mg)经Sephadex LH-20凝胶柱层析得到3个亚流分 (Fr 040101—Fr 040103),亚流分Fr 040103 (45.5 mg)经半制备HPLC进一步纯化得到化合物4(V甲醇∶V水=35∶75) ,tR=30.5 min,4.9 mg)。亚流分Fr 0402 (122.6 mg)经半制备HPLC进一步纯化得到化合物3(V甲醇∶V水=33∶77,tR=28 min,15 mg)。
流分Fr 02 (0.52 g)经硅胶 (200—300目)柱层析,以石油醚/氯仿 (体积比50∶1—0∶1)梯度进行洗脱,得到3个亚流分 (Fr 0201—Fr 0203),亚流分Fr 0201 (175.9 mg)经半制备HPLC进一步纯化得到化合物5(V甲醇∶V水=85∶15,tR=44 min,3.1 mg)。
1.2.5 细胞毒活性测定
参照文献[10]的方法,取对数生长期的肿瘤细胞,将细胞密度调至2×105个/mL,按每孔200 μL加到96孔细胞培养板中,放入37℃培养箱中并通入体积分数5% CO2,培养4 h。化合物样品分别设定5个浓度梯度,每个浓度设3个重复,同时设阳性、阴性对照,每孔肿瘤细胞中分别加样品液或空白液2 μL,再培养72 h。然后每孔加四甲基偶氮唑蓝(MTT)液10 μL,继续培养4 h,在37℃、2 000 r/min条件下,离心8 min,吸去上清液。每孔分别加入二甲基亚砜(DMSO)100 μL,在微量振荡器上振荡15 min,至结晶完全溶解后,用酶标仪测定每孔在570 nm处的吸光值(OD值)。取3孔平均OD值,按对细胞增殖的抑制率(IR,%)=[(OD空白-OD样品)/OD空白]×100%,计算样品IR,并采用bliss法计算出半数抑制率IC50。
2 结果与分析
2.1 化合物结构鉴定
化合物1—5的结构如图1所示。
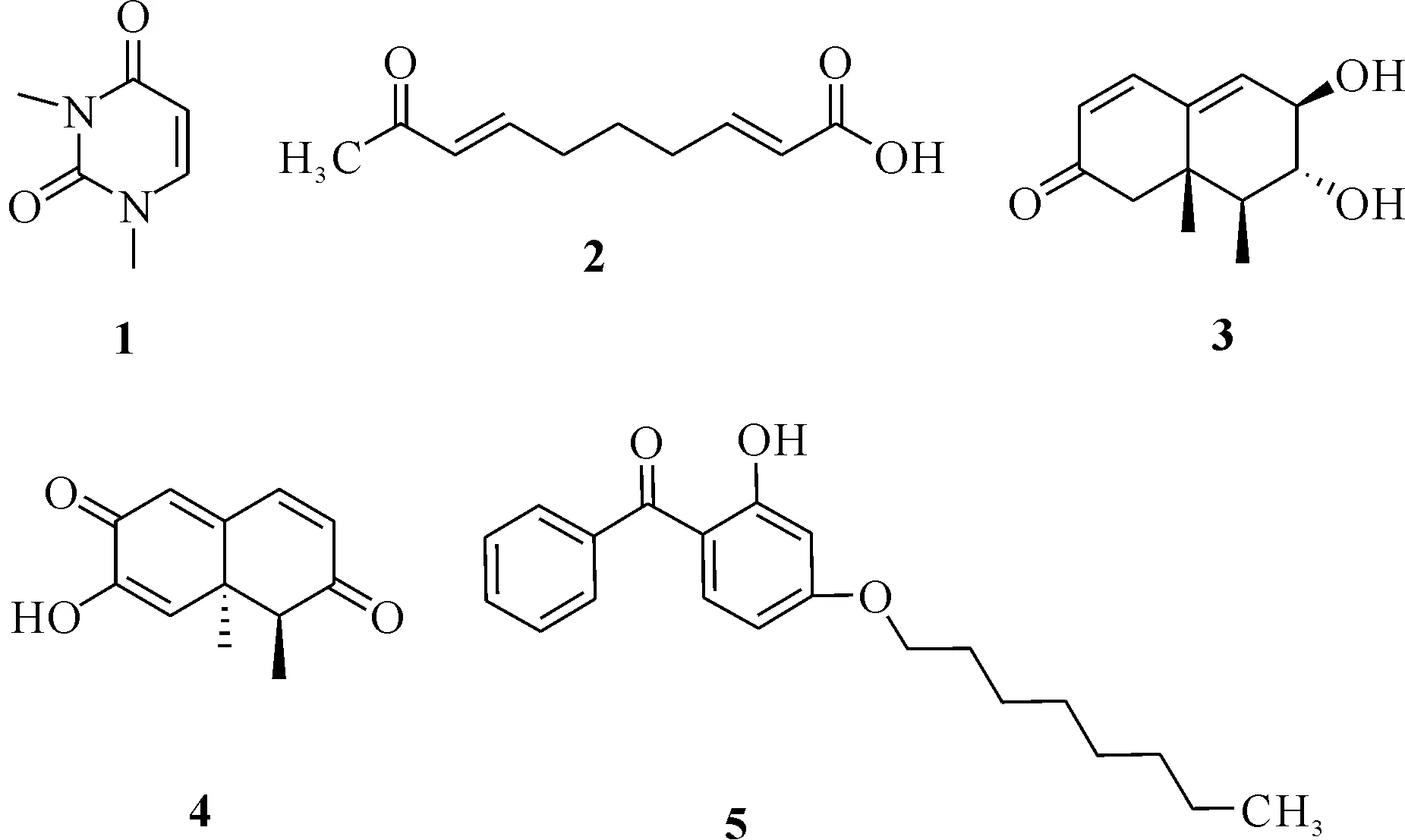
图1 化合物1—5的结构
化合物1:白色无定形粉末。1H NMR(500 MHz,CDCl3)δH7.12(1H,d,J= 7.5 Hz,H-6),5.74(1H,d,J=7.5 Hz,H-5),3.80(3H,m,1-NCH3),3.35(3H,m,3-NCH3)。13C NMR(125 MHz,CDCl3)δ:162.3(s,C-4),151.4(s,C-2),144.6(d,J=5.5 Hz,C-6),102.4(d,J=5.5 Hz,C-5),36.7(s,3H),28.2(s,3H)。低分辨质谱(+)-ESIMS给出准分子离子峰m/z141.1[M+H]+和281.1[2M+H]+,(-)-ESIMS给出准分子离子峰m/z139.3 [M-H]-。上述氢谱和质谱数据与文献报道的数据[11]一致,故鉴定该化合物为1,3-dimethyluracil。
化合物2:无色油状物。1H NMR (500 MHz,CDCl3)δH7.05(1H,dd,J1=7.0 Hz,J2=15.5 Hz,H-3),6.78(1H,dd,J1=6.5 Hz,J2=16.0 Hz,H-7),6.09(1H,d,J=16.0 Hz,H-8),5.85(1H,d,J=15.5 Hz,H-2),2.29(2H,m,H-4),2.28(2H,m,H-6),2.26(3H,s,H-10),1.67(2H,m,H-5);13C NMR(125 MHz,CDCl3)δC198.5(C,C-9),170.6(C,C-1),150.8(CH,C-3),146.9(CH,C-7),131.8(CH,C-8),121.2(CH,C-2),31.7(CH2,C-4),31.6(CH2,C-6),21.7(CH3,C-10),26.3(CH2,C-5)。(+) -HRESIMS 给出的分子式为C10H15O3(m/z183.101 5 [M+H]+,calcd.for C10H15O3,183.101 6)。上述数据与文献[12]一致,故鉴定该化合物为[2E,7E]-9-oxo-2,7-decadienoic acid。
化合物3:无色粉末。1H NMR (500 MHz,CDCl3)δH6.88(1H,d,J=10.0 Hz,H-1),5.80(1H,s,H-9),5.93(1H,d,J=10.0 Hz,H-2),4.24 (1H,d,J=7.0 Hz,H-8),3.87(1H,m,H-7),2.45(1H,dd,J1=6.5 Hz,J2=13.5 Hz,H-4),1.97(1H,dd,J1=2.5 Hz,J2=12.5 Hz,H-6a),1.65(1H,t,J=12.5 Hz,H-6b),1.07(3H,s,H-12),1.06(3H,s,H-11);13C NMR (125 MHz,CDCl3)δC200.8(C,C-3),143.8(CH,C-1),142.1(C,C-10),131.8(CH,C-9),127.2(CH,C-2),74.4(CH,C-8),70.0(CH,C-7),53.2(CH,C-4),42.0(CH2,C-6),41.2(C,C-5),20.1(CH3,C-12),7.2(CH3,C-11)。(+) -HRESIMS 给出的分子式为C12H17O3(m/z209.078 7 [M+H]+,calcd.for C12H17O3,209.078 1)。上述数据与文献[13]报道一致,故鉴定该化合物为periconianones H。
化合物4:无色粉末。1H NMR(500 MHz,CDCl3)δH7.21(1H,d,J=10.0 Hz,H-9),6.30(1H,d,J=10.0 Hz,H-8),6.53(1H,s,H-1),6.38(1H,s,H-4),2.53(1H,dd,J1=7.0 Hz,J2=13.5 Hz,H-6),1.25(3H,s,H-11),1.31(3H,d,J=7.0 Hz,H-12);13C NMR(125 MHz,CDCl3)δC198.6(C,C-7),181.1(C,C-2),160.8(C,C-10),147.3(C,C-3),141.6(CH,C-9),131.8(CH,C-8),125.9(CH,C-1),123.1(CH,C-4),50.9(CH,C-6),45.2(C,C-5),23.4(CH3,C-11),8.2(CH3,C-12)。(+) -HRESIMS 给出的分子式为C12H13O3(m/z205.086 0 [M+H]+,calcd.for C12H13O3,205.085 9)。上述数据与文献[14]报道一致,故鉴定该化合物为botryosphaeridione。
化合物5:无色油状物。1H NMR(500 MHz,CDCl3)δH7.48(1H,m,H-6),7.56(1H,m,H-4′),7.63(2H,m,H-6′,H-2′),7.49(2H,m,H-5′,H-3′),6.40(1H,dd,J1=2.5 Hz,J2=9.0 Hz,H-5),6.50(1H,d,J=2.5 Hz,H-3),4.02(2H,m,H-8),1.30(2H,m,H-13),1.26(2H,m,H-11),1.33(2H,m,H-12),1.80(2H,m,H-9),1.46(2H,m,H-10),1.28(2H,m,H-14),0.89(3H,s,H-15);13C NMR(125 MHz,CDCl3)δC200.1(C,C-7),166.3(C,C-2),165.8(C,C-4),138.3(C,C-1′),135.2(CH,C-6),131.4 (CH,C-4′),128.9(CH,C-6′,C-2′),128.3(CH,C-5′,C-3′),113.0(C,C-1),107.8(CH,C-5),101.5(CH,C-3),68.5(CH2,C-8),31.8(CH2,C-13),29.3(CH2,C-11),29.2(CH2,C-12),28.9(CH2,C-9),26.0(CH2,C-10),22.7(CH2,C-14),11.4(CH3,C-15)。(+) -HRESIMS 给出的分子式为C21H27O3(m/z327.196 1 [M+H]+,calcd.for C21H27O3,327.195 5)。上述数据与文献[15]报道一致,故鉴定该化合物为2-hydroxy-(4-octyloxy)benzophenone。
2.2 化合物活性测定
化合物3对人肝癌细胞 (HepG-2)、人食管癌细胞 (Eca109)、人急性骨髓白血病细胞 (KG-1a)、人前列腺癌细胞 (PC-3)和人喉癌细胞 (Hep2)均未显示出细胞毒活性,仅对人宫颈癌细胞 (Hela)显示出弱的抑制活性,其IC50值为20.5 μmol/L (表1)。该结果与文献[13]报道的化合物periconianones H对Hela显示出弱的细胞毒活性(IC50=16.5 μmol/L)的结果较为一致。
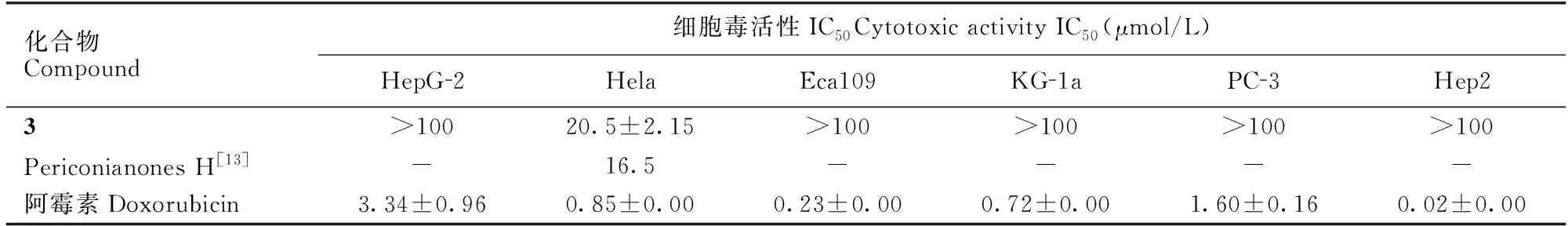
表1 化合物3的细胞毒活性测试结果
3 结论
本研究对来源于南海北部2 403 m深的海底沉积物中1株真菌TrichobotryseffuseDFFSCS021的乙酸乙酯萃取物进行化学成分研究,从中获得5个单体化合物,分别为1,3-dimethyluracil (1)、[2E,7E]-9-oxo-2,7-decadienoic acid (2)、periconianones H (3)、botryosphaeridione (4)和2-hydroxy-(4-octyloxy) benzophenone (5),均为首次从该菌株中分离得到。对化合物3进行细胞毒活性筛选,结果表明该化合物对5株肿瘤细胞株HepG-2、Eca109、KG-1a、PC-3和Hep2均未显示出细胞毒活性,仅对Hela显示弱的抑制活性。另外,据报道,化合物4对双子叶植物莴苣的种子萌发具有显著的抑制活性[14],化合物2,5的活性数据未见报道。接下来将对剩余的4个化合物进行多种生物活性筛选,例如抑制种子萌发、抗菌以及抗生物污损等,以期为进一步研究该菌属的海洋真菌提供活性数据和参考资料。