重组泛素样特异性蛋白酶1在大肠杆菌中的表达条件优化与分离纯化
张叶明,付正豪,陈云雨
(皖南医学院药物筛选与评价研究所,安徽 芜湖 241000)
小分子泛素样修饰蛋白质(small ubiquitin-like modifier protein,SUMO)广泛存在于各种真核细胞中,是一种通过结合赖氨酸侧链起相关调节修饰作用的蛋白质,广泛参与RNA转录、DNA修复、细胞周期调控及蛋白质转运等[1-2]。目前研究表明SUMO还可以作为重组蛋白质表达的融合标签和分子伴侣,促进重组蛋白质的折叠与可溶性表达,提高蛋白质的稳定性与生物学活性[3-5]。但重组蛋白质融合的SUMO标签可以被泛素样特异性蛋白酶1(ubiquitin-like specific protease 1,Ulp1)特异性识别并切割,高效获得具有天然结构和良好生物学活性的目的蛋白质。
Ulp1来源于酿酒酵母,是由621个氨基酸残基组成的蛋白质,含有2个结构域,一个是保守性弱的N-端结构域(1~432 aa),另一个是C-端结构域(432~621 aa),具有促进蛋白酶折叠作用。Ulp1的结构分析与蛋白质水解实验证实,Ulp1的活性结构域为第403至621位氨基酸,其表现出与全长的Ulp1等同的酶切活性,能够水解以α-氨基连接的SUMO融合蛋白质[6]。Ulp1在移除SUMO标签时依赖SUMO空间结构而不是线性氨基酸序列,实现了高效地特异性切割。更重要的是,融合蛋白质切除SUMO标签后,目的蛋白质的N端不含有多余的氨基酸,很好地保持了目的蛋白质的空间结构与生物学活性。本研究旨在优化Ulp1(403~621 aa)在大肠杆菌中的原核表达条件,再以亲和层析法一步分离纯化,从而高效制备Ulp1,为Ulp1在生物工程中的酶切应用奠定实验基础。
1 材料与方法
1.1 材料
1.1.1 菌株和质粒 E.coli BL21(DE3)感受态细胞购自全式金公司;pET-28a载体由中国医学科学院-北京协和医学院药物研究所林媛副研究员惠赠。
1.1.2 主要试剂 DNA标准分子量、蛋白质标准分子量、质粒提取试剂盒、NdeⅠ、XhoⅠ购自全式金公司;BCA(bicinchoninic acid)购自Thermo公司;辣根过氧化物酶(horseradish peroxidase,HRP)标记的羊抗小鼠IgG、小鼠抗组氨酸(histidine,His)标签单克隆抗体购自Biosharp公司;卡那霉素、氨苄西林、异丙基硫代半乳糖苷(isopropyl β-D-thiogalactoside,IPTG)购自Sigma公司;HisTrapTM层析柱购自Cytiva公司;HRP底物化学发光液购自上海天能科技有限公司;其他所用试剂均为国产分析纯试剂。
1.1.3 仪器与设备 恒温金属浴(Coyote Biotech公司);超声波细胞粉碎机(SCIENTZ公司);细菌振荡培养箱(上海知楚仪器有限公司);高速冷冻离心机(Eppendorf公司);蛋白质电泳仪与转膜仪(Bio-Rad公司);琼脂糖水平电泳仪(北京六一生物科技有限公司);凝胶成像系统(上海Clinx公司);AKTA Pure层析系统(GE公司)。
1.2 方法
1.2.1 Ulp1原核表达质粒的构建与鉴定 GenBank检索Ulp1(403~621 aa)基因序列,并在目的基因两端分别加入NdeⅠ和XhoⅠ酶切位点,由通用生物(安徽)有限公司进行基因片段合成。再将目的基因直接连接pET-28a载体中,构建重组质粒,以双酶切法进行鉴定。
1.2.2 Ulp1的原核表达 将构建成功的重组质粒Ulp1-pET28a以冷CaCl2化学转化法转化到E.coli BL21(DE3)细胞中,后在37 ℃的LB固态培养基(含50 μg/mL卡那霉素)中过夜。随机选取6个单菌落到5 mL LB液态培养基中,诱导Ulp1表达(30 ℃诱导10 h,IPTG浓度为1 mmol/L)。采用SDS-PAGE电泳方法分析Ulp1的表达情况。
1.2.3 Ulp1诱导时间的优化 37 ℃培养工程菌到OD60约为0.7时,诱导温度设置为20 ℃,加入 IPTG(1.0 mmol/L)继续培养。分别在2、4、6、8、10、12 h时间点等量收集菌体,通过 SDS-PAGE方法鉴定Ulp1表达量。分别设置诱导温度为25 ℃和30 ℃,重复以上实验,栓测分析结果,从而确定不同诱导温度的最佳诱导时间。
1.2.4 Ulp1诱导温度的优化 等量随机采集20 ℃诱导10 h、25 ℃诱导8 h和30 ℃诱导6 h的菌落,采用超声法裂解菌体,收集上清液与沉淀,以12% SDS-PAGE分析Ulp1的可溶性表达,从而确定Ulp1最佳诱导温度。
1.2.5 IPTG诱导浓度的优化 将工程菌于37 ℃培养至OD600约为0.7 h,分别加入不同浓度IPTG(0.2、0.4、0.6、0.8、1.0 mmol/L),30 ℃诱导6 h。等量收集菌体,以 SDS-PAGE分析不同IPTG浓度下Ulp1的表达量,并确定IPTG最佳诱导浓度。
1.2.6 饱和硫酸铵沉淀制备粗提液 工程菌以0.2 mmol/L IPTG于30 ℃诱导6 h,收集的菌体超声法破碎,收集菌体裂解上清液。在100 μL上清液中分别加入10%、15%、20%、25%、30%、35%、40%、45%饱和硫酸铵溶液,4 ℃沉淀2 h。离心收集沉淀,以80 μL TBS(25 mmol/L Tris、150 mmol/L NaCl pH 8.0)重悬,再以12% SDS-PAGE确定各不同饱和硫酸铵浓度中Ulp1沉淀量,确定饱和硫酸铵的最佳沉淀浓度。
1.2.7 Ulp1分离纯化与鉴定 在上述实验确定的最佳原核表达条件下,大量诱导工程菌,用30%饱和硫酸铵溶液沉淀菌体裂解上清液,制备粗提液。用适量A液(50 mmol/L 咪唑、0.5 mol/L NaCl、25 mmol/L Tris pH 8.0)重悬,制备粗提液。用0.5 mL/min的流速上样以10倍柱床体积A液清洗和平衡的HisTrapTM层析柱。随后按照参考文献方法进行洗脱收集、分离纯化[7]。以SDS-PAGE电泳检测,经TBS透析后,再用BCA法分析。
将含有Ulp1(24 kDa)泳道的电泳胶转膜,开展Western blot实验。一抗为1∶2000稀释的小鼠抗His标签单抗,二抗为1∶4000稀释的HRP-羊抗小鼠IgG,用HRP底物化学发光液显影成像。
2 结果与分析
2.1 Ulp1原核表达质粒的构建
将合成的Ulp1基因克隆到pET-28a载体中,构建了重组质粒Ulp1-pET-28a,见图1A。构建的重组质粒经NdeⅠ和XhoI双酶切后,可获得大小约657 bp的特异性片段,扩增的特异性片段与Ulp1预期大小基本一致,说明成功构建了重组质粒Ulp1-pET-28a,见图1B。

A:重组质粒Ulp1-pET-28a的构建;B:重组质粒Ulp1-pET-28a的双酶切鉴定
2.2 Ulp1的原核表达
重组菌经1 mol/L IPTG诱导培养后,随机选取6株工程菌,以SDS-PAGE分析,实验结果显示在相对分子量为24 kDa位置均有明显的目的蛋白质表达条带,这与Ulp1理论分子量基本相符,说明Ulp1原核表达成功,见图2。

1:阴性对照;2:蛋白质标准分子量;3~8:诱导的工程菌
2.3 确定Ulp1最佳诱导时间
工程菌经20、25和30 ℃诱导培养后,以SDS-PAGE分析Ulp1原核表达量。当诱导温度为20 ℃时,Ulp1表达量在10 h时趋于表达量峰值,此时表达量约为35%,见图3a。当诱导温度为25 ℃时,Ulp1表达量在8 h时趋于表达量峰值,此时表达量约为33,见图3b。当诱导温度为30 ℃时,Ulp1表达量在6 h时趋于表达量峰值,此时表达量约为36%,见图3c。
(a,b,c)Ulp1在20 ℃、25 ℃、30 ℃诱导时间的优化
2.4 确定Ulp1最佳诱导温度
菌体分别在20 ℃诱导10 h、25 ℃诱导8 h和30 ℃诱导6 h后,采用超声法裂解菌体,收集沉淀与上清液。SDS-PAGE实验结果表明,20 ℃诱导10 h时,Ulp1在上清液中含量较少;25 ℃诱导8 h时和30 ℃诱导6 h时,Ulp1虽有部分包涵体表达,但上清液中Ulp1含量明显增多,Ulp1以胞内可溶形式表达,见图4。
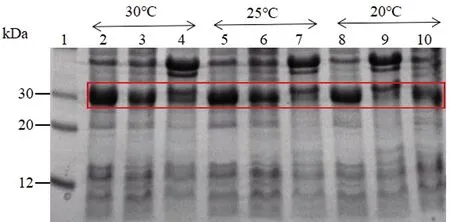
1:蛋白质标准分子量;2:全菌蛋白质(30 ℃);3:上清液(30 ℃);4:沉淀(30 ℃);5:全菌蛋白质(25 ℃);6:上清液(25 ℃);7:沉淀(25 ℃);8:全菌蛋白质(20 ℃);9:上清液(20 ℃);10:沉淀(20 ℃)
2.5 确定IPTG最佳诱导浓度
菌体在30 ℃温度下分别以不同浓度IPTG(0.2、0.4、0.6、0.8、1.0 mmol/L)诱导6 h,SDS-PAGE实验表明,虽然IPTG浓度不断递增,但Ulp1表达量基本不变,故选择0.2 mmol/L IPTG为最佳诱导浓度,见图5。

1:阴性对照;2:蛋白质标准分子量;3~7:0.2,0.4,0.6,0.8,1.0 mmol/L IPTG
综上所述,确定诱导温度30 ℃、诱导时间6 h、IPTG浓度0.2 mmol/L作为Ulp1最佳原核表达条件。
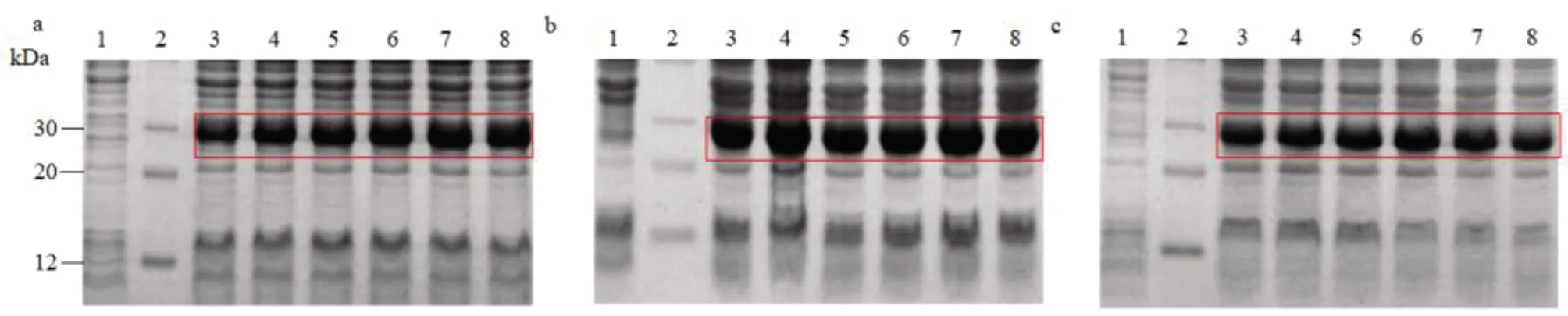
2.6 Ulp1分离纯化与鉴定
工程菌在30 ℃下诱导6 h,以不同浓度的饱和硫酸铵沉淀菌体裂解上清液,SDS-PAGE结果显示,30%饱和硫酸铵沉淀时Ulp1大量沉淀,见图6a。以30%硫酸铵沉淀上清液制备Ulp1粗提液,再用HisTrapTM层析柱分离纯化。SDS-PAGE结果表明,纯化的Ulp1经考马斯量蓝染色后,在预期分子量(24 kDa)位置均出现单一蛋白质染色条带,见图6b,说明Ulp1具有较高的纯度,纯度大于90%。Western blot表明,在预期分子量位置仍可呈现单一条带,证实了Ulp1的正确表达,见图6c。纯化的Ulp1以BCA法定量,其浓度为1.0 mg/mL,经原核表达条件优化后,Ulp1表达量约为350 mg/L。

(A)饱和硫酸铵法沉淀Ulp1。1:蛋白质标准分子量;2:10%;3:15%;4:20%;5:25%;6:30%;7:35%;8:40%;9:45%;(B)Ulp1的亲和层析。1:阴性对照;2:蛋白质标准分子量;3:全菌蛋白质;4:30%饱和硫酸铵沉淀样品;5~6:纯化的Ulp1条带;(C)Western blot实验鉴定Ulp1。1:蛋白质标准分子量;2:Ulp1条带(24 kDa)
3 讨 论
SUMO融合表达系统具有显著提升重组蛋白质表达水平、促进目的蛋白质正确折叠和提高目的蛋白质可溶表达等优点,因而广泛应用于容易错误折叠、有毒和难溶性蛋白质的表达。Ulp1可以特异性识别并切割SUMO标签,与传统的切割酶不同,Ulp1识别SUMO空间结构,特异性切割SUMO标签C端的异肽键,且切割后的目的蛋白质氨基端不含多余的氨基酸,几乎不影响目的蛋白质的生物学活性,因此高效制备高产量的Ulp1并应用于重组蛋白质的酶切具有重要的实践意义。
大肠杆菌原核表达系统具有成本廉价、操作简捷、表达量高等众多优点,已成为制备重组蛋白质的首选方案[8]。外源蛋白质连接分子量较小的His标签后,可方便重组蛋白的分析检测和分离纯化,因此本实验在Ulp1(403~621 aa)的羧基端融合了pET-28a载体的His标签,并以亲和层析方法进行了Ulp1分离纯化。优化原核表达条件是为了在简单的实验环境下最大量的表达目的蛋白。基于诱导温度、诱导时间和IPTG浓度是影响外源蛋白质表达的重要因素[9-10],本课题组开展了Ulp1原核表达优化实验。结果显示,温度是影响Ulp1表达的重要因素。20 ℃诱导培养时,Ulp1在上清液中含量较少,这可能与低温导致目的蛋白表达速度缓慢有关。25 ℃与30 ℃诱导培养时,大部分Ulp1表达为可溶形式,这可能是高温增加了蛋白质正确折叠、促进了蛋白质可溶。在低温环境下大肠杆菌发展缓慢,可通过延长诱导时间以促进目的蛋白的表达。菌体在30 ℃环境下培养时,Ulp1表达量随着诱导时间的延长而逐渐升高,在6 h左右后表达量趋于平稳,表达量约为35%,最高表达量约为350 mg/L,不低于现有文献报道[11]。另外,IPTG对Ulp1诱导效率很高,浓度为0.2 mmol/L时即可达到较好的诱导效果。故此确定0.2 mmol/L IPTG、30 ℃诱导6 h作为Ulp1在大肠杆菌中的最佳表达条件。
综上所述,本研究成功进行了Ulp1原核表达条件的优化与分离纯化,为Ulp1在生物工程中的酶切应用奠定了实验基础。

