APE-1对肝癌细胞裸鼠成瘤能力及PKM2表达的影响及机制探索
孙志鹏,许光中,阿民布和,樊 庆,彭吉润,张能维
肝细胞癌(hepatocellular carcinoma, HCC)是原发性肝癌中最常见的肿瘤,目前主要治疗手段为手术治疗,且放化疗效果较差[1]。同大部分肿瘤一样,HCC的早期诊断和手术的比例仅10%~20%,大多数患者在诊断时已是晚期或终末期[2]。肝癌的发生由多种因素共同作用,通过多种途径引起,具体的发病机制尚不清楚。深入研究HCC的发病机制,寻找关键性的分子作为分子治疗的靶点,对于肝癌的治疗具有重要的意义。脱嘌呤脱嘧啶核酸内切酶-1(apurinic-apyrimidinic endonuclease 1,APE-1)是一种可以发挥DNA修复功能和氧化还原功能的蛋白,可调节肿瘤相关途径的多种转录因子[3]。前期基于细胞水平研究[4]发现APE-1在肝癌组织和细胞中高表达,且其高表达与TNM分期、组织病理分级存在差异,沉默APE-1表达可降低肝癌细胞Hep 3B的增殖活性,提高细胞凋亡率。该研究基于动物模型水平,进一步探究APE-1对肝癌细胞裸鼠成瘤能力的影响及机制探索。
1 材料与方法
1.1 组织样本及主要试剂
1.1.1实验动物及细胞 20只4周龄SPF级BALB/c品系雄性健康裸鼠,体质量17~18 g,购自北京维通利华实验动物技术有限公司。在首都医科大学附属北京世纪坛医院(北京大学第九临床医学院)SPF级实验动物房饲养。所有饲料、水、空气、铺垫物及各种用品均需经过高温高压等灭菌处理。裸鼠处死取材后,用于免疫组化的样品保存于组织固定液中,用于Western blot的组织立即转入液氮保存。沉默APE-1表达的肝癌Hep 3B稳定细胞株及其对照由实验室构建后保存[4]。
1.1.2主要试剂 SP-0023-SP免疫组化检测试剂盒购自北京索莱宝公司;APE-1(ab189474,免疫组化 1 ∶500;Western blot 1 ∶1 000)、增殖细胞核抗原(proliferating cell nuclear antigen, PCNA)(ab92552,免疫组化 1 ∶500;Western blot 1 ∶2 000)、Ki-67(ab16667,免疫组化 1 ∶200;Western blot 1 ∶1 000)和PKM2(ab137852,免疫组化 1 ∶300;Western blot 1 ∶2 000)一抗抗体、GAPDH(ab181602,Western blot 1 ∶10 000)抗体购自英国abcam公司;蛋白提取RIPA裂解液、蛋白浓度测定试剂盒、SDS-PAGE凝胶配制试剂购自江苏碧云天公司。
1.2 方法
1.2.1细胞培养与收集 复苏沉默APE-1和对照组肝癌BEL-7402细胞,使用RPMI-1640完全培养基培养液(含10%FBS+1%双抗),在37 ℃,5%CO2细胞培养箱里培养,待细胞铺满培养瓶的瓶底时,用5%胰蛋白消化酶消化细胞,优质胎牛血清终止消化,轻轻吹打至细胞全部离壁,1 000 r/min离心5 min,弃上清液。再用生理盐水洗涤细胞2次。洗涤完成后生理盐水重悬细胞,调整细胞浓度为1×107/ml,备皮下成瘤用。
1.2.2模型制备 SPF条件下20只BALB/c-Nude裸鼠适应性饲养2周,待到第三周时将裸鼠随机均分为2组,分别编号。裸鼠右侧腋窝皮下接种注射1×107/ml细胞悬液200 μl。接种细胞悬液8周后脱臼处死裸鼠,计算成瘤率。完整剥离肿瘤组织,称瘤体质量并计算肿瘤体积。肿瘤体积(mm3)=1/2(长径×短径×短径)
1.2.3免疫组化检测APE-1、PCNA、Ki-67和PKM2在2组成瘤组织中表达 组织经过切片、水化、抗原修复,分别滴加一抗和二抗,DAB显色,中性树胶封片。光学显微镜拍照,采用IPP软件对图片进行积分光吸光度(integrated option density,IOD)分析。
1.2.4Western blot检测蛋白表达 收集2组成瘤组织,RIPA蛋白裂解液提取蛋白,Bradford法蛋白定量。SDS-PAGE凝胶电泳后NC膜恒流湿法进行转膜。转膜成功的NC膜转移到5%脱脂奶粉-TBST封闭液于室温封闭1 h。再将PVDF膜分别加入稀释的APE-1、PCNA、Ki-67、PKM2和GADPH一抗,4 ℃轻摇过夜;随后加入相应的二抗(1 ∶2 000),37 ℃恒温摇床孵育l h。蛋白的相对表达量用待测蛋白与GADPH的灰度值比值计算。
1.2.5基因表达相关性和生存曲线分析 基于TCGA数据库中374例肝癌患者数据,通过可视化GEPIA软件(http://starbase.sysu.edu.cn/panGeneCoExp.php)[5]分析APE-1和PKM2表达相关性及生存曲线分析。

2 结果
2.1 APE-1沉默抑制肝癌细胞裸鼠成瘤能力饲养至第8周,2组裸鼠成瘤率均为100%,且体质量呈现增长后趋于平稳趋势,成瘤体积呈现持续增长趋势,结果显示APE-1沉默组的裸鼠体质量及成瘤体积均小于对照组(P<0.01),见图1。第8周末处死裸鼠,称量瘤体重量并计算肿瘤体积,结果显示APE-1沉默组和对照组瘤体重量分别为(0.203±0.028)、(1.00±0.105) g,肿瘤体积分别为(0.209±0.039)、(0.921±0.148) cm3;APE-1沉默组成瘤重量及体积均小于对照组(F=13.65、P<0.01,F=14.00、P<0.01),见图2。

图1 成瘤过程中2组裸鼠体质量及成瘤体积与对照组比较:*P<0.05,**P<0.01
2.2 成瘤组织中APE-1、PCNA、Ki-67和PKM2表达检测免疫组化和Western blot方法检测2组成瘤组织中APE-1,细胞增殖标志性蛋白PCNA、Ki-67和PKM2的表达,结果显示APE-1沉默组中蛋白表达均小于对照组(P<0.05),见图3、图4。
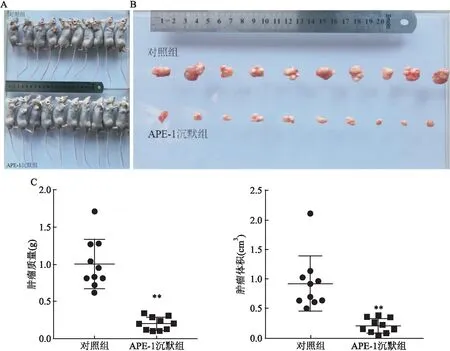
图2 2组裸鼠成瘤瘤体质量及体积比较
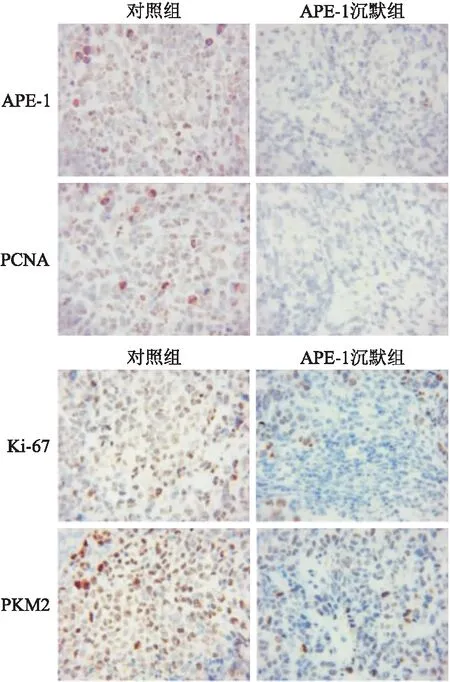
图3 免疫组化检测成瘤组织中APE-1、PCNA、Ki-67和PKM2表达 ×100

图4 Western blot检测成瘤组织中APE-1、PCNA、Ki-67和PKM2表达
2.3 APE-1和PKM2表达相关性分析基于TCGA数据库中374例肝癌患者数据,分析表达相关性。结果表明,APE-1和PKM2在肝癌中表达正相关(R=0.33,P<0.001),见图5。
2.4 PKM2表达在肝癌患者中生存曲线差异结果显示PKM2在肝癌患者中高表达组和低表达组整体生存曲线分布比较差异有统计学意义(P<0.001),低表达组生存期更长,见图6。

图5 APE-1和PKM2表达相关性分析
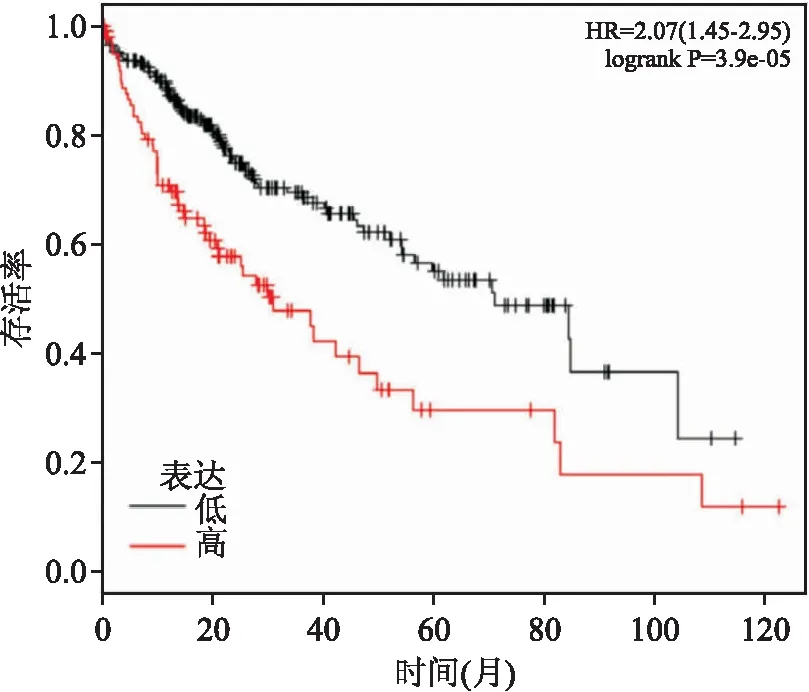
图6 PKM2表达在肝癌患者中生存曲线差异
3 讨论
HCC是预后较差的肿瘤之一,其在分子水平上由多种遗传、表观遗传和信号通路的失调,与肿瘤微环境相互作用导致肿瘤的发生、进展和转移[6]。氧化还原因子APE-1已经被证实在多种肿瘤发生发展中发挥关键作用[7]。Choi et al[8]通过检测277例膀胱癌(BCa)患者尿液中APE-1表达,发现BCa患者的APE-1水平显著升高,并且与肿瘤分级和分期相关,暗示基于无创获得的体液测量尿APE-1水平在临床上可用于诊断BCa;这与Shin et al[9]研究成果血清APE-1可用作膀胱癌的潜在血清生物标志物一致。
在肝癌研究中,Di Maso et al[10]通过临床样本证实APE-1 mRNA含量随着肝病的进展而增加,肝癌中APE-1转录水平的上调显著增加。本课题组前期研究结果显示APE-1在肝癌组织和细胞中均表达升高,其表达与TNM分期、组织病理分级存在差异。沉默APE-1表达可降低肝癌细胞Hep 3B细胞增殖活性,提高细胞凋亡率。APE-1在肝癌细胞中表现出了较强的抗肿瘤潜能[4]。与其它有关APE-1研究进展一致。
裸鼠肿瘤模型由于其保留原发肿瘤本身的形态特征及遗传性,是研究人类肿瘤生物特性以及肿瘤治疗的常用手段;且因为裸鼠肿瘤模型具有成瘤率高、均一性好,能够准确反应肿瘤的生物学特性等优点,因此通过培养瘤细胞来建立裸鼠皮下移植瘤模型,可以为肿瘤治疗的相关研究提供可靠的动物模型。基于前期细胞水平研究,通过建立裸鼠成瘤模型探索APE-1对肝癌发生的影响。结果显示在动物体内成瘤过程中,APE-1沉默组的裸鼠体质量及成瘤重量/体积均小于对照组,表明APE-1沉默抑制肝癌细胞成瘤能力。增殖细胞核抗原PCNA与细胞DNA合成关系密切,在细胞增殖的启动上起重要作用,是反映细胞增殖状态的良好指标[11];Ki67是一种增殖细胞相关的核抗原,其功能与有丝分裂密切相关,在细胞增殖中不可缺少,其表达越高,说明细胞增殖越活跃,肿瘤生长越快,组织分化越差,对化疗也越敏感[12]。通过免疫组化检测成瘤组织,显示APE-1沉默组中细胞增殖标志性蛋白PCNA、Ki-67表达均小于对照组,暗示成瘤抑制作用是由沉默APE-1降低肝癌细胞Hep 3B细胞增殖活性所导致的,与前期研究基础一致[4]。
此外还显示APE-1沉默组肿瘤组织中PKM2蛋白表达低于对照组。丙酮酸激酶M2,也称为PKM,是糖酵解过程最后一步的限速酶。PKM2以无活性单体、低活性二聚体和活性四聚体形式存在,通过高活性四聚体及低活性二聚体之间的转换,调节肿瘤细胞能量和底物供给之间的平衡,对于肿瘤发生至关重要[13]。Dayton et al[14]通过构建PKM2缺失小鼠,发现PKM2的丧失导致具有高渗透性的HCC的自发发展,并伴随着以系统性葡萄糖稳态,炎症和肝脂肪变性改变为特征的全身代谢的逐步变化。基于癌症和TCGA肿瘤标本数据库中374例肝癌患者数据,证明APE-1和PKM2表达线性正相关,且PKM2在肝癌患者中高表达组和低表达组整体生存曲线分布比较差异有统计学意义,低表达组生存期更长。暗示PKM2作为抑癌基因,APE-1可能通过影响PKM2抑制肝癌细胞裸鼠成瘤能力。
综上所述,APE-1在体内同样具有较强的抗肿瘤潜能,其可能通过影响PKM2抑制肝癌细胞裸鼠成瘤能力。

