微小RNA-34a抑制SIRT1对滋养细胞增殖和凋亡的影响
李 红,王 萍,黄晨曦,刘 灵,李根霞
子痫前期(preeclampsia,PE)是妊娠20周后出现的特发性高血压综合征[1]。PE的病因和发病机制尚未完全阐明,研究[2]发现胎盘滋养细胞凋亡过多可引起胎盘浅着床,螺旋动脉重铸失败,进而导致PE等妊娠疾病的发生。微小RNAs(miRNAs)是一类内源性非编码单链小分子RNA,可通过对mRNA的转录后调控影响细胞增殖、分化、凋亡等多种生物学功能[3-4]。沉默信息调节因子1(silent information regulator 1,SIRT1)是III类组蛋白去乙酰化酶,具有抗氧化应激、抗凋亡和延长寿命等作用[5]。研究[6]发现SIRT1与滋养细胞分化以及胎盘形成相关。在肿瘤细胞中miR-34a可靶向调控SIRT1影响肿瘤细胞的增殖和凋亡[7]。然而miR-34a通过调节SIRT1影响滋养层细胞增殖和凋亡尚未见报道。该研究旨在通过探讨miR-34a对SIRT1表达的调控作用及对HTR-8/SVneo细胞增殖和凋亡的影响, 为PE发病机制的研究和治疗提供新的思路。
1 材料与方法
1.1 实验材料
1.1.1组织收集 收集2018年5月—2019年 6 月于郑州大学第三附属医院行剖宫产手术的30例PE患者,和同期在我院行剖宫产的30例正常足月孕妇的胎盘组织。PE的诊断标准严格按照第8版《妇产科学》。排除标准为孕妇患有慢性高血压、妊娠糖尿病、心血管疾病、肝炎、胎儿染色体异常或其他妊娠并发症。2组孕妇孕周、收缩压、舒张压、蛋白尿、胎儿出生体质量比较, 差异有统计学意义(P<0.05)。2组孕妇年龄、体质量指数, 差异无统计学意义(P>0.05)。本研究经郑州大学第三附属医院伦理委员会批准,患者均知情同意。
1.1.2细胞株 人孕早期绒毛外滋养细胞HTR-8/SVeno购自美国典型培养物保藏中心。
1.1.3主要试剂 DMEM高糖培养基购自美国Hyclone公司;胎牛血清购自杭州四季青生物公司;Lipofectamine 3000转染试剂购自美国Invitrogen公司;Opti-MEM培养基购自美国Gibco公司;凋亡试剂盒购自美国BD公司;逆转录试剂盒购自日本东洋纺公司;荧光定量PCR试剂盒购自北京康为世纪公司;兔抗人SIRT1单克隆抗体和兔抗人GAPDH单克隆抗体均购于美国Abcam生物技术有限公司;miR-34a模拟物、miR-34a抑制物及模拟物阴性对照、抑制物阴性对照均由中国上海吉玛公司设计并合成;SIRT1 siRNA和NC siRNA由广州锐博生物公司设计并合成。miR-34a模拟物: sense:5′-UGGC AGUGUCUUAGCUGGUUGU-3′;antisense: 5′-AACC AGCUAAGACACUGCCAUU-3′; 模拟物阴性对照:sense: 5′-UUCUCCGAACGUGUCACGUTT-3′;antisense:5′-ACGUGACACGUUCGGAGAATT-3′;miR-34a抑制物:5′-ACAACCAGCUAAGACACUGCCA-3′;抑制物阴性对照:5′-CAGUACUUUUGUGUAGUACA-3′;SIRT1 siRNA作用于SIRT1 mRNA 的靶序列为CCTTAAAACTAGAGATCAA。
1.2 实验方法
1.2.1标本采集及处理 胎盘分娩后30 min内,于胎盘母体面剪取1 cm×1 cm×1 cm的组织块若干,用生理盐水冲洗后将其分为2份,一份放入含RNA储存液的冻存管中,一份直接放入冻存管,并立即放入液氮冷冻10 min,随后置于-80 ℃保存,以供qRT-PCR和Western blot实验使用。
1.2.2细胞培养 HTR-8/SVneo细胞置于含10%胎牛血清不含双抗的DMEM高糖培养基,于37 ℃,5%CO2培养箱培养。当细胞融合至80%~90%时, 进行消化传代。
1.2.3实验分组 ① 观察miR-34a对SIRT1表达及细胞增殖和凋亡的影响时,HTR-8/SVneo细胞共分为4组:模拟物组、模拟物对照组、抑制物组、抑制物对照组;② 观察SIRT1对HTR-8/SVneo细胞增殖和凋亡的影响时,细胞共分为2组: si-SIRT1组和si-NC组。
1.2.4qRT-PCR TRIzol法提取胎盘组织和转染48 h后各组细胞的总RNA。利用紫外分光光度计的方法测定其浓度和纯度。按照逆转录试剂盒操作流程进行逆转录。qPCR Mix 试剂盒进行qRT-PCR检测,反应条件为:95 ℃预变性10 min; 95 ℃,15 s;60 ℃,60 s,40个循环进行扩增。miR-34a和SIRT1分别采用U6和GAPDH作为内参,采用 2-△△Ct计算目的基因相对表达量。引物序列见表1。

表1 qRT-PCR引物序列
1.2.5Western blot 用预冷PBS将转染48 h后的各组细胞洗涤3次,使用RIPA裂解液冰上裂解30 min,提取总蛋白,BCA定量法测定蛋白浓度。5%浓缩胶和10%分离胶进行凝胶电泳,湿转300 mA 1 h进行转膜;5%脱脂牛奶室温封闭2 h,SIRT1一抗(1 ∶2 500)和GAPDH一抗(1 ∶5 000)4 ℃孵育过夜; 二抗室温孵1 h。ECL发光法和AI600 images成像系统对条带进行扫描,采用Image J 软件进行灰度值分析。
1.2.6MTS法检测细胞增殖 将生长至对数期的HTR-8/SVneo细胞按照8×103细胞/孔,接种于96孔板, 每组6个复孔,每孔含100 μl完全培养基, 细胞密度达到40%~50%后进行转染,48 h后更换含有0.5 mg/ml MTS的无血清培养基,37 ℃孵育1 h。酶标仪检测490 nm处吸光度。
1.2.7流式细胞术检测细胞凋亡水平 收集6孔板中转染后的细胞, 预冷1×Binding Buffer洗涤细胞3次,用100 μl 1×Binding Buffer悬浮细胞,加入5 μl Annexin V-FITC和5 μl PI染色,室温避光孵育15 min,上机前加入400 μl 1×Binding Buffer, 流式细胞仪检测细胞凋亡情况,实验重复3次。
2 结果
2.1 胎盘组织中miR-34a和SIRT1 mRNA的表达及相关性PE组胎盘组织miR-34a表达水平高于对照组,SIRT1 mRNA表达水平低于对照组,差异均有统计学意义(t=8.787、-8.731,P<0.001),见图1A。Pearson相关性分析显示miR-34a和SIRT1的表达呈负相关(r=-0.707 4,P<0.05),见图1B。
2.2 转染 miR-34a模拟物和抑制物后,HTR-8/SVeno细胞中miR-34a和SIRT1的表达水平① qRT-PCR技术检测结果显示miR-34a在miR-34a模拟物组细胞中表达水平高于模拟物对照组, 差异均有统计学意义,(t=14.947,P<0.001),在 miR-34a抑制物组中表达水平低于抑制物对照组,差异有统计学意义(t=-9.662,P<0.01),见图2A。SIRT1 mRNA 在 miR-34a 模拟物组细胞中的表达水平低于模拟物对照组,在miR-34a 抑制物组中的表达水平高于抑制物对照组,差异有统计学意义(t=-3.942、4.214,P<0.05),见图2B。② Western blot印迹法结果显示, 与模拟物对照组相比,miR-34a模拟物组SIRT1蛋白表达水平降低,与抑制物对照组相比,miR-34a抑制物组中SIRT1蛋白表达水平升高,差异有统计学意义(t=-5.126、6.571,P<0.01),见图2C。
2.3 miR-34a对HTR-8/Sveno细胞增殖和凋亡的影响MTS结果显示,转染48 h后,miR-34a模拟物组细胞的增殖受到抑制。miR-34a抑制物组细胞的增殖水平增加,差异均有统计学意义(t=-10.964、15.670,P<0.001),见图3A。流式细胞术结果显示,转染48 h后,miR-34a模拟物组细胞凋亡增多,差异有统计学意义(t=6.868,P<0.01)。miR-34a抑制物组细胞凋亡减少,差异均具有统计学意义(t=-16.711,P<0.001)见图3B、C。
2.4 沉默SIRT1对HTR-8/SVeno细胞SIRT1 mRNA和蛋白表达的影响与si-NC组相比,si-SIRT1组中SIRT1 mRNA和蛋白的表达水平降低,差异有统计学意义(t=-7.077、-12.111,P<0.05),见图4。
2.5 沉默SIRT1对HTR-8/SVeno细胞增殖和凋亡的影响MTS结果显示,转染48 h后,SIRT1 siRNA组HTR-8/SVeno细胞的增殖受到抑制,差异有统计学意义(t=-19.709,P<0.05),见图5A。流式细胞术结果显示,SIRT1 siRNA组HTR-8/SVeno细胞的凋亡水平增加,差异有统计学意义(t=4.951,P<0.05),见图5B、C。
2.6 miR-34a结合SIRT1 mRNA靶点位置预测通过在线靶基因预测网站mircroRNA(http://www.mircrorna.org/)预测到miR-34a与SIRT1 mRNA具有靶向结合位点,见图6。

图1 胎盘组织中miR-34a和SIRT1 mRNA的表达及相关性

图2 miR-34a对HTR-8/SVeno细胞中SIRT1 mRNA和蛋白表达的影响
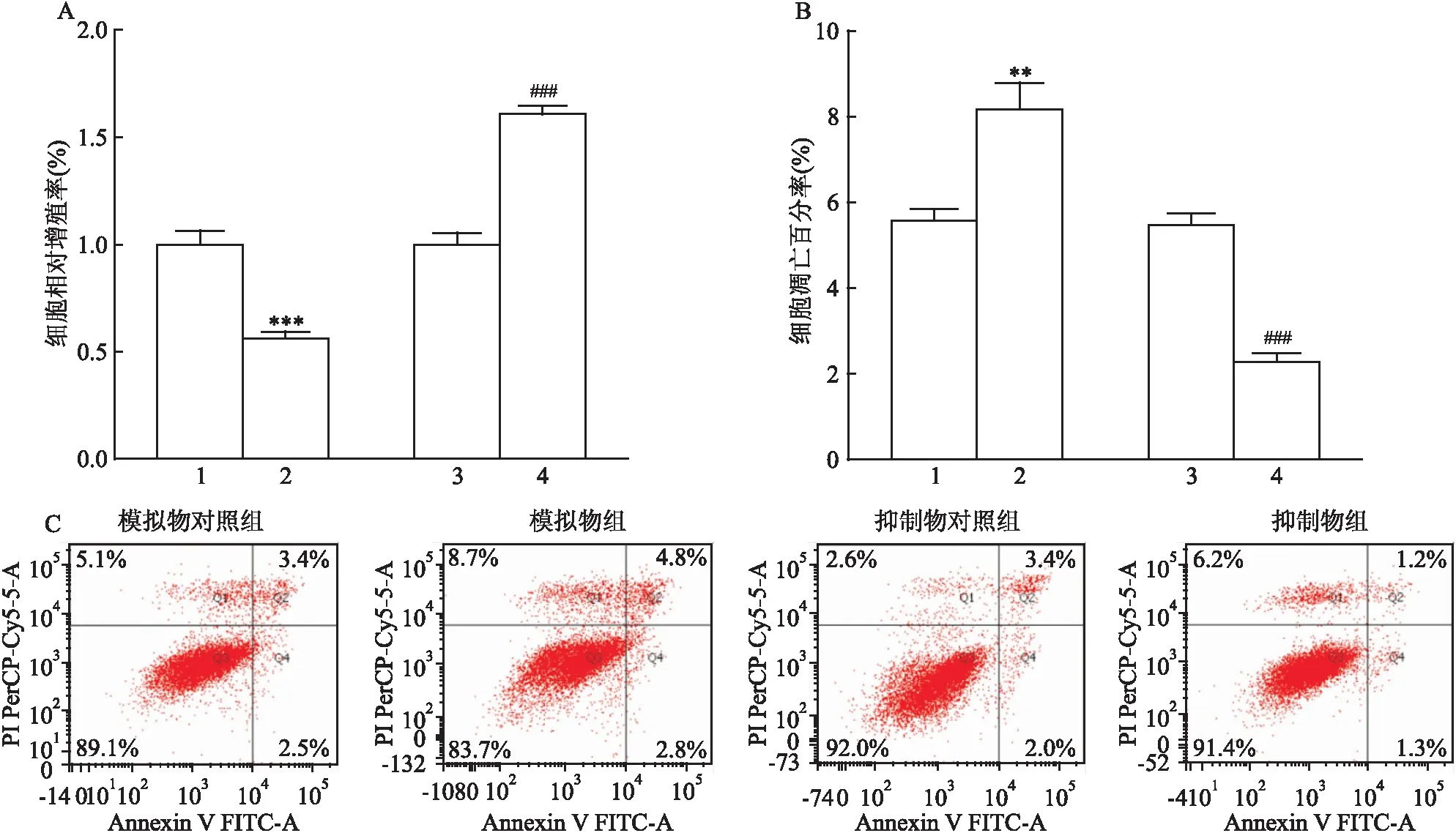
图3 miR-34a对HTR-8/SVeno细胞增殖和凋亡的影响
3 讨论
miR-34a是一种肿瘤抑制基因,位于染色体1p36,与细胞增殖、凋亡、迁移等多种生物学功能有关。研究[8-10]发现miR-34a可通过调控Notch信号通路和靶向作用MYC、Smad4等下游基因抑制滋养细胞侵袭,也可通过靶向Bcl-2促进滋养细胞凋亡,进而参与PE的发生发展。本研究显示,与健康孕妇胎盘组织相比,miR-34a 在 PE 胎盘组织中升高,这与既往报道相一致。胎盘滋养细胞增殖能力降低,凋亡增加可引起胎盘浅着床,螺旋动脉重铸不足,导致胎盘形成不良,是PE发生的一个重要因素。HTR-8/SVeno细胞中过表达 miR-34a可抑制细胞增殖,促进细胞凋亡。相反,抑制miR-34a的表达,促进了细胞的增殖,并抑制细胞凋亡,进一步证实了miR-34a在PE的发生发展中可能发挥重要的作用。

图4 沉默SIRT1对HTR-8/SVeno细胞SIRT1 mRNA和蛋白表达的影响
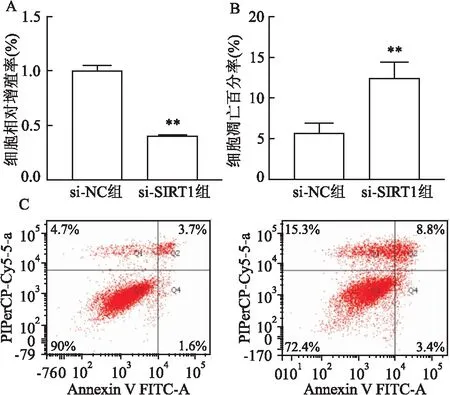
图5 沉默SIRT1对HTR-8/SVeno细胞增殖和凋亡的影响

图6 miR-34a结合SIRT1 mRNA的靶向位点预测
SIRT1可去乙酰化其下游基因p53,调控p53依赖的细胞凋亡途径,也可通过去乙酰化Nrf2、PCG-1α等抗氧化基因缓解氧化应激诱导的细胞损伤和凋亡,还可通过调节细胞自噬相关基因来抑制细胞凋亡[11-12]。SIRT1主要位于人类胎盘合体滋养细胞层和细胞滋养细胞、羊膜上皮、绒毛滋养细胞层和蜕膜细胞,对滋养细胞的分化和胎盘形成具有重要的调控作用。NDRG1与SIRT1/p53信号相互作用可减轻人滋养细胞缺氧损伤[13]。本研究显示,PE组胎盘组织中SIRT1 mRNA表达降低。体外实验表明抑制SIRT1表达后,HTR-8/SVeno细胞的增殖能力下将,凋亡水平增加。提示SIRT1可能通过调控细胞增殖和凋亡水平参与PE的发病机制。
有研究[7]表明SIRT1是miR-34a的一个靶标, 生物信息学网站也表明二者存在靶向结合位点,理想的mirSVR score应该小于等于-0.1,图6结果显示二者结合不够稳固(mirSVR score为-0.274 7)。但是使用miR-34a模拟物,可抑制SIRT1 mRNA和蛋白表达;使用miR-34a抑制物,SIRT1 mRNA和蛋白表达上调;组织实验也显示SIRT1与miR-34a的表达呈负相关。这些结果表明miR-34a可能通过调控SIRT1的表达参与PE的发生发展。但miR-34a是否能够直接靶向作用于SIRT1进而影响HTR-8/SVeno细胞的增殖和凋亡能力,参与PE的发生发展,还需深入研究。
miR-34a和SIRT1 可能参与了PE的发病过程,其分子机制可能是miR-34a 通过抑制SIRT1 mRNA 和蛋白表达,抑制滋养细胞的增殖、促进滋养细胞凋亡,进而促进PE的发生发展,这为PE的发病机制提供了新的思路和方法,为PE的预防和治疗提供了新的视角。

