赖氨酸-半乳糖对TMAO-Fe(II)体系中TMAO热分解的影响
李颖畅,李双燕,曹娜娜,刘雪飞,蔡友琼
(1.渤海大学食品科学与工程学院,生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心,辽宁 锦州 121013;2.中国水产科学研究院东海水产研究所,上海 200090)
鱿鱼具有很高的营养价值,含有丰富的氨基酸、还原糖等,属于低脂肪高蛋白水产品,鱿鱼体内含有大量的氧化三甲胺(trimethylamine oxide,TMAO),TMAO具有保持鱼体内氮的平衡及调节体内渗透压的作用[1]。同时TMAO是水产品鲜味的主要成分[2]。鱿鱼在加热过程中TMAO热分解产生甲醛(formaldehyde,FA)、二甲胺(dimethylamine,DMA)和三甲胺(trimethylamine,TMA)[3-4],鱿鱼中高含量FA给鱿鱼产品品质和食用安全带来了负面的影响[1],同时对鱿鱼制品的出口也造成很大的经济损失。因此,鱿鱼在加工和运输过程中的FA超标问题越来越受到人们的重视[5]。
美拉德反应是一种普遍的非酶褐变现象,被广泛应用于食品加工、烟草加香等多个领域[6-7]。鱿鱼在加工和贮藏过程发生的褐变反应主要由美拉德反应引起[8]。鱿鱼体内含有高含量的蛋白质和水解氨基酸,再加上鱿鱼本身含有的半乳糖(galactose,Gal)、葡萄糖,以及调味料中乳糖、蔗糖等水解产生的还原糖为美拉德反应提供了必须的反应物[9]。鱿鱼在加工过程中,特别是蒸煮、烘烤的环境中,美拉德反应难免发生。目前国内外对鱿鱼制品中美拉德反应与TMAO分解的研究较少,Vaisey[10]报道了半胱氨酸(Cys)和Fe2+或Cys和血红蛋白能催化TMAO分解产生TMA、少量DMA和FA。李丰[11]研究发现乳糖促进TMAO热分解形成FA,认为鱿鱼丝贮藏过程中FA的产生与美拉德反应有关。同时,李薇霞[12]研究奶糖中FA产生机理时,认为FA的产生与美拉德反应密不可分;因为鱿鱼在加工过程中存在美拉德反应,推测FA产生可能与氨基酸和还原糖有关[13]。目前大多数研究均通过外源添加氨基酸或者还原糖探究对鱿鱼中TMAO热分解的影响,但关于美拉德反应对TMAO分解反应的影响及机制研究却鲜见报道。
本实验在进行体外模拟实验之前对鱿鱼中氨基酸和还原糖的成分进行检测,结果发现鱿鱼所含的氨基酸中赖氨酸(Lys)、谷氨酸、精氨酸、天冬氨酸含量较多;还原糖中Gal含量最多。又因为Lys最易与还原糖发生美拉德反应,因此以TMAO-Fe(II)模拟体系为研究对象,将Lys、Gal以及Lys-Gal的混合溶液分别加入到模拟体系当中进行反应,研究在不同的浓度比、反应时间、反应温度下对模拟体系中TMAO降解的变化规律。并采用DSC技术探讨Lys、Gal、Lys-Gal对TMAO降解的作用机制,为下一步研究蒸煮和煎烤鱿鱼中TMAO的热分解机制提供理论依据。
1 材料与方法
1.1 材料与试剂
TMAO标准品(纯度>99%) 国家环境保护总局标准样品研究所;D-Gal、L-Lys(纯度>98%)生工生物工程(上海)股份有限公司;甲醇(色谱纯) 北京DIKMA公司;无水硫酸钠、三羟甲基氨基甲烷 上海阿拉丁生化科技股份有限公司;对甲苯磺酰氯 天津致远化学试剂有限公司;甲苯 上海易恩化学技术有限公司;磷酸二氢钾、磷酸氢二钾、氯化钾、铁氰化钾、氯化铁 上海国药集团化学试剂有限公司;以上无特殊说明均为分析纯。
1.2 仪器与设备
UV-2550紫外-可见分光光度仪 日本岛津仪器有限公司;冷冻高速离心机 美国Thermo公司; GC7890气相色谱仪、液相色谱仪 美国安捷伦科技公司;DSCQ2000差示热量扫描仪 美国TA公司;Milli-Q超纯水系统 美国Millipore公司;电子分析天平 瑞士Mettler Toledo公司;雷磁PHS-C型pH计 上海仪电科学仪器股份有限公司。
1.3 方法
TMAO-Fe(II)体系的制备:20 mmol/L TMAO+0.2 mmol/L Fe(II)+20 mmol/L Tris-乙酸(pH 7)。
试剂配制:用蒸馏水将Lys、Gal配成0.1 mol/L的母液备用。
1.3.1 还原力和褐变程度的测定
取一定量的Lys和Gal的母液将两者混合定容至100 mL,使溶液中Lys和Gal浓度均为0.08 mol/L。再分别取一定量的Lys、Gal母液各加入蒸馏水定容到100 mL,使浓度为0.08 mol/L。取配好的各溶液10 mL于25 mL具塞试管中,在100 ℃水浴锅中反应90 min后,冷却备用,进行还原力和褐变程度的测定。
还原力的测定参考Yen等[14]建立的方法。
褐变程度测定参考Ajandouz等[15]的方法。将反应后的溶液稀释100 倍,分别在294 nm和420 nm波长处测吸光度,用吸光度表示褐变程度。
1.3.2 温度对模拟体系中TMAO热分解的影响
分别取2 mL Lys溶液、Gal溶液、Lys-Gal溶液与2 mL TMAO-Fe(II)溶液(浓度比为4∶1)组成反应体系,分别于60、70、80、90、100 ℃条件下反应30 min后,迅速冷却,加入1 mL 7.5%的三氯乙酸终止反应,5 000 r/min离心15 min,测定TMAO、FA、DMA、TMA含量。
1.3.3 时间对模拟体系中TMAO热分解的影响
分别取2 mL Lys溶液、Gal溶液、Lys-Gal溶液与2 mL TMAO-Fe(II)溶液(浓度比为4∶1)组成反应体系,于100 ℃反应条件下分别反应0、15、30、45、60、75 min后,迅速冷却,加入1 mL 7.5%的三氯乙酸终止反应,5 000 r/min离心15 min后,测定TMAO、FA、DMA、TMA含量。
1.3.4 反应物量比对模拟体系中TMAO热分解的影响
分别取2 mL Lys溶液、Gal溶液、Lys-Gal溶液与2 mL TMAO-Fe(II)溶液组成反应体系,使溶液中的Lys、Gal、Lys-Gal与TMAO-Fe(II)的浓度比分别为1∶4、1∶2、1∶1、2∶1、4∶1于100 ℃条件下反应30 min后,迅速冷却,加入1 mL 7.5%的三氯乙酸终止反应,5 000 r/min离心15 min后,测定TMAO、FA、DMA、TMA含量。
1.3.5 体系中TMAO、TMA、FA、DMA的测定方法
TMA测定参考朱军莉等[16]的方法。TMAO含量测定:先将TMAO还原为TMA后进行测定,取2 mL的反应液加入1%的三氯化钛溶液0.25 mL,80 ℃水浴90 s,冷却后同TMA测定方法。
DMA测定参考贾佳[17]的方法。FA测定参考Li Jianrong等[18]建立的高效液相色谱法测定水产品中FA含量。1.3.6 DSC分析用专用坩埚称取5~10 mg的样品。测试条件:温度20~200 ℃,氮气气氛,以15 ℃/min条件进行升温。
1.4 数据分析
每个实验重复3 次,采用Origin 9.1软件作图,SPSS 19.0对数据进行方差分析,P<0.05,差异显著。
2 结果与分析
2.1 Lys、Gal、Lys-Gal的还原力和褐变程度

表1 Lys、Gal、Lys-Gal的还原力和褐变程度Table 1 Reducing powers and browning degrees of Lys, Gal and Lys-Gal
吴帅帅等[19]研究发现DMA、FA的生成与美拉德反应产物(Maillard reaction products,MRPs)的抗氧化性有相关性。此外有研究表明一些具有还原性的物质使TMAO发生非酶降解[10],且TMAO非酶途径与水产品的贮藏温度和还原条件有关。因此研究Lys、Gal、Lys-Gal溶液的褐变程度和还原力,并探究其抗氧化性,为研究Lys、Gal、Lys-Gal对TMAO降解的影响奠定基础。由表1可以看出,Lys、Gal和Lys-Gal都发生了不同程度的褐变,但是Lys-Gal在高温条件下反应生成MRPs的紫外吸光度和褐变程度显著(P<0.05)增加,高于单独的Lys和Gal。这是因为随着Lys-Gal美拉德反应的进行,促进了褐色素物质的生成,从而加深了反应产物的褐变程度[20]。Hwang等[21]报道了MRPs的还原力与紫外吸光度和褐变程度有关。Yilmaz等[22]报道了MRPs水溶液在100 ℃和200 ℃条件下分别加热10、20、30 min均具有抗氧化活性。还原力是反应物质抗氧化作用的重要指标,通常样品的还原力与抗氧化能力呈正相关[23]。从表1可以看出,Lys-Gal反应产生的MRPs在还原力方面明显高于单独的糖和氨基酸,这是因为在反应过程中MRPs可以提供电子,使Fe3+还原为Fe2+,起到还原作用[24]。
2.2 温度对模拟体系中TMAO降解的影响
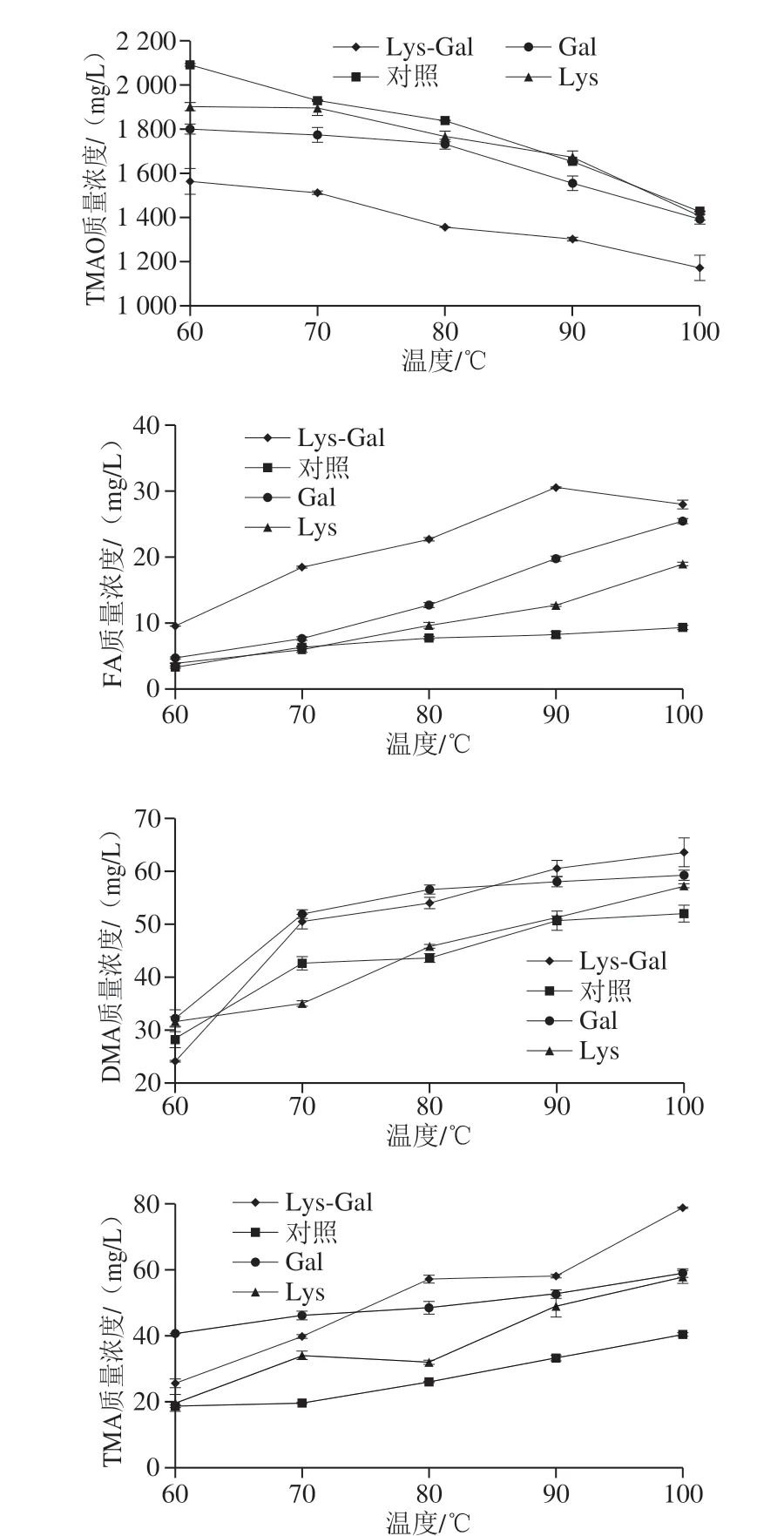
图1 加热温度对各体系中TMAO、FA、DMA和TMA含量变化的影响Fig. 1 Effects of heating temperature on the contents of TMAO, FA,DMA and TMA in each model system
通过上述的实验结果发现Lys-Gal产生的MRPs产物在还原力和褐变程度方面比Gal、Lys强,因此进一步研究了在60~100 ℃加热后Lys-Gal、Gal、Lys对TMAO热分解的变化规律,由图1可见,随着反应温度的升高,对照组和处理组的TMAO含量均降低表现出相似的变化趋势,逐渐热分解为FA、DMA、TMA。相对于对照组、Gal-TMAO-Fe(II)和Lys-TMAO-Fe(II)而言,温度越高Lys-Gal-TMAO-Fe(II)体系中TMAO降解程度越显著(P<0.05),相应FA、DMA、TMA的含量也最高,但在90~100 ℃之间Lys-Gal处理组的FA含量有下降的趋势,分析可能是随温度的升高,体系中其他反应产物浓度越来越大,影响了FA的溶解度,因此FA含量有下降的趋势[25]。但整个过程FA含量仍是增加的,朱军莉等[26]研究发现加热可能会使FA挥发,使FA含量略有下降,但是FA含量总体增加。本实验中Gal、Lys在较高温度下可以促进TMAO分解,这一结果与陈帅等[27]研究结果一致。同时本实验也表明了Lys-Gal的混合物在较高的温度下对TMAO降解的促进作用最强,其次是Gal、Lys。
2.3 时间对模拟体系中TMAO降解的影响
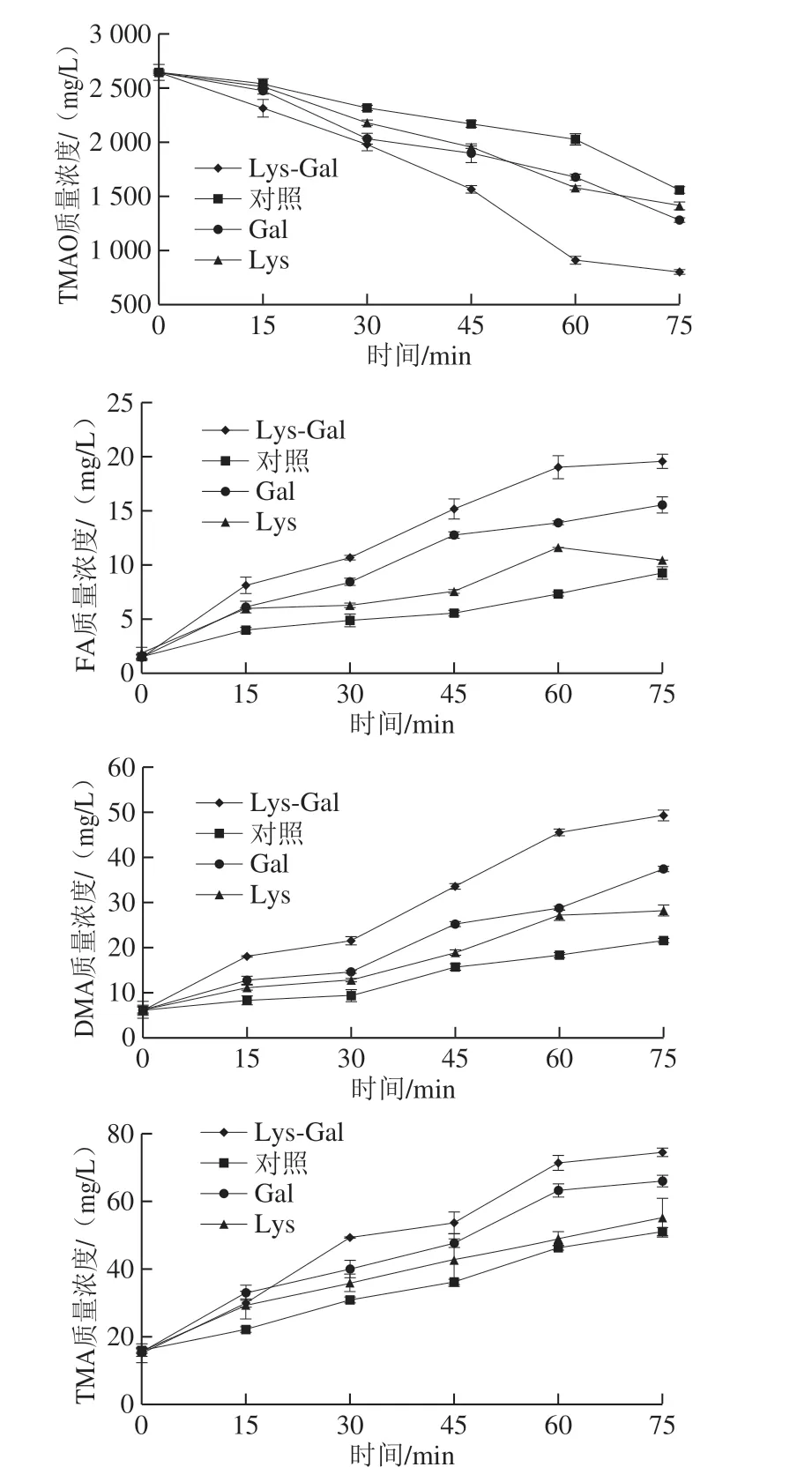
图2 加热时间对各体系中TMAO、FA、DMA和TMA含量变化的影响Fig. 2 Effects of heating time on the contents of TMAO, FA, DMA and TMA in each model system
由图2可知,随着加热时间延长,对照组和3 个处理组的TMAO热分解程度增加,其中Lys-Gal-TMAO-Fe(II)中的TMAO含量减少最显著(P<0.05),从最初的2 644.4 mg/L下降至800.83 mg/L,降解率为69.71%,分别是对照组、Gal-TMAO-Fe(II)、Lys-TMAO-Fe(II)组的1.7、1.3 倍和1.4 倍,相应的分解产物FA、DMA、TMA也明显高于另外3 组。这是因为随着反应时间的延长,Lys-Gal反应生成MRPs的抗氧化性更高[28],还原力更大,促进了TMAO非酶途径的降解[19]。从而使TMAO降解率更大,FA、DMA、TMA生成量最多。
2.4 反应物量比对模拟体系中TMAO降解的影响

图3 反应物量比对各体系中TMAO、FA、DMA和TMA含量变化的影响Fig. 3 Effects of reactant ratio on changes in TMAO, FA, DMA and TMA contents in each model system
由图3可知,加入Gal、Lys、Lys-Gal后TMAO含量下降,FA、DMA、TMA含量有所升高均高于对照组,说明Gal、Lys、Lys-Gal能促进TMAO的降解,随着Gal、Lys、Lys-Gal浓度的增大,TMAO降解速度和FA、DMA、TMA的生成速度逐渐增快,Lys-Gal-TMAOFe(II)中的各指标变化大于Lys-TMAO-Fe(II)和Gal-TMAO-Fe(II)两组,并且各指标随着浓度的增加呈显著变化(P<0.05)。当Lys-Gal与TMAO的比值为4∶1时TMAO质量浓度降为1 217.81 mg/L,相应的分解产物FA、DMA、TMA的生成量最多。这是因为随着反应浓度的增加,Lys-Gal生成的MRPs可以阻止Fe2+被氧化从而促进TMAO分解,使FA、DMA、TMA生成量高于其他组。
2.5 Lys、Gal、Lys-Gal对模拟体系中TMAO热分解的影响
通过分析DSC曲线形状的变化可反映样品的稳定性[29]。图4A显示了随着温度的升高,TMAO标准品逐渐出现了均匀失重的现象,可以看出从55 ℃开始TMAO标准品的DSC曲线图向下呈吸热状态,在98.75 ℃时出现最小值,这是因为TMAO为标准品纯度为98%,其所含杂质挥发所致;整个过程无明显的吸热和放热峰,表明TMAO标准品在整个挥发过程中只需要吸收热量。这一结果与朱军莉等[30]研究的TMAO热分解结果一致。


图4 TMAO(A)、TMAO-Fe(II)(B)、Lys-TMAO-Fe(II)(C)、Gal-TMAO-Fe(II)(D)、Lys-Gal-TMAO-Fe(II)(E)热分解的DSC图Fig. 4 DSC curves for thermal decomposition of TMAO (A), TMAOFe (II) (B), Lys-TMAO-Fe (II) (C), Gal-TMAO-Fe (II) (D), and Lys-Gal-TMAO-Fe (II) (E)
图4 B显示了TMAO-Fe(II)的热分解情况,可以明显看出DSC曲线产生了吸热和放热峰,在93.41 ℃时出现第一阶段的吸热峰,可能是样品从固体向熔融状态转变的过渡态[31],此时TMAO开始熔化发生固态相变;第2阶段的吸热峰出现在162.28 ℃,此阶段TMAO开始分解。说明加入Fe2+后促进了TMAO高温分解,使主要的分解反应在较低的温度下发生。可以看出在126.18 ℃出现了放热峰,可能是由于Fe2+在高温的条件下容易被氧化为Fe3+所致[30]。
图4C、D分别显示了Gal-TMAO-Fe(II)、Lys-TMAO-Fe(II)的分解过程,Gal-TMAO-Fe(II)中吸热阶段分别在68.35 ℃和137.04 ℃的时候出现吸热峰,在100.03 ℃出现放热峰;Lys-TMAO-Fe(II)中的2 个吸热阶段在83.6 ℃和130.95 ℃时出现吸热峰,在111.01 ℃出现放热峰,与TMAO-Fe(II)体系的DSC曲线图相比,加入Gal、Lys后吸热和放热峰的位置都出现了前移,TMAO熔融和分解温度提前,又因为整个实验过程的处理条件相同,所以Gal、Lys对TMAO降解的促进作用大于Fe2+,更容易使TMAO进行分解。
图4E显示了Lys-Gal-TMAO-Fe(II)的DSC曲线图,出现了3 个吸热峰,第1阶段吸热峰温度为65.28 ℃,与之前4 个样品的DSC图相比较,TMAO分解温度明显变低,并且Lys-Gal使TMAO分解阶段由2 个吸热阶段变为了3 个吸热阶段,分析可能的原因是因为Lys-Gal的还原力较高,使TMAO的分解反应在更低的温度下进行,从而加速了TMAO的分解。从整个DSC图可以看出Lys-Gal相较于单个的糖和氨基酸更能降低TMAO的分解温度。
3 结 论
相对Lys和Gal,Lys-Gal混合物反应形成的MRPs表现出更高程度的褐变和更好的还原能力,其抗氧化能力更强。
Gla、Lys、Lys-Gal这3 种添加物均可以促进TMAO降解生成FA、DMA和TMA,相同条件下Lys-Gal-TMAO-Fe(II)体系反应程度更高一些,TMAO降解程度更大,这可能是因为Lys-Gal在高温条件下生成MRPs的还原性较强,从而更容易促进TMAO降解。
从DSC图可以看出Lys、Gal、Lys-Gal可以使TMAOFe(II)体系热反应的热分解温度明显降低,表明3 种物质参与并加快了TMAO-Fe(II)的热分解反应,使TMAO-Fe(II)中TMAO分解需要较少的能量,加速TMAO的热分解,产生更多的FA、DMA和TMA。

