孕母合并HCA应用产前糖皮质激素与早产儿预后相关性分析
蔡志勇,刘进娣,卞洪亮,蔡金兰,朱相干,贾丽娅
(扬州大学医学院附属盐城市妇幼保健院 1.新生儿科;2.妇产科,江苏 盐城 224000)
2017年“糖皮质激素产前应用”指南建议孕周为24+0~33+6周有早产风险的孕妇在产前7天内给予1个疗程的产前糖皮质激素(antenatal corticosteroid,ACS)治疗[1]。产前应用ACS可降低早产儿呼吸窘迫综合征(respiratory distress syndrome,RDS)、脑室内出血(intraventricular hemorrhage,IVH)、坏死性小肠结肠炎(necrotizing enterocolitis,NEC)的发生率和死亡率,减少机械通气时间[1-3]。有研究表明,ACS在给药后2~7天达到最佳效果[1,4]。尽管ACS对单胎早产儿的有益作用已被广泛证实,但在某些特殊情况下,如母亲为绒毛膜羊膜炎,ACS对新生儿结局的益处仍存在争议。Been等[5]报道了包含7项研究的Meta分析,结果表明ACS可降低合并组织学绒毛膜羊膜炎(histological chorioamnionitis,HCA)孕母子代新生儿不良结局的发生率。但是,这些研究中绒毛膜羊膜炎或子宫内感染均为临床诊断,未经病理组织学检查证实。日本的一项研究表明,与未合并HCA的孕母相比,合并HCA的孕母应用ACS对子代新生儿结局的益处更高[6]。但该研究未考虑ACS应用时间和剂量上的差异。
本研究探讨适于胎龄(appropriate for gestational age,AGA)的单胎早产儿孕母合并HCA时,应用ACS与新生儿结局之间的相关性;同时还比较了应用ACS的最佳疗程、次优疗程与不应用ACS各组新生儿结局。
1研究对象与方法
1.1研究对象
收集2014年1月至2018年12月在扬州大学附属盐城市妇幼保健院分娩的孕母及其早产儿的临床资料共268例,采用回顾性病例对照分析法,并经本院伦理委员会批准,所有研究对象知情同意。纳入标准[7]:①单胎;②早产胎龄为24+0~33+6周;③AGA,即出生体重位于同胎龄儿平均体重第10至90百分位之间;④孕母胎盘已行病理检查;⑤早产儿入住新生儿重症监护病房。排除标准:①胎儿过大或过小,即出生体重低于同胎龄儿平均体重第10百分位或大于同胎龄儿平均体重第90百分位;②多胎;③严重先天性畸形,包括先天性心脏病、膈疝等;④孕母未完成1个标准疗程或多次应用ACS;⑤临床资料缺失。
1.2研究方法
1.2.1分组
孕母分娩后胎盘、胎膜均及时送病理检查。标本经4%甲醛固定后,石蜡包埋、切片、苏木精-伊红染色。按照胎盘、胎膜白细胞浸润数量≥5个/高倍镜视野(high power field of view,HP)诊断HCA[8],将孕母合并HCA者分为HCA+组,无HCA者分为HCA-组。
将应用ACS者定为ACS组。根据ACS的应用情况,又分为最佳ACS组(optimal ACS,OACS组,产前≥24小时、<7天应用,且完成1个标准疗程,即地塞米松5mg/kg,肌内注射,12小时1次,共4次)、次优ACS组(suboptimal ACS,SACS组,产前<24小时、≥7天应用)[1]、未应用ACS者为未用ACS组(no ACS,NACS组)。
1.2.2观察指标
①孕母指标:合并妊娠期糖尿病(gestational diabetes mellitus,GDM)、胎膜早破、羊水过少、不可避免早产、胎儿窘迫及剖宫产的比例。②早产儿指标:RDS,肺表面活性物质(pulmonary surfactant,PS)的应用,动脉导管未闭(patent ductus arteriosus,PDA)的治疗率,败血症、NEC(≥2b)、IVH(≥3级)、低血压(生后7天内)、脑室周围白质软化症(periventricular leukomalacia,PVL)、支气管肺发育不良(bronchopulmonary dysplasia,BPD)及重度BPD、视网膜病变(retinopathy of prematurity,ROP)的住院时间及死亡率;出生时胎龄、出生体重、男婴比例、血气酸碱度(pH)及生后1min、5min Apgar评分。以上疾病的诊断均参考《实用新生儿学》(第5版)[9]。
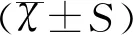
1.3统计学方法
2结果
2.1各组孕母的一般情况
在纳入的268例孕母及其早产儿中,孕母合并HCA(HCA+组)117例(43.7%),233例(86.9%)产前接受了ACS治疗;在HCA+组和HCA-组的孕母中,应用ACS组与未用ACS组的比例,以及OACS组、SACS组、NACS组的比例差异均无统计学意义(均P>0.05),见表1。
2.2孕母合并HCA产前用ACS与子代AGA早产儿一般情况及新生儿结局
ACS组包含OACS组和SACS组,与未应用ACS的NACS组的孕母因素和子代早产儿因素一般情况比较差异均无统计学意义(均P>0.05),见表2。单因素分析显示,ACS组早产儿中重度BPD及生后7天内低血压发生率均低于NACS组(均P<0.05),见表3。多因素分析中,经校正胎龄、性别及剖宫产等混杂因素后,亦可发现ACS组早产儿中重度BPD及生后7天内低血压发生率均低于NACS组,但其子代早产儿PDA治疗率较高,差异有统计学意义(均P<0.001),见表4。
OACS、SACS和NACS三组的孕母剖宫产比例差异有统计学意义(P=0.002),见表2。经校正胎龄、性别及剖宫产等混杂因素后,多因素分析显示OACS组的重度BPD及生后7天内低血压的发生率均低于NACS组(均P<0.05),见表3。但OACS组的PDA治疗率及败血症的发生率均较NACS组高,差异均有统计学意义(均P<0.001),SACS组的生后7天内低血压发生率低于NACS组(P<0.001),但ACS组及SACS组败血症的发生率与NACS组比较均无显著性差异(均P>0.05),见表4。

表1 孕母应用ACS比例的比较结果[n(%)]

表2 孕母合并HCA产前用ACS的子代AGA早产儿一般情况比较结果

表3 孕母合并HCA产前用ACS的新生儿结局比较结果

表4 孕母合并HCA的ACS各组与NACS组新生儿结局Logistic多因素回归分析
2.3孕母未合并HCA应用ACS与子代AGA早产儿一般情况及新生儿结局
ACS组包含OACS组和SACS组,与NACS组的孕母因素和子代早产儿因素一般情况比较差异均无统计学意义(均P>0.05),见表5。单因素分析显示,ACS组的PDA治疗率低于NACS组,差异有统计学意义(P<0.001),见表6。多因素分析中,经校正胎龄、性别及剖宫产等混杂因素后,亦可得出ACS组的PDA治疗率低于NACS组,见表7。

表5 孕母未合并HCA产前用ACS的子代AGA早产儿一般情况比较结果

表6 孕母未合并HCA产前用ACS的新生儿结局比较结果

表7 孕母未合并HCA的ACS各组与NACS组新生儿结局Logistic多因素回归分析

续表7
3讨论
3.1应用ACS可降低孕母合并HCA子代早产儿早期肺动脉高压和重度BPD的风险
产前应用糖皮质激素可促进胎儿成熟,其应用剂量及时间早已引起产科、儿科医务人员的重视[10-11]。目前,在早产儿临产前1周内给予ACS已是一种常规做法;但ACS对孕母合并HCA的新生儿结局的影响仍存在争议。广东省26家三级甲等医院新生儿科超低出生体重儿(extremely low birth weight infant,ELBWI)ACS应用率为53.0%,但新生儿呼吸窘迫综合征(neonatal respiratory distress syndrome,NRDS)、BPD及需治疗的PDA等并发症的发生率却呈现逐年增高的趋势,考虑与研究对象为ELBWI,同时与其存活率逐年升高(BPD的诊断发生在生后28天之后)及出生胎龄和体重逐年降低有关[12]。国外有研究发现,孕母合并HCA与子代严重不良新生儿结局和远期神经系统发育障碍有关[13-14]。因此,在关于ACS对新生儿结局影响的研究中,不能排除孕母HCA的影响。Lee等[15]认为孕母HCA与子代早产儿IVH和早期脓毒症发生有关,ACS的应用可降低孕母合并HCA子代早产儿BPD的发生率和机械通气时间;但该研究中包含了所有的早产儿,未考虑诸如小于胎龄儿(small for gestational age,SGA)和多胎妊娠等混杂因素。本文研究表明,当孕母合并HCA时,ACS的应用,特别是在最佳疗程中应用时,子代单胎AGA新生儿不良结局发生率降低,包括重度BPD和低血压的发生率。有研究表明,ACS的应用可以降低早产儿生后最初几天的血压支持干预,特别是对极早产婴儿[16-17]。本研究发现,ACS对早产儿生后7天内低血压的有益作用,减少了血压支持干预,可降低生后早期肺动脉高压的发生。Berenz等[18]认为早期肺动脉高压与极低出生体重儿死亡率增加和晚期BPD的发生有关。余彦亮等[19]也发现,肺动脉高压是影响BPD预后的最为重要的因素。因此,ACS的应用可以降低孕母合并HCA子代早产儿早期肺动脉高压和重度BPD的风险。
3.2孕母合并HCA时ACS的应用与子代早产儿PDA治疗的相关性
关于孕母合并HCA是否增加子代早产儿发生如PDA等血流动力学显著性改变仍存在争议[20-21]。本研究中,与未应用ACS组相比,最佳疗程应用ACS组其子代早产儿PDA治疗率升高;而未合并HCA时,ACS的应用可降低子代早产儿PDA的治疗率。Verma等[22]认为,ACS可通过影响前列腺素E2与导管组织的相互作用(降低其对前列腺素E2的敏感性)降低PDA的发生率。Koc等[23]研究表明,宫内炎症(如HCA)增加了环氧化酶1的活性,合并HCA组ACS的应用使子代PDA增加,可能是HCA对PDA的影响大于ACS对PDA的影响,又或者ACS和HCA对PDA可能存在另一种相互作用。因此还需要更大型的队列进一步的研究以阐明HCA、ACS和PDA之间的关系。
3.3 ACS的应用增加了子代早产儿败血症的发生率
对于疑似宫内感染的孕妇,如绒毛膜羊膜炎和真菌感染,ACS的应用仍存在许多争论。众所周知,HCA能刺激肾上腺,导致皮质醇增加,从而加速肺成熟[24];ACS也会增加皮质醇。因此担心过高的皮质醇会对新生儿结局产生有害影响。与以往的其他研究[6,25]不同,本研究发现孕母合并HCA的早产儿应用最佳疗程的ACS与早产儿败血症的风险增加有关。考虑虽然ACS具有抗炎作用,可以减轻HCA孕母的宫内炎症,但ACS也具有免疫抑制作用。因此,在孕母和子代早产儿中都有较高的败血症风险。
3.4本研究的优势与局限
本研究的主要优势:第一,对所有早产儿的胎盘进行了常规病理组织学检查,因此与以往关于母体宫内炎症/感染的其他报道相比,HCA的定义是明确和证实的。第二,本研究只包括AGA单胎早产儿,因为在宫内发育迟缓(intrauterine growth retardation,IUGR)或SGA和多胎妊娠分娩的新生儿中,ACS的有益作用仍然存在争议[1]。以色列的一项研究表明,ACS的应用降低了SGA婴儿的死亡率和并发症的发生率,但其效果不如AGA婴儿[26]。第三,根据先前的报道将ACS的应用分为最优和次优疗程,即ACS在初始剂量应用后2~7天达最大益处[1]。当根据ACS的应用时间来评估其效果时发现,对早产儿常见并发症的有益作用在最优ACS组更为明显,但同时最佳ACS组子代早产儿败血症的发生率也增加了,因此,对孕母合并HCA且应用ACS的早产儿进行败血症相关监测是必要的。
当然,本研究也有一定的局限性:首先,这是一个仅有少量研究对象的回顾性分析;其次,本研究中未分析每组早产儿诸如神经发育等远期预后。HCA对子代脑发育的影响及ACS和HCA对神经系统远期发育结果的联合作用是利大于弊,还是弊大于利,仍存在广泛争论[27-28]。所以,为了阐明ACS对神经系统的远期效应,还应采用各种工具评估神经系统随访数据进行综合分析。
综上所述,当孕母合并HCA时,ACS的应用可降低单胎AGA早产儿重度BPD的发生率,但同时也可增加子代早产儿败血症的发生率。

