不同包衣增重对泼尼松龙磷酸钠口腔崩解片关键质量属性的影响
沈 川,沈丹丹,曾令高,程 义,许 娟
(1.重庆市綦江区人民医院,重庆 401420; 2.重庆市食品药品检验检测研究院,重庆 401121; 3.重庆市药物过程与质量控制工程技术研究中心,重庆 401121; 4.重庆仁泽医药科技有限公司,重庆 400021)
泼尼松龙磷酸钠是由默沙东有限公司在泼尼松龙基础上开发出的21-磷酸酯[1],为白色或微黄色易碎颗粒或粉末,在水中易溶,能在体内迅速、完全水解成泼尼松龙。泼尼松龙是一种以糖皮质激素性质为主的、人工合成的肾上腺皮质类固醇[2]。BioMarin公司与Cima Labs公司合作,采用掩味口腔崩解片技术(OraSolv®)研发出了泼尼松龙磷酸钠口腔崩解片(商品名为Orapred ODT®)。2006年6月1日,美国食品药物管理局(FDA)批准了Orapred ODT®上市,这是美国国内首个口腔崩解片剂型的泼尼松龙制剂。经研究证明,泼尼松龙口服溶液的耐受性优于压碎的普通片剂[3]。而相对于液体制剂,89%的患者更倾向于使用口腔崩解片[4]。日本、美国、欧洲药典均收载了泼尼松龙磷酸钠原料药,但各国药典均未收载其口腔崩解片的制剂标准。目前,本品未在国内上市销售,也无仿制药上市。袁宝清等[5]对泼尼松龙磷酸钠口腔崩解片的制备及质量评价进行了实验室研究,采用干法制粒,根据公开的处方研究资料,其未对药物颗粒进行包衣掩味处理。对于苦味极强且极易溶于水的药物,仅通过甜味剂矫味无法达到满意的顺应性。本研究中拟通过考察不同包衣增重的口腔崩解片的粒度分布情况,评价影响关键质量属性的指标,开发出与原研参比制剂Orapred ODT®规格、质量一致且口感良好的产品,并实现工业化规模生产。现报道如下。
1 仪器与试药
1.1 仪器
WBF型流化床实验机(重庆英格造粒包衣技术有限公司);WL-300型离心式制丸机(重庆市科旭制药机械设备制造有限公司);FW-400A型倾斜式高速万能粉碎机(北京中兴伟业仪器有限公司);HLSH2-6型湿法混合制粒机(中国航空工业第一集团公司北京航空制造工程研究所);DP30A型单冲压片机(北京国药龙立科技有限公司);YPD-30A型片剂硬度仪、FT-2000A型脆碎度检查仪(上海黄海药检仪器有限公司);ZRS-8G型智能溶出仪(天津市天大天发科技有限公司);1200型高效液相色谱仪(安捷伦科技有限公司);XSE204型电子天平(梅特勒公司,精度为万分之一)。
1.2 试药
泼尼松龙磷酸钠(浙江仙琚制药股份有限公司,批号为170703);蔗糖(湖南湘易康制药有限公司,批号为20170503);羟丙甲基纤维素(TheDow ChemcalCompany,批号为PD161102);甲基丙烯酸氨烷基酯共聚物E型(Rohm GmbH&Co.KG,批号为E060901196);直压甘露醇(法国罗盖特公司,批号为103420200301);甘露醇(广西南宁化学制药有限责任公司,批号为2002025);交联聚维酮(International Specialty Products Inc.,批号为0002404542);微晶纤维素(德国瑞登梅尔父子公司,批号为5610274929);碳酸氢钠(自贡鸿鹤制药有限责任公司,批号为170910);三氯蔗糖(广州科宏食品添加物有限公司,批号为181102);二氧化硅(批号为20170614),无水乙醇(批号为20161101),硬脂酸镁(批号为161017),无水枸橼酸(批号为2016121901),均购自湖南尔康制药股份有限公司;葡萄粉末香精(上海爱普香料有限公司,批号为0000277272);水为纯化水。
2 方法及结果
2.1 处方及工艺
以蔗糖浆为黏合剂,将泼尼松龙磷酸钠和蔗糖粉黏合成颗粒状载药颗粒(丸芯);以羟丙甲基纤维素作为隔离包衣材料,覆盖于载药颗粒表面;胃溶型聚丙烯酸树脂为掩味包衣材料,硬脂酸镁为抗黏剂,两者与无水乙醇组成包衣液(掩蔽不良口味);普通甘露醇和直压型甘露醇配合使用作为填充剂(既改善口感又提高流动性);微晶纤维素为填充剂(改善可压性和崩解性);超细型交联聚维酮为超级崩解剂;无水枸橼酸和碳酸氢钠共同构成泡腾剂(入口时与唾液接触产生少量二氧化碳,既促进崩解,又麻痹味蕾,辅助掩味);三氯蔗糖为甜味剂;葡萄香精为矫味剂;二氧化硅为助流剂;压片处方中的硬脂酸镁为润滑剂。
2.2 不同包衣增重粒度分布
本试验中使用了100目筛(150μm),80目筛(180μm),60目筛(250μm),50目筛(270μm)和40目筛(380μm)。取不同掩味包衣增重颗粒各约1 g,精密称定,置40目金属筛网和接收盘上扣上筛盖。水平方向振摇3min,并不时轻敲。称量截留在各筛网上和接收盘中的颗粒量。结果见表1和图1。
表1 各筛网截留掩味颗粒累积百分含量(±s,%)Tab.1 Cumulative percentage of taste masking particles retained by each screen(±s,%)

表1 各筛网截留掩味颗粒累积百分含量(±s,%)Tab.1 Cumulative percentage of taste masking particles retained by each screen(±s,%)
注:含药颗粒用50目整粒。Note:The drug-loading particles are sieved with 50 mesh sieve.
粒度<100目<80目<60目<50目<40目>40目含药颗粒15.90±1.21 36.80±2.08 73.80±5.44 99.20±6.17 100.00±5.48 0.00±0.00包衣增重20%39.30±3.06 73.40±4.11 91.70±5.95 99.10±7.22 100.00±5.29 0.00±0.00包衣增重30%38.90±4.17 70.50±4.67 90.20±5.26 98.70±8.11 99.90±5.47 0.10±0.28包衣增重40%32.60±2.18 62.30±4.26 85.60±4.17 97.90±5.46 99.90±6.21 0.10±0.15包衣增重50%27.70±2.11 62.40±3.29 86.00±4.55 97.80±6.29 100.00±5.94 0.00±0.00
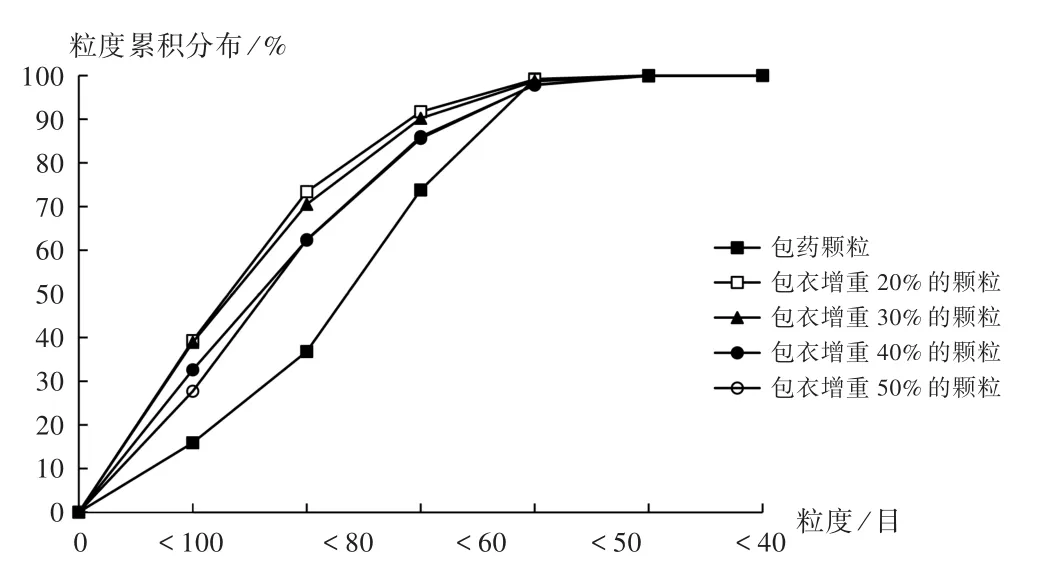
图1 50目整粒制备载药颗粒时各工艺步骤中间体粒度累积分布Fig.1 Cumulative particle size distribution of intermediates in each process during preparation of drug-loading particles sieved w ith 50 mesh sieve
2.3 微观形态比较
取少量颗粒置载玻片上,不盖盖玻片,分别在透射光路和反射光路模式下观察颗粒的轮廓和表面形态。结果自制样品与参比制剂的粒度分布和颗粒外观一致。详见图2。
2.4 溶出度比较
参比制剂在磷酸盐缓冲液中的溶出速率是4种溶出介质(纯化水、pH1.2的盐酸氯化钠溶液、pH4.5的醋酸盐缓冲液、pH6.8的磷酸盐缓冲液)中最慢的,故选择磷酸盐缓冲液区分不同包衣增重对溶出度的影响。由图3可见,包衣增重40%时,溶出曲线最相似,依据相似系数f2值判定为相似。
2.5 体外溶出曲线比较
根据日本厚生劳动省医药品食品卫生管理局2006年11月签发的《有关仿制药生物等效性试验等指导原则的一系列制订与修订事宜》[6],要求研究固体口服制剂在多种介质中的溶出曲线,并与参比制剂(已上市的原研产品)进行比较。另外,参照张继稳等[7]《口腔崩解片溶出度的质量控制方法》,也要求将多种介质(包括水和pH6.8的磷酸盐缓冲液)作为溶出曲线的考察介质。
取本品,照2015年版《中国药典(四部)》通则0931溶出度与释放度测定法(第二法),分别以水、pH1.2的盐酸氯化钠溶液、pH4.5的醋酸盐缓冲液、pH6.8的磷酸盐缓冲液500mL为溶出介质,转速为50 r/min,依法操作,经5,10,15,30,45,60min时各取溶出液10.0mL(及时补充相同温度、相同体积的溶出介质)。结果在pH1.2的盐酸氯化钠溶液中,温和的溶出条件下(桨法50 r/min)能在15min内溶出85%以上。该条件下药物吸收的限速步骤是胃排空。禁食状态下,胃滞留(排空)50%所需的平均时间为15~20min。因此,如果药物在温和溶出试验条件下、15min内在0.1mol/L的盐酸溶液中溶出85%,类似于溶液,通常应无任何生物利用度问题。在pH4.5的醋酸盐缓冲液、pH6.8的磷酸盐缓冲液和纯化水中,自制样品与参比制剂的溶出度的相似因子(f2值)大于50,符合FDA《口服固体制剂溶出度试验技术指导原则》及日本厚生劳动省医药品食品卫生管理局《仿制药生物等效性试验指导原则》对于溶出曲线相似性的判定标准,表明自制样品与参比制剂具有相似的溶出行为。详见图4。
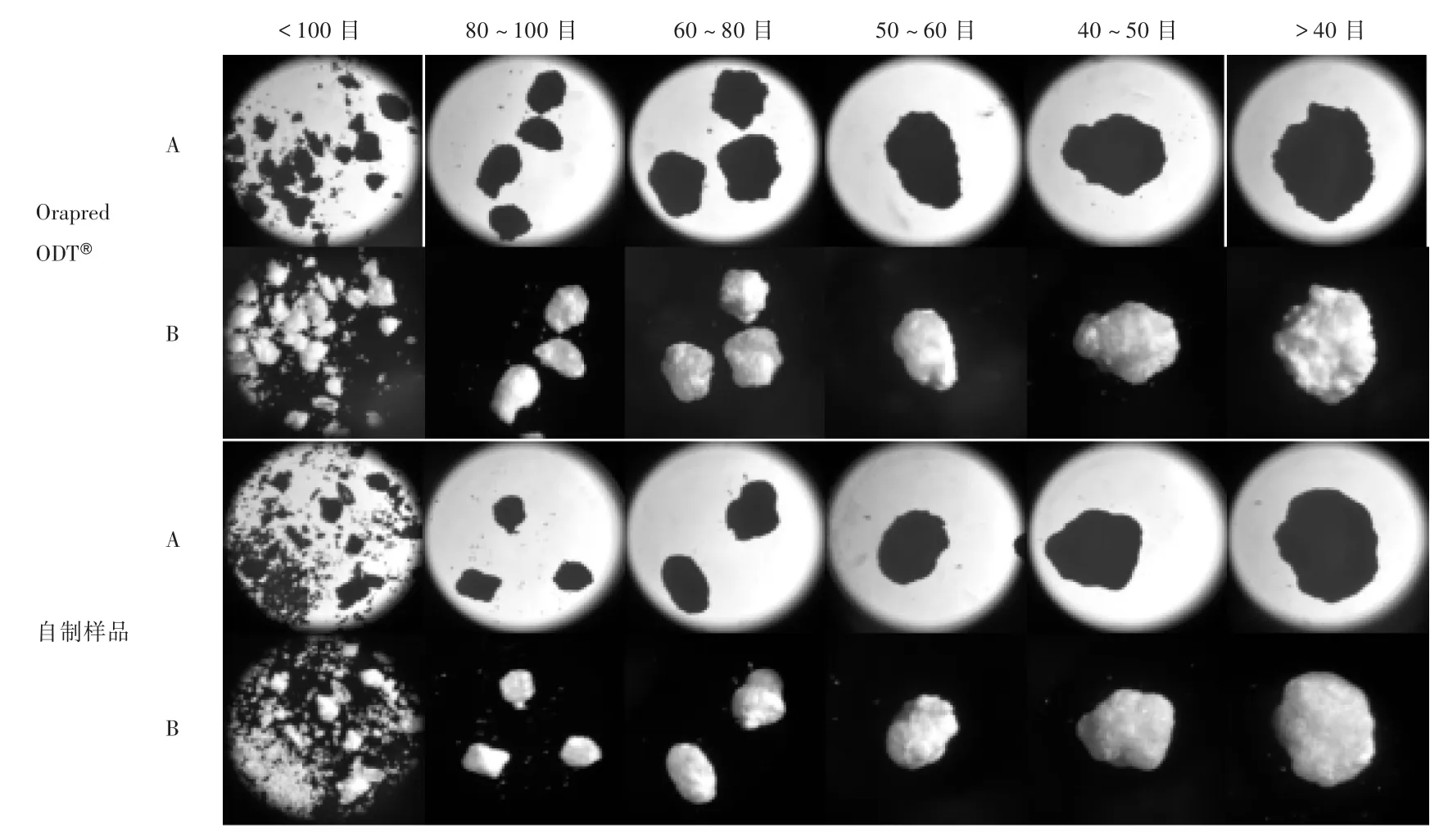
图2 自制样品与参比制剂细粉微观形态图Fig.2 M icrom orphology of self-made sam p le powder and reference p reparation powder
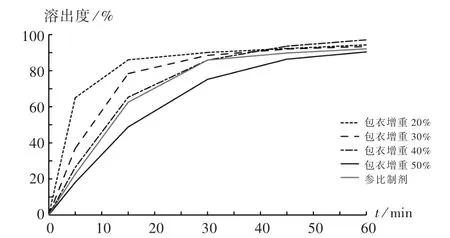
图3 不同包衣增重的自制样品与参比制的剂溶出曲线Fig.3 Dissolution profiles of self-made sam p les w ith different coating weight gains and reference p reparation
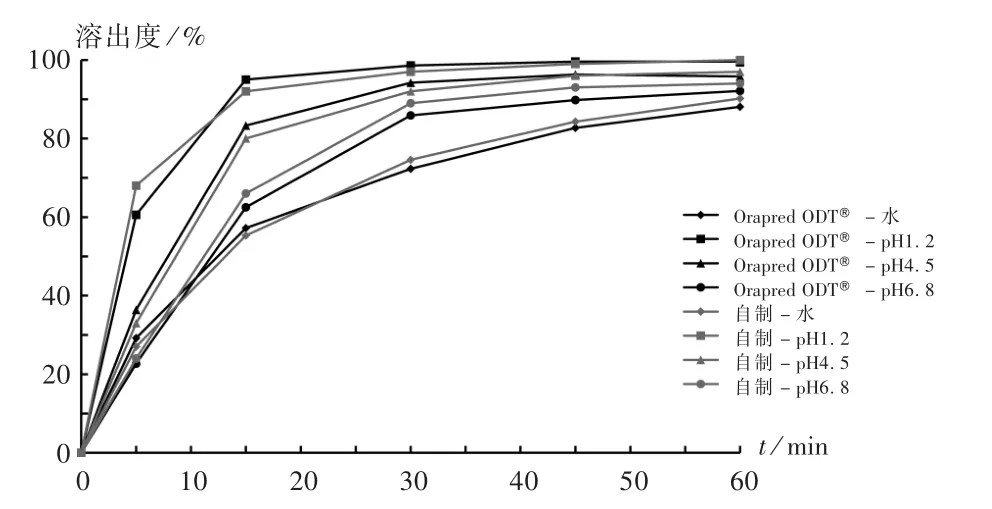
图4 自制样品与参比制剂在4种溶出介质中的溶出曲线Fig.4 Dissolution profiles of self-made sam p les and reference p reparation in four dissolutionmedium s
2.6 体外崩解试验
使用模拟润湿检测(SWT)法测定泼尼松龙磷酸钠口腔崩解片的润湿时间。将Whatman滤纸盘(直径为21mm)放入苯乙烯培养板的孔内(直径为22mm),加入一定体积0.1%(m/m)着色溶液,取本品1片,置孔内已润湿的纸盘表面上,使片剂表面与滤纸接触,染料溶液的水平面不能超过片剂,记录润湿时间。由于口腔崩解片辅料本身具有层析效果,导致溶剂前沿不与色素线吻合,故以口腔崩解片中心隆起并出现龟裂现象的时间作为模拟崩解时间。结果3个规格Orapred ODT®的崩解时间分别为(51±1.17)s(30mg∶570 mg)、(45±1.05)s(15mg∶285 mg)和(42±1.03)s(10 mg∶190mg),自制口腔崩解片的平均崩解时间分别为43 s(30 mg∶570 mg)、38 s(15 mg∶285 mg)、34 s(10 mg∶190mg),表明本课题组研发的泼尼松龙口腔崩解片在崩解性能方面与国外上市产品相当或更优。详见表2和图5。

表2 不同规格泼尼松龙磷酸钠口腔崩解片体外崩解时间比较Tab.2 Com parison of in vitro disintegration time of different specifications of Prednisolone Sodium Phosphate Orally Disintegrating Tablets
3 讨论
口腔崩解片是一种新型固体速释与速效制剂,具有服用方便、口感好、起效速度快、生物利用度高等特点,成为继咀嚼片和分散片后片剂研究与开发的热点[8]。针对载药量低、硬度小、口感差的问题,目前报道了控制口腔崩解片载药量与改善口感的制剂新技术,包括直接压片法、湿法制粒压片法、3D打印技术、包合物技术、固体分散体技术等[9-11],但制备工艺较复杂,部分制备工艺还处于实验室研发阶段,将其运用于实际生产仍需大量研究。
泼尼松龙磷酸钠为极苦且极易溶于水的药物,故本研究的难点是如何改善口感。用空白丸芯(蔗糖丸芯或微晶纤维素丸芯)载药工艺制成的掩味包衣颗粒受限于空白丸芯的粒径,沙砾感明显,且由于空白丸芯多为挤出工艺制成,质地坚硬,进一步增强了在口腔内的磨砂感觉。由于掩味颗粒质地坚硬,在压片过程中可能会造成包衣衣膜破裂,故空白丸芯载药工艺制成的口腔崩解片苦味更强烈。离心制粒工艺能使药物镶嵌于丸芯中,载药颗粒表面的药物量减少,更易于包衣掩蔽苦味;且有可能制成更小粒径的颗粒,从而降低沙砾感。因此,选择离心制粒工艺和聚丙烯酸树脂包衣工艺,可同时制备泼尼松龙磷酸钠掩味包衣颗粒。
本研究中通过包衣技术达到掩味效果,以提高患者的顺应性,通过微观形态、溶出试验、体外崩解试验等关键质量属性指标对自制样品与参比制剂进行比较和评价,结果显示,该处方工艺条件下制备的自制样品与参比制剂质量一致。目前,本剂型尚未在国内上市销售,开发本品对于填补国内药品品种空白,改善患者(尤其是儿童患者)的用药依从性都有十分重要的意义。

图5 波尼松龙磷酸钠口腔崩解片体外崩解图像(规格/片剂/批号)Fig.5 InvitrodisintegrationimageofPrednisoloneSodium PhosphateOrallyDisintegratingTablets(specification/tablet/batchnumber)

