复方芩兰口服液调控流感病毒感染致重症肺炎动物模型免疫功能的机制研究
郭 清,王 龙,黄 猛,李 允
高州市人民医院呼吸与危重症医学科,广东 高州525200
流感病毒感染后会激活免疫反应,适度的炎症反应被激活可能有利于病毒清除[1],然而,过度激活的炎症反应可能对宿主造成有害影响,如造成重症肺炎(severe pneumonia,SP)[2]。研究显示,感染流感病毒后,具有促炎作用的T辅助细胞17(T helper cells 17,Th17)会增加,而具有抗炎作用的调节T细胞(regulatory T cells,Treg)则会减少,并且随着病情的加重,Th17/Treg的水平也会升高[3]。而Th17和Treg的分化受到核因子κB(nuclear factor-κB,NF-κB)通路的调控,会激活NF-κB通路,从而使Th17/Treg平衡向Th17偏移,引起促炎因子白细胞介素17(interleukin 17,IL-17)等的分泌,导致肺组织损伤[4-5]。近年来,中药在治疗流感和SP中取得了良好的临床疗效。复方芩兰口服液具有清热解毒的作用。最新研究[6]证实,其对感染性肺损伤具有较好的治疗作用,但是药物的调控机制尚不清楚。本研究通过动物实验,主要基于NF-κB通路探讨复方芩兰口服液对流感病毒感染致SP小鼠炎性因子及免疫功能的影响。
1 材料与方法
1.1 毒株与动物H1N1毒株(PR8)(美国典型培养物保藏中心,批号:HCoV-229E);BALB/c小鼠,雌性,共60只,8~12周龄,由上海斯莱克实验动物中心提供,实验动物合格证号:SCXK(京)2018-002。饲养条件:ABSL-2生物安全实验室,温度22~26℃,日温差≤4℃,湿度40%~70%,喂食小鼠维持饲料,自由饮水、摄食。
1.2 试药及仪器复方芩兰口服液(黑龙江珍宝岛药业股份有限公司,国药准字Z20026049,规格:10 mL/支);HE试剂盒(碧云天公司);Trizol试剂(美国Invitrogen公司,批号:257403);逆转录cDNA试剂盒、SYBR Green PCR Master Mix qPCR试剂盒(瑞士Roche公司,批号:04897030001);RIPA裂解缓冲液(Beyotime,批号:P0013K);BCA试剂盒(武汉博斯特生物技术有限公司,批号:266117);anti-NF-κB和anti-RelB(Abcam公 司,批 号:HK5704);PVDF膜(Bio-Rad公司,批号:AMM05633 G);ELISA试剂盒(碧云天公司,批号:S0026B);小鼠Treg/Th17表型抗体试剂(Becton Dickinson公司,批号:AM00401)。显微镜(Olympus公司);流式细胞仪(Becton Dickinson公司);免疫磁珠(Invitrogen公司);匀 浆 机(Thermo Fisher Scientific公司)。
1.3 动物处理将60只小鼠分为对照组、模型组和观察组,每组20只。模型组和观察组根据参考文献[7]构建流感病毒感染的SP模型。使用80 μg/kg的氯胺酮和10 μg/kg的甲苯噻嗪麻醉小鼠,通过气管内递送50 μL的H1N1,H1N1滴度为100 LD50。对照组小鼠滴入等量的溶剂。在滴入H1N1第二天观察组使用复方芩兰口服液灌胃[8],根据人体口服复方芩兰口服液的剂量,利用人和小鼠体质量换算方法,计算得到复方芩兰口服液的干预剂量为22 mL/kg,每日1次,连续7天。其他两组小鼠使用等量的生理盐水灌胃。干预后模型组共有2只小鼠死亡,而对照组和观察组随机在20只小鼠中选择18只采集样本进行后续研究。通过眼眶取血获得血液样本,小鼠经过颈脱臼处死。本次研究的动物实验经过伦理委员会批准。
1.4 观察指标
1.4.1 肺指数及HE染色检测肺组织损伤小鼠处死前称质量,处死后取出肺组织,擦干表面组织液后称质量。首先计算肺指数(全肺质量与体质量之比×100%)。在室温下用4%多聚甲醛中固定过夜,然后室温下通过梯度浓度的乙醇(80%持续2 h,90%持续2 h,95%过夜,100%分别持续0.5、0.5、1.0 h处理后包埋在石蜡中。然后将石蜡包埋的样品切成4 µm的切片,用Mayer´s苏木室温下精染色10 min,洗去染色液后加入0.5%曙红水溶液室温下染色3 min。细胞核和其他酸性结构被染成蓝色,而细胞质被染成红色。使用光学显微镜观察。
1.4.2 ELISA检测炎性因子水平将血液样本以离心半径:15 cm,2000 r/min离心20 min收集上层清液,根据试剂盒说明书分别加入抗体和显色剂,然后通过酶标仪检测450 nm处吸光度,然后根据标准曲线计算白细胞介素1β(interlenkin-1β,IL-1β)、白细胞介素6(interlenkin-6,IL-6)、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)的浓度。
1.4.3 流式细胞术检测Th17/Treg将脾脏中细胞经过密度梯度离心分离淋巴细胞,将淋巴细胞悬浮液重悬,加入20 μL预冷的1×BD Mouse Foxp3缓冲液在黑暗、4℃的条件下固定30 min。洗去固定液离心并收集细胞。在细胞中加入200 μL通透缓冲液,并将细胞在37℃下避光孵育30 min。洗涤后加入20 μL的小鼠Treg/Th17表型抗体试剂或对照抗体在室温下孵育30 min。然后将抗体清洗干净后,将细胞重悬并通过FACS Calibur流式细胞仪进行分析Th17和Treg的百分比。
1.4.4 qPCR检测mRNA小鼠处死后收集脾组织,通过qPCR检测Th17转录因子RORγt mRNA和Treg转录因子FOXP3 mRNA的水平,以及NF-κB通路中关键基因NF-κB、RelB mRNA的水平。通过TRIzol获得总mRNA,分别通过PrimeScript-RT和SYBR Premix Ex Taq试剂盒进行反转录(37℃/15 min,85℃/5s)和qPCR(95℃/5 min,95℃/30 s/40个循环,65℃/45 s)。GAPDH作为内源参照。通过qPCR分析mRNA的相对表达水平。
1.4.5 Western blot检测蛋白根据文献[9]将脾组织裂解为单个细胞,中细胞通过密度梯度离心法分离单个核细胞,使用免疫磁珠分离淋巴细胞。将淋巴细胞匀浆后萃取总蛋白,蛋白浓度通过BCA试剂盒测量。分别取总量为30 μg的总蛋白使用10%的聚丙烯酰胺凝胶进行电泳(80~120 V,90 min)。在100 mV的恒定电压下与PVDF膜进行湿转移。在5%牛血清白蛋白中于室温孵育1 h。加入anti-NF-κB和anti-RelB添加到分离的蛋白质中,并在4℃下孵育过夜,洗涤后在室温下添加二抗孵育1 h,然后加入化学发光试剂进行显影,GAPDH作内部参考,用Image J软件分析目标条带的灰度值。
1.5 统计学方法所有数据使用SPSS 19.0软件,计量数据以表示,多组间比较进行单因素方差分析,两两比较使用SNK-q检验,P<0.05表示差异有统计学意义。
2 结果
2.1 小鼠肺指数肺指数模型组为(16.95±1.47)mg/g,观察组为(11.20±1.45)mg/g,均高于对照组(7.02±0.94)mg/g;模型组、观察组均高于对照组(P<0.05),模型组高于观察组(P<0.05)。
2.2 小鼠肺组织损伤程度对照组肺组织一切正常。模型组肺组织出现广泛的肺部损伤,包括毛细支气管上皮细胞脱落,并有明显的出血和炎性浸润,肺泡结构基本丧失。与模型组比较,观察组炎性反应等情况明显缓解,可观察到基本的肺泡结构。见图1。
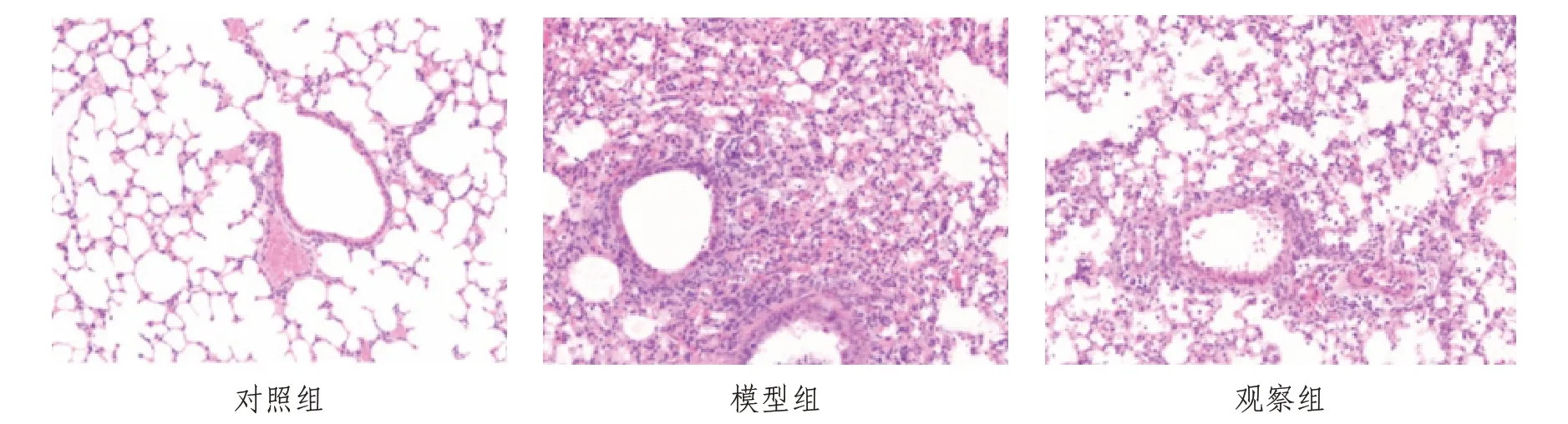
图1 各组小鼠肺损伤组织程度病理表现(HE×200)
2.3 小鼠Th17/Treg水平模型组Th17和Th17/Treg显著高于对照组(P<0.05),而Treg显著低于对照组(P<0.05);观察组Th17和Th17/Treg显著低于模型组(P<0.05),而Treg显著高于模型组(P<0.05)。见表1。
表1 各组小鼠Th17/Treg水平比较()

表1 各组小鼠Th17/Treg水平比较()
注:*表示与对照组比较,P<0.05;#表示模型组比较,P<0.05
Th17/Treg 0.67±0.75*#0.29±0.35 1.63±0.21*组别观察组对照组模型组鼠数18 18 18 Th17(%)5.23±0.75*#2.80±0.38 7.14±0.94*Treg(%)7.79±1.01*#9.52±0.92 4.38±0.64*
2.4 小鼠IL-1β、IL-6、TNF-α水平IL-1β、IL-6、TNF-α水平模型组、观察组显著高于对照组(P<0.05),观察组显著低于模型组(P<0.05)。见表2。
表2 各组小鼠炎性因子水平比较() pg/mL

表2 各组小鼠炎性因子水平比较() pg/mL
注:*表示与对照组比较,P<0.05;#表示模型组比较,P<0.05
TNF-α 83.31±10.42*#61.58±4.23 124.66±11.39*组别观察组对照组模型组鼠数18 18 18 IL-1β 55.03±6.72*#43.62±4.29 75.48±8.35*IL-6 60.24±8.45*#40.82±4.56 84.56±9.57*
2.5 小鼠RORγt、FOXP3 mRNA,NF-κB、RelB mRNA及蛋白表达与对照组比较,模型组、观察组RORγt mRNA,NF-κB、RelB mRNA及蛋白水平均高于对照组(P<0.05),FOXP3 mRNA水平低于对照组(P<0.05);观察组RORγt、NF-κB、RelB mRNA及蛋白水平显著低于模型组(P<0.05),FOXP3 mRNA水平高于模型组(P<0.05)。见表3。
表3 各组小鼠脾组织中RORγt、FOXP3 mRNA及NF-κB、RelB mRNA和蛋白水平比较()

表3 各组小鼠脾组织中RORγt、FOXP3 mRNA及NF-κB、RelB mRNA和蛋白水平比较()
注:*表示与对照组比较,P<0.05;#表示模型组比较,P<0.05
组别观察组对照组模型组RelB 1.52±0.15*#0.82±0.08 3.04±0.27*鼠数18 18 18 RORγt mRNA 4.02±0.41*#2.34±0.21 6.85±0.65*FOXP3 mRNA 3.35±0.35#3.46±0.31 1.23±0.13*NF-κB mRNA 2.79±0.30*#1.38±0.14 5.24±0.51*RelB mRNA 3.02±0.31*#1.22±0.12 5.16±0.49*NF-κB 1.20±0.13*#0.76±0.08 2.98±0.27*
3 讨论
由H1N1等病毒感染引发的流感是世界范围内的卫生问题,会引起大流行性急性呼吸道疾病。一些严重的患者可能会发展为急性肺损伤,甚至出现急性呼吸窘迫综合征,这是感染了H1N1的患者最常见的死亡原因[10]。研究表明,许多传统中药具有免疫调节、抗炎、抗病毒和抗氧化活性。临床试验也评估了中医中药在治疗H1N1引起的SP中的潜在益处。使用中药治疗H1N1引起的SP是一种有前景的治疗方法。
复方芩兰口服液,具有辛凉解表之功效,研究已经证实其对冠状病毒肺炎有治疗作用[11]。本研究通过H1N1感染构建SP小鼠模型,并通过HE染色验证了建模结果,建模后使用复方芩兰口服液灌胃小鼠,结果显示干预后小鼠的肺指数和肺损伤程度得到了显著的缓解,并且可以明显地抑制血清炎性细胞因子的水平。
复方芩兰口服液由金银花、黄芩、连翘、板蓝根等药物组成,研究显示金银花不但具有抗病毒的作用[12],还可以直接抑制氧化应激引起的炎性反应[13]。以黄芩、连翘为主要成分的中药均可以明显地缓解感染造成的肺损伤[14]。现代中药药理学分析表明,连翘和板蓝根在呼吸道病毒感染的治疗中具有重要作用[15]。这提示对于H1N1感染引起的SP小鼠,复方芩兰口服液可以显著地缓解炎性反应,并保护肺组织。
在病毒感染的早期通常不给予抗病毒药物,而宿主免疫反应是治疗流感的重要手段,病毒会激活机体的细胞免疫,轻微的炎性反应有助于宿主对病毒的吞噬和清除。若发生大量病毒感染,则会引起过度的炎性反应,激活并引起“细胞因子风暴”,这不但会直接引起肺组织的损伤,引起炎性浸润[16]。Th17/Treg的失衡在过度炎性反应中发挥重要作用。研究显示,病毒感染会直接激活NF-κB通路,而NF-κB通路的激活会促进淋巴细胞向Th17分化并抑制向Treg分化,诱导Th17分泌大量的促炎因子加剧肺损伤[10]。
本研究结果显示,复方芩兰口服液可以显著抑制Th17水平并促进Treg的分化,使Th17/Treg向Treg偏移。此外,复方芩兰口服液也会明显抑制淋巴细胞中NF-κB通路中NF-κB和RelB mRNA和蛋白的表达水平。有研究[17]显示,金银花提取物具有抗氧化和抗炎活性,从而保护胃黏膜。研究表明,复方芩兰口服液中活性物质具有调控NF-κB信号的作用;金银花提取物可以通过抑制BV-2小胶质细胞中的NF-κB信号传导,从而抑制脂多糖刺激的炎症反应[18]。而黄芩活性物质不但可以抑制肺泡上皮细胞中的NF-κB通路,缓解LPS诱导的促炎反应[19-20],还可以调控过敏性哮喘小鼠Th17/Treg的平衡,缓解肺部症状[21]。这提示复方芩兰口服液中的活性物质可以通过抑制NF-κB通路并调节RORγt和FOXP3的转录水平,进而调控淋巴细胞分化,使Th17/Treg平衡向Treg偏移,进而抑制免疫炎性反应,缓解肺损伤。
综上所述,复方芩兰口服液可以通过抑制NF-кB通路诱导Treg而抑制Th17,从而调节免疫炎性反应,缓解由流感病毒引起的SP。关于复方芩兰口服液治疗流感病毒引起的SP仍需要临床实验证实,其中的有效化合物和作用机制值得深入探究。

