痛泻要方破壁饮片对腹泻型肠易激综合征模型大鼠肠推进及血管活性肠肽含量的影响*
胡 莹,郑依玲,梅全喜,彭伟文,宋 叶
(1.广东省中山市中医院,广东 中山 528400;2.广东省广州市中西医结合医院,广东 广州 510800;3.广东省深圳市宝安纯中医治疗医院,广东 深圳 518101)
肠易激综合征(IBS)为功能性肠道疾病[1],临床表 现为腹胀、腹泻、腹痛及排便习惯改变等症状,临床分型有便秘型(IBS-C)、腹泻型(IBS-D)、混合型(IBS-M)及不定型(IBS-U),我国以 IBS-D发病率最高[2]。IBS-D的发病机制尚不明确,可能与肠动力异常、内脏敏感、肠道通透性增加及“脑肠轴”功能失调等因素相关[3]。现代疗法常以脱敏、解痉为主,治疗过程较长,需长期服药,停药后易复发,严重影响患者的生活质量。痛泻要方出自《丹溪心法》[4],由炒白术、炒白芍、炒陈皮和防风4味中药组方,为治疗脾虚泄泻的传统方剂,临床常用于治疗IBS-D,疗效良好[5]。本研究中探讨了痛泻要方破壁饮片的药效作用,为临床应用破壁中药饮片提供理论依据。现报道如下。
1 材料与方法
1.1 仪器、试药与动物
仪器:MultisKan FC型酶标仪、洗板机(美国Thermo Scientific公司);电热恒温水浴锅(上海横平仪器仪表厂);JY 92-IIN型超声波细胞粉碎机(宁波新芝生物科技股份有限公司,功率为65 W,频率为20~25 kHz);超微粉碎匀浆机(德国Fluko公司);TD25-WS型48孔多管架自动平衡离心机(长沙湘仪离心机仪器有限公司);TS-8型摇床(海门市其林贝尔仪器制造有限公司);移液枪(德国Eppendorf公司);自动程控烘箱(杭州卓驰仪器有限公司)。
试药:痛泻要方破壁饮片(中山市中智药业集团有限公司,批号为20160130);匹维溴铵片(商品名得舒特,法国 Abbott Healthcare SAS公司,批号为642647);BCA蛋白浓度测定试剂盒(批号为78100150),RIPA裂解液(强)(批号为74k00153),均来源于北京鼎国昌盛生物技术有限责任公司;Rat血管活性肠肽(VIP)酶联免疫吸附试验(ELISA)KIT 96T试剂盒(上海酶联生物科技有限公司,批号为05/2017);水合氯醛(上海展云化工有限公司,批号为161115)。
动物:SPF级 SD大鼠 94 只,雄性,体质量(200±20)g,购于山东省医学实验动物中心,动物生产许可证号为SCXK(鲁)20140007,饲养于广东省中山市中医院屏障级实验室,实验室动物使用许可证号为SYXK(粤)2015-0109。实验室 12 h昼夜交替,室内恒温(22±2)℃,相对湿度40% ~70%,统一适应性喂养1周。
1.2 方法
药液制备:称取适量痛泻要方破壁饮片,用90℃水充分溶解,混匀,配制成痛泻要方破壁饮片低、中、高剂量溶液,浓度分别为 1.015g/kg(临床 1/4 量)、2.030 g/kg(临床 1/2 量)、4.060 g/kg(临床 1 倍量),放凉,置 4 ℃冰箱保存,待用。取匹维溴铵片碾碎,用蒸馏水溶解,配制成质量浓度为0.018 g/kg的阳性对照药液,置4℃冰箱保存,待用。
IBS-D动物模型建立:采用改良慢性束缚刺激法[6]建立IBS-D动物模型。随机挑选8只SD大鼠作为正常组,其余大鼠全部参与造模。造模大鼠每日于固定时间捆绑束缚3 h,再随机选择另一种复合刺激方式补充刺激。复合刺激方式包括昼夜颠倒12 h/12 h,禁食24 h,强迫游泳 30 min,禁饮 24 h,悬尾 1 h,孤养 12 h,饮糖水24 h。每种方法随机重复2~3次,大鼠连续刺激造模21 d,造模期间观察大鼠的体质量、行为活动、饮食饮水等变化。
动物分组及给药:将造模大鼠随机分为6组,分别为模型组,匹维溴铵组,痛泻要方破壁饮片低、中、高剂量组。各组大鼠于造模后第7天开始灌胃给药,连续21 d,每天1次,正常组及模型组灌胃等体积蒸馏水。
样本采集:试验结束前1 d,所有动物均禁食不禁饮18 h,并于末次灌胃给药后将大鼠置代谢笼内1 h收集粪便,腹腔注射10%水合氯醛(0.35 mL/100 g)麻醉大鼠,待翻正反射消失后迅速打开腹腔采集腹主动脉血;同时取出大鼠远端结肠组织并分为2段,分别置液氮及4%多聚甲醛中储存;最后打开大鼠头骨,取出大脑组织,将其分为2份,分别置液氮及4%多聚甲醛储存。将液氮中的结肠组织、脑组织标本随后移入-80℃冰箱中保存。
1.3 观察指标
体质量:造模期间注意观察动物的状态、毛色及饮食饮水状态,并记录试验期间大鼠第 1,7,14,21,28天体质量变化情况。
排便情况:观察大鼠第 1,7,14,21,28 天的排便情况,于代谢笼中收集大便,按照Bristol评分系统[7]评估,并记录大鼠排便粒数。详见表1。

表1 Bristol大便分级评分标准Tab.1 Bristol classification and scoring criteria
小肠推进率:大鼠末次灌胃给药后1 h,每只大鼠灌胃自制营养糊(活性炭与奶粉比例为1∶5,m/m)2 mL,待肠蠕动30 min后将大鼠依据灌胃营养糊先后顺序处死,取出小肠,用直尺测量小肠全长及营养糊推进长度,并计算小肠推进率,小肠推进率(%)=(推进长度/小肠全长)×100%。
血清、结肠及脑组织中VIP含量(ELISA法):血浆于4℃条件下静置2 h,3 000 r/min离心10 min,取上清液,按ELISA试剂盒步骤测定血清中VIP含量。将结肠组织从-80℃冰箱中取出,室温解冻,用磷酸盐缓冲液(PBS)洗净,滤纸吸干多余液体,用眼科剪剪碎,并加入裂解液,用超声波细胞粉碎机粉碎10 s,再用手持式超微粉碎匀浆仪进一步粉碎(以上步骤均在冰浴条件下完成),匀浆液于12 000 r/min离心20 min,取匀浆上清液进行蛋白定量,并按ELISA试剂盒步骤测定VIP含量。将脑组织从-80℃冰箱中取出,于室温解冻,取出脑组织,匀浆制作及测定步骤与结肠组织相同。
结肠、大脑组织形态学:将取出的大鼠结肠组织及脑组织放入10%多聚甲醛中固定,常规脱水,石蜡包埋,切片,苏木精-伊红(HE)染色,于光学显微镜下观察。
1.4 统计学处理
2 结果
2.1 体质量变化
与正常组比较,模型组大鼠造模后体质量下降明显,第 7天体质量最低(P <0.05),第 14,21,28 天体质量缓慢回升,但仍处于较低水平(P<0.05)。与模型组比较,第7天,各给药组大鼠体质量均上升,差异无统计学意义(P>0.05);第21,28天,各给药组大鼠体质量回升明显(P<0.05),破壁饮片高剂量组效果较好,结果与匹维溴铵组最接近。详见表2。
2.2 排便情况
与正常组比较,模型组大鼠粪便Bristol评分显著升高(P<0.05),造模后大鼠大便性状改变明显,形状不规则多呈糊状,或排稀便、水便。与模型组比较,造模第7天各给药组大鼠Bristol评分差异无统计学意义(P>0.05);造模第14,21,28天各给药组大鼠随着给药时间的延长,大便性状逐渐改善,粪便Bristol评分逐渐回落,各给药组评分第28天最低(P<0.05)。详见表3。
与正常组比较,模型组大鼠排便数量于造模后第7天急剧升高(P <0.05),第 14,21,28天均维持在较高数量(P<0.05)。与模型组比较,破壁饮片各剂量组大鼠造模第7天排便数量均大幅度增加,差异无统计学意义(P>0.05);随着给药时间的延长,各给药组第14,21,28天排便粒数逐渐减少(P<0.05),第28天各组大鼠排便数量最少,其中破壁饮片高剂量组效果与匹维溴铵组接近,呈浓度依赖性。详见表4。
表2 各组大鼠体质量比较(±s,g,n=8)Tab.2 Comparison of body mass of rats in each group(±s,g,n=8)
表2 各组大鼠体质量比较(±s,g,n=8)Tab.2 Comparison of body mass of rats in each group(±s,g,n=8)
注:与模型组比较,*P<0.05;与正常组比较,#P<0.05。下表同。Note:Compared with those in the model group,*P < 0.05;compared with those in the normal group,#P < 0.05;as well as the following tables.
组别正常组模型组匹维溴铵组破壁饮片 低剂量组中剂量组高剂量组剂量(g/kg)0.018 1.015 2.03 4.06第1天236.00±2.83 237.60±3.66 240.73±4.76 237.78±3.88 233.69±5.21 233.33±3.30第7天239.25±5.34*216.40±2.55#219.09±6.20 217.80±3.79 218.22±5.89 216.73±4.90第14天252.13±4.61 220.40±8.50#235.82±4.94*227.30±7.32 223.89±5.46 230.00±4.56*第21天261.88±3.13 225.00±3.89#245.27±5.18*238.20±7.69*236.33±5.15*242.73±4.98*第28天277.13±3.27 227.80±3.94#250.55±5.16*243.10±4.51*241.22±4.66*248.36±3.98*
表3 各组大鼠粪便Bristol评分比较(±s,分,n=8)Tab.3 Comparison of Bristol scores in feces of rats in each group(±s,point,n=8)

表3 各组大鼠粪便Bristol评分比较(±s,分,n=8)Tab.3 Comparison of Bristol scores in feces of rats in each group(±s,point,n=8)
组别正常组模型组匹维溴铵组破壁饮片 低剂量组中剂量组高剂量组剂量(g/kg)0.018 1.015 2.03 4.06第1天3.33±0.50 3.30±0.48 3.50±0.52 3.40±0.52 3.45±0.52 3.42±0.52第7天3.33±0.50 5.00±0.67#4.67±0.78 4.90±0.88 5.18±0.75 4.92±0.79第14天3.33±0.50 6.10±0.74#4.75±0.75*5.50±0.53 5.27±0.47*5.00±0.60*第21天3.33±0.50*6.50±0.53#4.67±0.65*5.30±0.48*5.18±0.40*4.92±0.51*第28天3.33±0.50*6.70±0.48#4.42±0.67*4.90±0.74*4.82±0.60*4.67±0.65*
表4 各组大鼠排便粒数比较(±s,粒,n=8)Tab.4 Comparison of fecal pellets of rats in each group(±s,pellet,n=8)

表4 各组大鼠排便粒数比较(±s,粒,n=8)Tab.4 Comparison of fecal pellets of rats in each group(±s,pellet,n=8)
组别正常组模型组匹维溴铵组破壁饮片 低剂量组中剂量组高剂量组剂量(g/kg)0.018 1.015 2.03 4.06第1天9.88±2.36 9.10±2.02 8.42±2.02 8.50±2.17 8.55±1.97 9.67±2.39第7天9.50±1.85*33.30±3.34#31.67±2.77 34.30±2.50 33.36±2.29 32.25±2.22第14天9.50±1.60*38.90±1.91#26.83±2.21*30.20±2.78*30.64±1.80*29.92±3.18*第21天9.25±1.67*41.70±2.31#23.92±2.35*27.10±3.48*25.36±3.35*26.58±3.11*第28天9.38±1.60*41.60±3.20#18.92±2.54*24.00±2.26*22.73±1.68*21.17±2.72*
2.3 小肠推进率
与正常组比较,模型组大鼠小肠推进长度明显延长,小肠推进率大幅度提高(P<0.05)。与模型组比较,破壁饮片各剂量组大鼠小肠推进长度缩短,小肠推进率下降(P <0.05)。详见表 5。
表5 各组大鼠小肠推进率比较(±s,n=8)Tab.5 Comparison of small intestinal propulsion rate in each group(±s,n=8)

表5 各组大鼠小肠推进率比较(±s,n=8)Tab.5 Comparison of small intestinal propulsion rate in each group(±s,n=8)
组别正常组模型组匹维溴铵组破壁饮片 低剂量组中剂量组高剂量组剂量(g/kg)0.018 1.015 2.03 4.06小肠长度(cm)105.88±6.58 103.75±4.65 106.50±5.21 103.38±5.73 102.88±4.85 102.50±5.01推进长度(cm)57.13±5.17*82.38±3.54#61.63±6.97*77.13±4.16 75.13±6.38 69.00±6.00*小肠推进率(%)53.96±3.71*79.43±2.17#57.75±4.46*74.75±4.96 73.05±5.53*67.28±4.27*
2.4 血清、结肠及脑组织中VIP含量
与正常组比较,模型组大鼠血清、结肠及下丘脑VIP含量显著下降(P<0.05)。与模型组比较,破壁饮片各剂量组大鼠血清、结肠及下丘脑中VIP含量显著上升(P <0.05)。详见表 6。
表6 各组大鼠血清、结肠及下丘脑VIP水平比较(±s,pg/mL,n=8)Tab.6 Comparison of VIP level in serum,colon and hypothalamus of rats(±s,pg/mL,n=8)

表6 各组大鼠血清、结肠及下丘脑VIP水平比较(±s,pg/mL,n=8)Tab.6 Comparison of VIP level in serum,colon and hypothalamus of rats(±s,pg/mL,n=8)
组别 剂量(g/kg)VIP正常组模型组匹维溴铵组破壁饮片 低剂量组中剂量组高剂量组0.018 1.015 2.03 4.06血清153.79±40.26*84.59±10.16#143.75±17.09*103.44±16.49 144.96±18.08*143.94±20.61*结肠241.40±21.81*118.13±24.07#220.21±23.18*151.06±30.63 177.62±23.24*208.29±17.41*脑组织248.57±18.67*139.32±13.34#221.38±9.35*135.41±12.07 181.22±14.57*207.81±15.35*
2.5 结肠、大脑组织形态学
结肠病理切片结果:正常组大鼠肠黏膜上皮细胞排列规则整齐,上皮细胞未见坏死脱落,黏膜层未见炎性细胞浸润,固有层腺体未见萎缩减少,黏膜下层血管未见充血水肿,肌层未见萎缩溶解性改变。与正常组比较,模型组大鼠肠黏膜层上皮细胞有坏死脱落,黏膜结构轻微破坏,固有层中可见少量炎性细胞浸润,腺体未见明显萎缩,黏膜下层和肌层未见明显病理改变。与模型组比较,破壁饮片低、中、高剂量组大鼠的肠黏膜上皮细胞排列规则整齐,未见坏死脱落细胞及明显炎性细胞浸润,固有层中腺体未见萎缩及减少,黏膜下层及肌层未见明显病理改变;匹维溴铵组除肠黏膜可见个别上皮细胞坏死脱落,其余均未见明显病理改变。详见图1。
大脑病理切片结果:正常组大鼠海马细胞排列密集,中枢神经纤维未见扭曲及萎缩性改变。与正常组比较,模型组大鼠海马颗粒层神经元细胞核发生明显固缩,神经纤维变得短粗、扭曲。与模型组比较,破壁饮片低、中剂量组大鼠脑海马神经元细胞发生固缩,细胞层数减少、稀疏,神经纤维短粗、扭曲,稀疏变淡;而破壁饮片高剂量组大鼠海马颗粒层神经元细胞排列紧密,未见神经元细胞核发生固缩,神经纤维排列密集未见扭曲、萎缩等改变。详见图2。
3 讨论
IBS是一种反复发作、肠道功能紊乱的慢性疾病[1],病程绵延反复,严重影响患者的生活质量。IBS-D属中医“泄泻”范畴。中医认为,人体内肝主疏泄,善调气机,喜条达而恶抑郁;脾主受纳,善运化水谷精微,如肝气郁结而犯脾土,肝脾失调,则影响脾运化水谷,脾运失常导致消化不良,易出现腹胀、腹泻、腹痛及情志失调、焦虑等症状,与IBS-D病机相似。痛泻要方出自朱丹溪的《丹溪心法》[4],乃治疗肝郁脾虚痛泻之良方,现代临床常用于治疗IBS-D[8]。
本研究结果显示,与模型组比较,痛泻要方破壁饮片各剂量组可有效控制IBS-D大鼠体质量下降,通过减少大便次数及稀便情况缓解腹泻症状,还可减慢肠蠕动,降低肠道推进率,同时刺激IBS-D大鼠肠道分泌VIP,抑制肠道运动过速。表明痛泻要方破壁饮片对IBS-D有较好疗效,其中破壁饮片高剂量组效果最好,优于破壁饮片低、中剂量组。

A.正常组 B.模型组 C.匹维溴铵组 D.破壁饮片低剂量组 E.破壁饮片中剂量组 F.破壁饮片高剂量组图1 各组大鼠结肠组织病理切片(HE,×10)A.Normal group B.Model group C.Pinaverium bromide group D.Low-dose ultrafine granular powder group E.Medium-dose ultrafine granular powder group F.High-dose ultrafine granular powder groupFig.1 Pathological sections of colonic tissues of rats in each group(HE staining,×10)
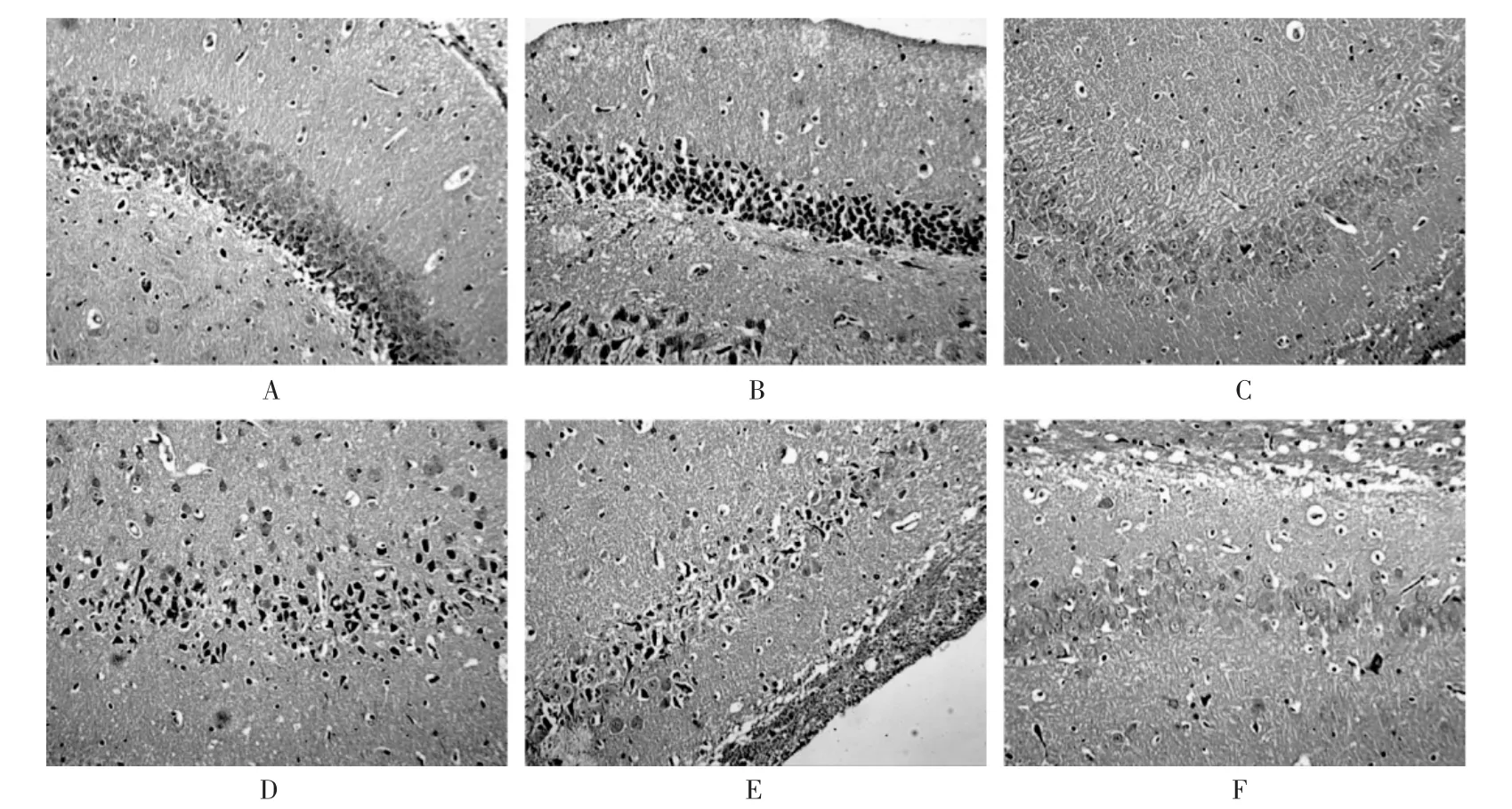
A.正常组 B.模型组 C.匹维溴铵组 D.破壁饮片低剂量组 E.破壁饮片中剂量组 F.破壁饮片高剂量组图2 各组大鼠脑组织病理切片(HE,×10)A.Normal group B.Model group C.Pinaverium bromide group D.Low-dose ultrafine granular powder group E.Medium-dose ultrafine granular powder group F.High-dose ultrafine granular powder groupFig.2 Pathological sections of brain tissues of rats in each group(HE staining,×10)
VIP是一种抑制性胃肠道调节激素[9],具有舒张血管及松弛平滑肌的作用,可直接抑制胃肠道平滑肌的收缩,同时还可通过促进一氧化氮(NO)与环磷酸腺苷(cAMP)合成,再次抑制胃肠平滑肌的运动,减慢胃肠道蠕动,降低胃排空及肠推进速度,提示大鼠肠道VIP分泌异常可能与IBS-D发病密切相关[10-11]。痛泻要方破壁饮片可有效促进IBS-D大鼠肠道分泌VIP,达到止泻作用,故推测有效调节大鼠肠道VIP分泌可能是痛泻要方破壁饮片治疗IBS-D的作用机制之一。
研究表明,中药饮片经破壁技术处理后并不会破坏有效成分[12]。且前期研究发现,痛泻要方中药饮片与破壁饮片有效成分及含量一致[13-14],说明破壁饮片可发挥与传统中药饮片相同的药效作用,同时具有给药剂量准确、独立包装、携带方便的优势,不需要煎煮,热水冲服即可,对于不方便煎煮中药或是不接受服用大剂量汤剂的患者更有优势。建议临床可将破壁饮片作为传统中药饮片的补充品种,为进一步应用中医药服务广大患者带来便利。

