胸腺肽诱导Hela细胞死亡的研究
李亚琳, 魏 睿, 史秀超
(渭南师范学院 环境与生命科学学院, 渭南 714009)
胸腺肽是胸腺组织分泌的具有生理活性的一组多肽,胸腺肽主要活性成分是由28个氨基酸组成的胸腺肽α1(Thymosin alpha 1,Tα1)。临床上常用的Tα1是从小牛胸腺分离并经提纯的有非特异性免疫效应的小分子多肽,它能诱导刺激T细胞分化和发育,维持机体免疫平衡状态,增强T细胞对抗原的反应,从而提高机体抵抗疾病的能力[1]。临床上也有用Tα1辅助治疗肿瘤如肝癌和肾母细胞瘤的报道[2-4],然而Tα1在治疗癌症方面的研究还不是很多,其对肿瘤细胞本身的效应也不清楚。Hela细胞源自于人类宫颈癌细胞,宫颈癌是女性较为常见的恶性肿瘤,其发病率和死亡率在女性中居第二,仅次于乳腺癌[5]。
本研究选取注射用Tα1作为肿瘤治疗试剂,以人宫颈癌Hela细胞作为研究对象。用不同浓度的Tα1处理体外培养的Hela细胞,观察其对Hela细胞生长增殖及死亡的影响,并进一步调查Tα1诱导自噬相关因子lc3的表达情况,从而探索Tα1在体外诱导肿瘤细胞死亡的机制,为Tα1抗肿瘤研究提供实验依据。
1 材料与方法
1.1 材料
人 Hela细胞株(购于第四军医大学动物实验中心);注射用Tα1(西安迪赛生物药业有限责任公司);反转录酶(TaKaRa公司);定量PCR试剂盒(TaKaRa公司);LC3抗体(Sigma,USA);HRP标记的山羊抗兔IgG;ECL发光液;蛋白提取试剂盒(碧云天);lc3和β-actin引物由Invitrogen合成;ABI stepone plus实时荧光定量PCR仪;BHP9504-02化学发光仪。
1.2 方法
1.2.1 显微镜观察细胞死亡
将处于对数生长期的Hela细胞制成单细胞悬液,按1×103个/mL,接种于6孔板,培养24 h后,更换新鲜培养液并加入不同浓度的Tα1(10、20和30 μg/mL)作用48 h后,直接在显微镜下观察细胞形态。
1.2.2 MTT法检测HeLa细胞的生长率
取对数生长期的细胞, 用完全培养液调整细胞数为1×102个/mL,接种于96孔板,24 h后分别加入终浓度为:10、20、30、40、50、60和70 μg/mL 的Tα1作用24 h或48 h,同时设置正常对照组,每组6个复孔。药物作用24 h或48 h后,每孔加入5 mg/mL MTT 10 μL,继续培养4 h,吸出上清液,同时每孔加入DMSO 100 μL,摇床混匀 10 min,室温静置 20 min 后,用酶标仪(波长= 540 nm)测吸光值。
1.2.3 实时定量PCR检测lc3基因的表达
Hela细胞以1×104个/mL接种于6孔板,按照上述方法用不同浓度的Tα1(10、20和30 μg/mL)处理细胞48 h后,对细胞进行RNA抽提并检测其纯度和浓度,用特异性引物进行反转录反应合成cDNA第一链。用Power SYBR Green Master Mix(Applied Biosystems)进行定量PCR,检测不同浓度处理下lc3基因的表达情况,以β-actin作为内参。lc3引物如下:正向5′-CCACACCCAAAGTCCTCACT-3′,反向5′-CACTGCTGCTTT CCGTAACA-3′,产物长度220 bp。反应条件为:95 ℃预变性30 s;95 ℃变性5 s,58 ℃退火30 s,共40个循环。用β-actin作为内参来量化lc3的相对表达量。
1.2.4 Western Blot法检测LC3的表达
不同浓度的Tα1(10、20和30 μg/mL)处理Hela细胞48 h后,用蛋白提取试剂盒提取细胞总蛋白,进行体积分数为10%的SDS聚丙烯酰胺凝胶电泳(SDS-PAGE)并转膜。用脱脂牛奶室温封闭1 h,加入一抗(1∶1 000),4 ℃冰箱中孵育过夜。第2天取出膜,洗净后加入HRP标记的山羊抗兔IgG(1∶4 000), 室温杂交1 h。加入ECL显色,暗室曝光,显影,定影。
1.3 统计学处理

2 结果与分析
2.1 显微镜观察细胞死亡
在正常情况下Hela细胞呈梭形,比较饱满,大小均一。用不同浓度(10、20和30 μg/mL)的Tα1处理后,明显发现胞体变圆,细胞体积缩小,不再发生增殖等特征。并且随着Tα1浓度的增加,细胞死亡、萎缩的程度越明显(图1)。

(a)Control;(b)10 μg/mL Tα1;(c)20 μg/mL Tα1;(d)30 μg/mL Tα1
2.2 MTT法检测HeLa 细胞的死亡率
图2和图3是不同浓度的Tα1(10、20、30、40、50、60和70 μg/mL)处理细胞24 h和48 h后,由MTT法检测得到的细胞OD值。与正常细胞比较,药物处理后,测得的OD值明显降低,并且低浓度处理组降幅更大。处理24 h后,与正常对照组比较,20 μg/mL和30 μg/mL的Tα1处理组具有显著性差异。

图2 Tα1处理Hela细胞24 h后MTT检测细胞生长率
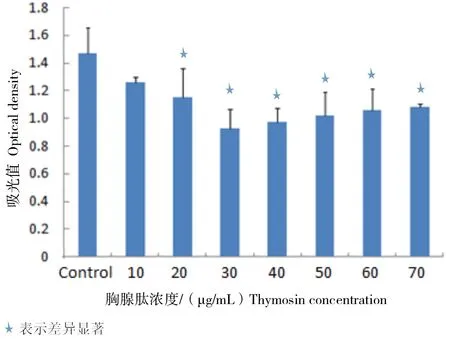
图3 Tα1处理Hela细胞48 h后MTT检测细胞生长率
2.3 实时定量PCR检测lc3基因的表达
用不同浓度的Tα1处理Hela细胞48 h后,RT-PCR检测lc3基因的表达。如图4所示,在一定浓度范围内,Tα1处理后,lc3的表达明显升高,且随着处理浓度的增加,lc3的表达量也在升高,具有剂量依赖性。

图4 RT-PCR检测lc3基因的表达
2.4 Western Blot法检测LC3的表达
不同浓度的Tα1(10、20和30 μg/mL)处理Hela细胞48 h后,Western Blot法检测LC3蛋白的表达,结果如图5所示。与Real time-PCR有一致的效应,Tα1处理后,自噬相关蛋白的表达也显著增加,并与处理浓度呈正相关。与正常对照组比较,Tα1处理后LC3的表达具有显著性差异。

图5 Western Blot检测LC3的表达
3 讨论与结论
Tα1主要通过活化机体免疫细胞,增加机体免疫力来治疗包括肿瘤在内的多种疾病[6]。有研究证明了Tα1也可以抑制乳腺癌细胞的增殖,诱导细胞凋亡,阻止乳腺癌生长[7-8]。也有报道显示Tα1能抑制食管鳞状细胞癌和肺癌的发展[9-10],所有这些报道均是通过体内试验来验证的。在本研究中,在体外通过形态学观察、MTT检测、RT-PCR检测以及Western Blot检测调查了Tα1对Hela细胞生长增殖的抑制,并简单分析了其诱导细胞死亡的机制,试图揭示Tα1在体外对宫颈癌Hela细胞的杀伤效应。
显微镜观察发现,用不同浓度的Tα1处理Hela 细胞后,细胞均出现一些形态学改变,如贴壁能力下降、胞体变圆、增殖减慢或停止。这些现象说明Tα1能够抑制Hela细胞的生长增殖,诱导其死亡。
为了进一步探讨Tα1对Hela细胞生长的抑制效应,试验用MTT测试法检测了细胞的生长情况。随着Tα1浓度的升高,测得的细胞吸光度值也逐渐减小,说明Tα1确实能够抑制Hela细胞的增殖并杀死Hela 细胞。由图2和图3也可以看出,10、20和 30 μg/mL的低浓度Tα1处理对Hela的生长抑制作用更为明显,这也是本试验在RT-PCR和Western Blot中所使用的Tα1浓度。MTT结果表明:Hela细胞对低浓度的药物刺激比较敏感,而较高浓度Tα1对细胞的生长抑制作用并不是很强;Tα1的这种抑制作用与处理的时间呈正相关。有文章揭示了在病理条件下血清Tα1的水平明显低于健康对照组[11],这个结论或许能解释Hela细胞对高浓度Tα1不敏感的原因。
自噬是20世纪60年代发现的生物现象,它是指细胞内的溶酶体降解自身细胞器和其他大分子的过程[12]。自噬主要降解长半衰期蛋白,是细胞能够完整降解细胞器的唯一途径[13],是一种由基因控制的自主性死亡过程[14]。LC3蛋白是细胞中自噬体的标记蛋白[15],因此实验进一步用RT-PCR和Western Blot检测了自噬相关基因lc3在基因水平和蛋白水平的表达,结果表明Tα1无论在哪个水平均能够诱导lc3的表达,并且随着Tα1浓度的提高,lc3的相对表达量也逐渐增加。
在肿瘤治疗过程中,Tα1作为一个辅助治疗因子能够提高患者的免疫能力,但该药物对于肿瘤细胞的作用不是很清楚。本研究仅以Hela细胞为例,证明了Tα1至少在体外对该细胞具有抑制其生长增殖的作用,并进一步调查了Tα1通过自噬的方式诱导Hela细胞死亡。该结果为Tα1在肿瘤治疗方面的临床应用提供了试验基础,也为拓宽肿瘤治疗的方法提供了新的生物治疗思路。

