丁香提取物抑菌作用及稳定性研究
孙长花,于智勇,丁娟芳,刘妮婷
(1.扬州市职业大学 生物与化工工程学院,扬州 225009 2.扬州大学 江苏省动物遗传繁育与分子设计重点实验室,扬州 225009)
随着生活水平不断提高,人们对食品安全也越来越关注,迫切希望用更自然、更安全的天然防腐剂来延长食品保藏期,从而保证人体健康。近几年,天然植物源食品防腐剂由于其安全、高效的特点受到广泛关注[1-2]。天然食用香辛料因具有抑菌[3]、抗氧化[4-5]作用,对其防腐保鲜的研究已经成为热点[6]。丁香(EugeniacaryophyllataThunb.)是一种常见的香料,是桃金娘(Rhodomyrtustomentosa)科植物丁香的干燥花蕾。丁香能够抑制多种霉菌和致腐菌的生长繁殖,是开发天然防腐剂的良好来源[7]。丁香中含有挥发油、多酚、黄酮等多种活性物质,其中主要抑菌成分为丁香酚[8-9]。目前,关于丁香抑菌成分研究主要集中于提取方法和工艺[10-14],以及在食品防腐保鲜中的应用[15-17],而未见其抑菌稳定性的研究报道。本文旨在对丁香抑菌成分的提取工艺、提取物的抑菌作用、最小抑菌浓度及影响抑菌稳定性的因素进行系统研究,以期为丁香作为天然防腐剂原料在食品防腐保鲜中的运用提供有益的理论参考依据。
1 材料与方法
1.1 材料与试剂
大肠杆菌(Escherichiacoli, E),表皮葡萄球菌(Staphylococcusepidermidis, S),金黄色葡萄球菌(Staphlococcusaureus, A),枯草芽孢杆菌(Bacillussubtilis, B),均由扬州市职业大学微生物实验室提供;丁香:产地广东,购自扬州众成堂大药房;平板计数琼脂培养基、琼脂、酵母粉、牛肉浸膏;无水乙醇、氯化钠、丙酸、氢氧化钠、氯化钾、氯化钙、氯化铁、硫酸亚铁、浓盐酸,均为分析纯。
1.2 仪器与设备
JY92-IIDN超声波细胞粉碎机、JA2003N电子天平、旭曼多功能粉碎机、SHB-III循环水式多用真空泵、RE-2000A旋转蒸发仪等。
1.3 工艺流程
原料选择 → 粉碎 → 过筛 → 称量 → 加乙醇 → 超声波提取 → 抽滤 → 滤液→ 真空浓缩 → 丁香提取物。
1.4 试验方法
1.4.1 丁香抑菌成分的提取工艺条件优化
采用超声波提取丁香的抑菌成分,分别选用乙醇溶液体积分数、料液比、提取温度、提取时间进行正交实验设计(表1)。

表1 正交设计因素与水平
1.4.2 抑菌圈测定
抑菌圈的测定采用牛津杯法[18-19]。将培养基冷却至60 ℃左右,倒培养皿(10~15 mL培养基),水平静置至完全凝固,取供试菌悬液0.1 mL于平板上,再倒入10 mL左右培养基,轻微摇动,使其与菌液混合均匀,水平静置至完全凝固。用镊子将灭过菌的牛津杯轻放入培养皿中,每个平皿中均匀地放置 3只牛津杯。吸取0.25 mL丁香提取物至牛津杯。将培养皿正置于37 ℃恒温培养箱培养24 h后测定抑菌圈直径,设置无菌水作阴性对照,并以体积分数为0.5%的山梨酸钾溶液的抑菌试验作阳性对照。
1.4.3 最小抑菌浓度测定
采用二倍稀释法,将丁香提取物(浓度为0.850 0 g/mL)用无菌水稀释,获得100%、50%、25%、12.5%、6.25%和3.125%共6个浓度梯度(提取物浓度分别为0.850 0、0.425 0、0.212 5、0.106 3、0.053 1和0.026 6 g/mL)。吸取1 mL不同浓度的稀释液,分别加入各无菌平皿,再倒入15~20 mL培养基,充分混合均匀,冷却凝固。取供试菌悬液0.1 mL与平板上,涂布均匀[20]。将培养皿倒置于37 ℃恒温培养箱中,培养24 h后观察菌落生长情况,每组做3个平行试验。
1.4.4 影响丁香提取物抑菌稳定性的因素
丁香提取物分别经过不同的热处理、pH值、金属离子Na+、K+、Ca2+以及紫外照射等条件处理[20-21],以未处理过的提取物作对照,进行抑菌试验,统计牛津杯法抑菌圈直径,研究在食品加工中各种条件对丁香提取物抑菌稳定性的影响。
2 结果与分析
2.1 丁香抑菌成分的提取工艺条件优化
分别将在各提取工艺条件下得到的丁香提取物进行抑菌试验。丁香提取物对大肠杆菌(E)、金黄色葡萄球菌(A)、枯草芽孢杆菌(B)、表皮葡萄球菌(S)的抑菌效果用抑菌圈直径大小判断,具体结果见表2。
由表2可知,乙醇溶液体积分数、料液比、提取温度、提取时间的极差R分别为8.6、1.2、5.2和2.9,因此影响丁香抑菌成分提取效果的条件因素的主次顺序为乙醇溶液体积分数>提取温度>提取时间>料液比。其中,乙醇溶液体积分数对提取效果影响最大,乙醇含量过低,丁香抑菌成分溶出量偏低,抑菌效果不佳。提取温度较低时,有效抑菌成分的溶出量低,提取不完全。提取时间过短,提取不充分,导致抑菌效果不好。料液比对提取效果的影响相对较小,当提取溶剂量过少,有效成分的提取量也过少,抑菌效果不佳;提取溶剂使用量较大时,明显增加提取物的浓缩时间,导致有效成分提取量的损失,降低抑菌效果。根据正交试验结果K值,筛选出最佳组合A2B2C2D3,即:乙醇溶液体积分数为85%,料液比为1∶10,提取温度80 ℃,超声波提取80 min,在此条件下获得的丁香提取物抑菌效果最好。
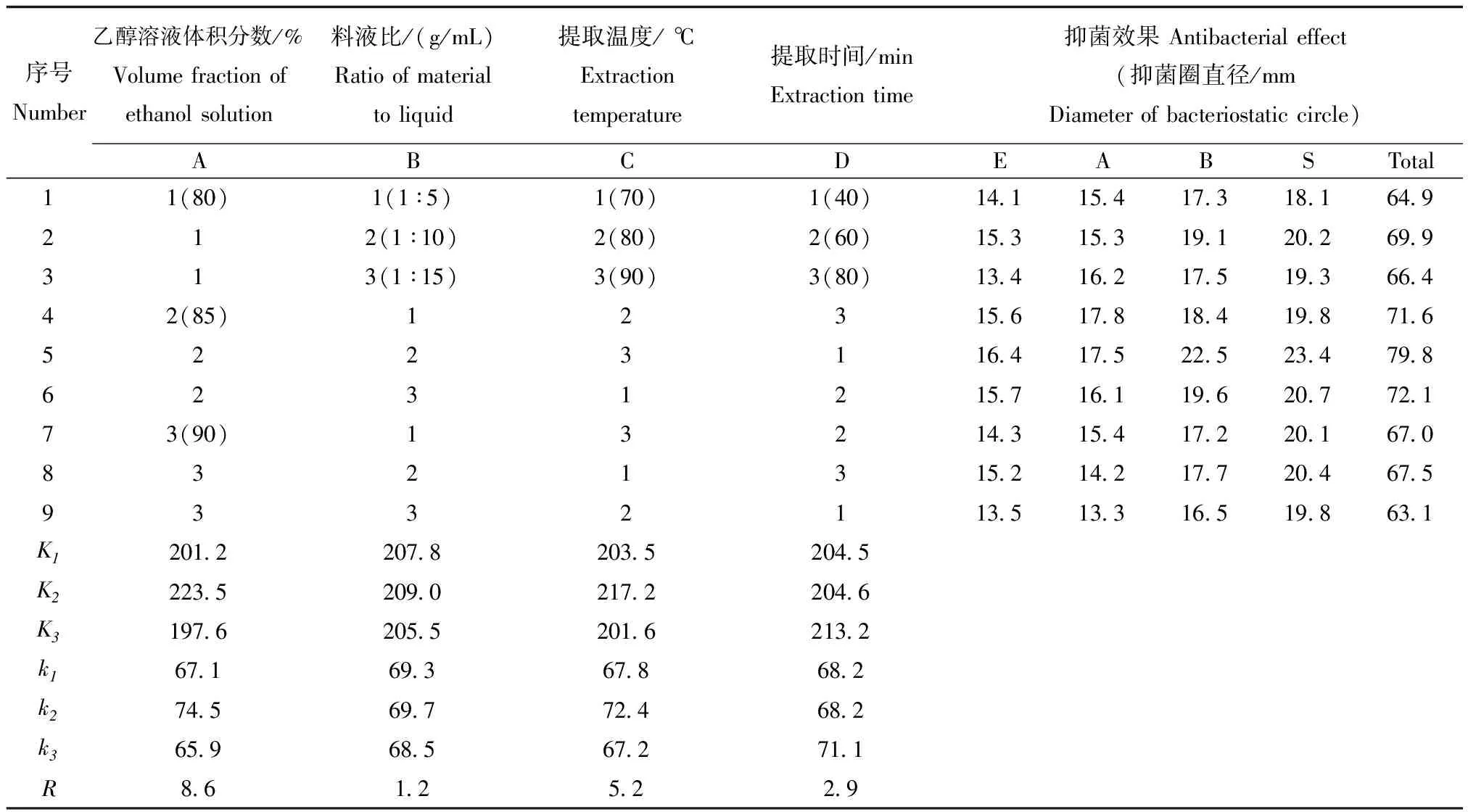
表2 丁香中天然抑菌成分提取的正交试验结果
2.2 丁香提取物的抑菌效果及最小抑菌浓度
2.2.1 丁香提取物的抑菌效果
采用牛津杯法,对丁香提取物和0.5%山梨酸钾进行金黄色葡萄球菌、大肠杆菌、枯草芽孢杆菌和表皮葡萄球菌等的抑菌试验,抑菌效果见图1。

图1 丁香提取物对常见细菌的抑菌效果
从图1可看出,丁香提取物和山梨酸钾对金黄色葡萄球菌、大肠杆菌、枯草芽孢杆菌和表皮葡萄球菌均有明显的抑菌作用,形成明显的抑菌圈,并且丁香提取物的抑菌活性明显高于同在等条件下的0.5%山梨酸钾。丁香提取物对金黄色葡萄球菌的抑菌圈直径为15.7 mm,对大肠杆菌的抑菌圈直径为16.9 mm,对枯草芽孢杆菌的抑菌圈直径为21.6 mm,对表皮葡萄球菌的抑菌圈直径为23.3 mm;山梨酸钾对金黄色葡萄球菌的抑菌圈直径为12.8 mm,对大肠杆菌的抑菌圈直径为13.6 mm,对枯草芽孢杆菌的抑菌圈直径为12.2 mm,对表皮葡萄球菌的抑菌圈直径为17.1 mm。
2.2.2 丁香提取物的最小抑菌浓度
采用二倍稀释法,对丁香提取物(浓度为0.850 0 g/mL)分别进行涂布抑菌试验。通过不同稀释浓度的平皿中菌落生长情况来判定提取物的最小抑菌浓度,结果(表3)表明,丁香提取物浓度为0.106 3 g/mL时,均未见菌落生长,说明丁香提取物对常见细菌的抑菌效果良好。同时,丁香提取物对不同细菌的最小抑菌浓度也不同。当丁香提取物浓度稀释到0.053 1 g/mL时,大肠杆菌、金黄色葡萄球菌和枯草芽孢杆菌均出现菌落,丁香提取物对3种细菌的最小抑菌浓度为0.106 3 g/mL;当提取物浓度稀释到0.026 6 g/mL时,表皮葡萄球菌才有菌落出现,说明丁香提取物对表皮葡萄球菌有很强的抑菌效果,最小抑菌浓度为0.053 1 g/mL。
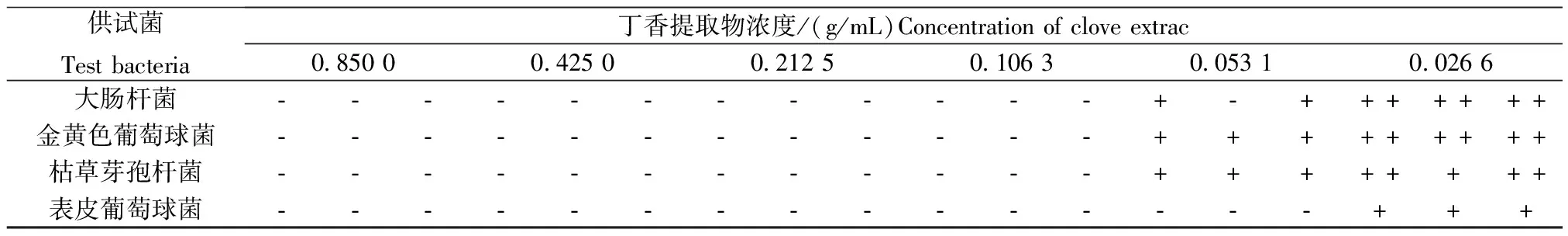
表3 丁香提取物的最小抑菌浓度
2.3 丁香提取物抑菌稳定性的研究
2.3.1 热处理对丁香提取物抑菌稳定性的影响
将丁香提取物分别在80 ℃、100 ℃和121 ℃下处理 30 min,以未处理过的提取物作对照,对提取物稳定性的影响结果见图2。

图2 热处理对丁香提取物抑菌作用的影响
由图2可知,经过不同温度的热处理,丁香提取物的抑菌效果变化不显著。80 ℃和100 ℃热处理后,丁香提取物对供试菌的抑菌圈平均直径分别减小:E为0.7 mm,A为0.2 mm,B为1.3 mm,S为1.4 mm,减幅小于6%,抑菌效力基本不变;121 ℃处理后,提取物抑菌圈平均直径分别减小:E为3.0 mm,A为1.4 mm,B为4.7 mm,S为3.3 mm,抑菌效力略降低,但仍有较好的抑菌效果,说明丁香提取物对热的稳定性较好。
2.3.2 pH值对丁香提取物抑菌稳定性的影响
分别用丙酸和NaOH溶液将提取物的pH值调节为2.0、4.0、8.0和10.0,以未处理过的丁香提取物(pH 6.0)作对照。抑菌结果(图3)显示,丁香提取物的抑菌效果受pH值的影响,且变化显著。当pH 2.0时,提取物抑菌圈平均直径减小:E为5.8 mm,A为5.1 mm,B为11.0 mm,S为7.3 mm,最高减幅达50%,抑菌活力降低明显;当pH 4.0时,提取物的抑菌圈平均直径减小:E为0.2 mm,A为0.1 mm,B为1.9 mm,S为0.7 mm,变化幅度低于9%,抑菌活性基本未受影响;当pH 8.0时,提取物抑菌圈平均直径减小:E为6.0 mm,A为4.3 mm,B为6.8 mm,S为6.6 mm,抑菌活力降低,抑菌效果变差;当pH 10时,提取物抑菌圈平均直径减小:E为7.9 mm,A为7.1 mm,B为14.1 mm,S为10.3 mm,减幅高达63.6%,抑菌活力显著降低。因此,丁香提取物在弱酸性及中性环境下的抑菌稳定性很好,但是在强酸性、碱性环境下抑菌效果较差。
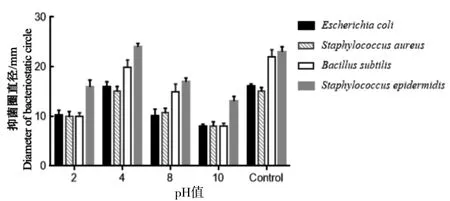
图3 pH值对丁香提取物抑菌作用的影响
2.3.3 金属离子对丁香提取物抑菌稳定性的影响
分别配制1 mol/L 的不同金属离子(Na+、K+、Ca2+、Fe2+、Fe3+)的溶液,以未处理过的提取物作对照。金属离子对提取物稳定性的影响结果(图4)显示:金属离子Na+、K+、Ca2+处理后,丁香提取物抑菌圈平均直径最多减小:E为1.1 mm,A为1.1 mm,B为1.3 mm,S为1.8 mm,减少量小于7.7%,抑菌活性保持稳定;金属离子Fe2+、Fe3+处理过的提取物,抑菌圈平均直径分别增加E为3.9 mm、A为4.7 mm、B为1.5 mm,S为2.7 mm,最大增幅29.6%,抑菌活性有一定程度的提高。这个现象产生的原因可能是:1)金属离子本身具有抑菌作用;2)抑菌成分与金属离子发生螯合作用,从而提升了抑菌活力[20]。

图4 金属离子对丁香提取物抑菌作用的影响
2.3.4 紫外线照射对丁香提取物抑菌稳定性的影响
将丁香提取物分别置于紫外线灯下照射,照射时间分别设定为5、10、15、20和25 min,以未处理的提取物作对照。紫外照射对提取物稳定性的影响结果(图5)显示,经过紫外线照射处理,随着照射时间的变化,丁香提取物抑菌圈平均直径并未出现明显变化。与对照相比,抑菌圈平均直径的变化最大值分别为:E为2.2 mm,A为1.1 mm,B为3.5 mm,S为2.6 mm,变化幅度小于15.8%,抑菌活性基本保持稳定。因此,丁香提取物对紫外线照射的稳定性很好。

图5 紫外线照射对丁香提取物抑菌作用的影响
3 讨论与结论
丁香是一种常见的香料,具有抑菌作用。丁香抑菌成分的最佳提取工艺条件为:乙醇溶液体积分数为85%,料液比为1∶10,提取温度80 ℃,超声波提取80 min,获得的丁香提取物对常见细菌均具有较好的抑菌效果。丁香提取物对大肠杆菌、金黄色葡萄球菌和枯草芽孢杆菌的最小抑菌浓度为0.106 3 g/mL,对表皮葡萄球菌的最小抑菌浓度0.053 1 g/mL。
现有的研究报道表明,丁香的抑菌活性成分主要包括丁香酚、乙酰丁香酚、丁香烯、水杨酸甲酯、苯甲醛、乙酸苄酯等物质[10]。对丁香提取物的抑菌稳定性研究发现,丁香提取物的热稳定性较好,对紫外线有很强的稳定性,大多数金属离子对其抑菌效果也无明显作用,在酸性及中性环境下的抑菌稳定性很好,但是在碱性环境下抑菌活性降低。这说明丁香提取物中某些抑菌成分和溶液中的碱发生反应,从而导致该抑菌成分的抑菌活力降低或消失,该抑菌成分应为有机酸酚类,而丁香的抑菌活性成分中丁香酚属于有机酸酚类,因此推断丁香的主要抑菌成分是丁香酚,这也与文献报道的一致[8-9]。
丁香原料来源广、易获得,丁香提取物具有良好的抑菌作用,且对加工条件具有广泛的适用性,因此以丁香作为天然防腐剂原料进行加工利用并应用于食品的防腐保鲜,具有较好的发展前景。

