嘌呤核苷磷酸化酶与嘧啶核苷磷酸化酶的融合表达及酶法合成嘌呤核苷类产物
徐玲玲,康丽峰,刘高飞,何冰芳,储建林
(1.南京工业大学 药学院,江苏 南京 211816; 2.常州市第一人民医院,江苏 常州 213003; 3.南京工业大学 生物与制药工程学院,江苏 南京 211816)
核苷类药物是临床上重要的抗病毒、抗肿瘤药物[1-2],主要有:齐多夫定、阿巴卡韦等可用于治疗艾滋病;恩替卡韦、替比夫定等可用于治疗乙肝病毒;克拉屈滨、氟达拉滨等可用于治疗白血病、淋巴瘤等肿瘤疾病[3-5]。核苷类化合物以化学法合成报道居多,该方法是利用保护的碱基与多羟基选择性保护的核糖进行缩合反应来制备核苷类产物,但得到的核苷产物往往是核糖(阿糖)α、β同分异构体产物;化学法也可以利用天然核苷类化合物为原料,对其碱基或核糖基进行修饰,得到其核苷类化合物的新型衍生物[6]。化学法合成核苷类产物往往需要多步反应,对活性基团修饰保护与脱保护,使用重金属等特点,不利于环保[7];甚至还需要对其异构体拆分,才能得到活性β型核苷类产物,糖异构体的化合物一般难以分离获得高纯度的单一异构体核苷产物,化学法合成核苷产物的最终产率往往不是很高[7-8]。
生物酶法合成核苷类药物具有无需保护、步骤少、无糖异构体产物生成等特点与优势[6-8]。目前,生物酶法催化合成核苷类药物主要有核苷磷酸化酶和N-脱氧核糖转移酶两大类酶[8]。依据核苷磷酸化酶对嘌呤与嘧啶类底物的选择性,可细分为嘧啶核苷磷酸化酶和嘌呤核苷磷酸化酶[9-10]。核苷磷酸化酶对糖供体选择范围较为宽泛,能识别核糖、脱氧核糖等多种核苷类糖供体,被用于核苷类产物的合成制备方面较为引人注目[9-10]。核苷磷酸化酶能以廉价的天然核苷为原料,可逆催化其磷酸化反应,生成1-磷酸核糖为真正的核糖基供体,以碱基为受体合成新的核苷类产物(即催化核苷与碱基之间的转换反应)[8-10]。嘌呤核苷磷酸化酶往往只能催化嘌呤核苷供体的磷酸化反应,并只能合成嘌呤核苷产物,对嘧啶类碱基供体不反应,具有极为严格的碱基底物受体专一性(嘧啶核苷磷酸化酶类同)[11]。
生物酶法合成嘌呤核苷类产物,利用嘌呤核苷磷酸化酶与嘧啶核苷磷酸化酶构建的双酶催化体系来合成嘌呤核苷产物,能得到较高的产率[12-13]。该双酶催化的具体反应过程:第一步由嘧啶核苷磷酸化酶催化嘧啶核苷的磷酸化反应水解生成1-磷酸核糖(作为第二个酶的糖供体),第二步再由嘌呤核苷磷酸化酶催化嘌呤碱基与1-磷酸核糖的合成反应从而得到嘌呤核苷类产物[14]。嘧啶核苷磷酸化酶和嘌呤核苷磷酸化酶在热动力学方面分别偏向于水解合成,双酶催化有利于嘌呤核苷类产物的合成累积;并且第一步反应所产生的嘧啶碱基副产物不会参与第二步反应,不会因为副产物的积累而抑制第二步反应,最终提高了嘌呤核苷类产物的合成产率[12-15]。
然而,单独添加的游离双酶的生物催化是在液体反应体系下进行的,中间产物可能很容易扩散,且局部浓度不高、传质效率较低,导致中间产物不易很快进入第二个酶的活性中心参与反应[14]。因此,考虑利用连接肽将第一个酶与第二酶相互连接在一起,形成新的融合蛋白[16-17]。连接肽特性如连接肽长度、刚柔性等可能影响酶的表达与酶的活性[18-21],合适的连接肽可增强酶与酶分子之间的临近效应,可能会形成较强的底物通道效应,显著提高参与反应物质的传质效率,并减少中间物的扩散,从而大幅度地提高反应效率[22-23]。
本文利用自行筛选,并实现表达的尿嘧啶核苷磷酸化酶EcUP与嘌呤核苷磷酸化酶AmPNP为研究对象,酶EcUP和酶AmPNP具有相对较小的分子量,具有相似的三维结构;酶EcUP和酶AmPNP适合进行双酶融合的表达研究。对尿嘧啶核苷磷酸化酶EcUP与嘌呤核苷磷酸化酶AmPNP进行融合设计;考察不同特性的连接肽(Linker)对酶融合的可溶性表达影响,并研究了融合效果最好的融合蛋白催化合成克拉曲滨等嘌呤核苷类产物的影响,以期实现双酶高效催化合成核苷产物,增强生物催化合成核苷的实用性。
1 材料与方法
1.1 实验材料
菌株E.coli和菌株AneurinibacillusmigulanusAM007,由南京工业大学药学院何冰芳教授的研究室筛选并保存,其中菌株AneurinibacillusmigulanusAM007在中国典型培养物保藏中心的编号为CCTCC NO.M2016404[24];E.coliBL21(DE3)、E.coliDH5α化学感受态细胞,南京市诺唯赞公司;质粒pET-28a(+),北京市索莱宝公司。
细菌基因组DNA提取试剂盒、限制性内切酶NdeⅠ、BamHⅠ、T4 DNA Ligase、Prime STAR HS DNA聚合酶、DNA Marker等,北京市TaKaRa公司;2×EVO Master Mix,南京市诺唯赞公司;质粒提取试剂盒、DNA胶回收试剂盒,美国AXYGEN公司。HPLC分析使用的溶剂甲醇为色谱级;尿苷,脱氧尿苷,核苷碱基等其他试剂均为分析纯试剂。
工程菌株的液体培养基(LB培养基): NaCl 10 g/L,蛋白胨10 g/L,酵母提取物5 g/L,上述培养基于121 ℃灭菌 20 min,加入过滤除菌的硫酸卡那霉素(Kana)使其终质量浓度为50 mg/L,制得液体培养基。工程菌株的平板固体培养基:在上述的液体培养基中额外添加琼脂粉20 g/L,相同条件灭菌,加入过滤除菌的Kana使其终质量浓度为50 mg/L,制得平板固体培养基。
所用的相关引物见表1。

表1 核苷磷酸化酶EcUP与AmPNP的基因克隆与酶融合设计的引物序列Table 1 Primer sequences of purine nucleoside phosphorylase EcUP,pyrimidine nucleoside phosphorylase AmPNP and fusion enzymes
1.2 实验方法
1.2.1 嘧啶核苷磷酸化酶EcUP与嘌呤核苷磷酸化酶AmPNP基因的克隆
分别提取本研究室自行筛选获得的菌株AneurinibacillusmigulanusAM007与大肠杆菌(E.coli)的总DNA基因组,以对应菌株的总DNA为模板,分别进行酶AmPNP与酶EcUP的基因扩增。PCR基因扩增的反应体系为2×EVO Master Mix 25 μL,分别加入2 μL对应的引物E1/E2与A1/A2,DNA模板2 μL和超纯水19 μL。PCR扩增反应条件:1) 94 ℃,预变性3 min;2) 94 ℃,变性15 s;3) 55 ℃,退火30 s;4) 72 ℃,延伸1 min; 2)~4)步骤循环重复30次;5) 72 ℃彻底延伸10 min,冷却至4 ℃。PCR产物经琼脂糖凝胶电泳纯化,琼脂糖凝胶DNA回收试剂盒回收目的基因的DNA片段,获得嘌呤核苷磷酸化酶AmPNP与嘧啶核苷磷酸化酶EcUP的基因序列。
1.2.2 融合蛋白EcUP-Linker-AmPNP的重组菌构建与诱导表达
分别以酶AmPNP和酶EcUP基因序列为模板,进行基因扩增。以酶EcUP基因为模板,双酶融合设计使用的引物分别为E-S-N/E-X-L1,E-S-N/E-X-L2,E-S-N/E-X-L3,E-S-N/E-X-L4;以酶AmPNP基因为模板,融合设计使用的引物分别为A-X-B/A-S-L1,A-X-B/A-S-L2,A-X-B/A-S-L3,A-X-B/A-S-L4,基因扩增反应体系与方法同上一步。PCR产物经琼脂糖凝胶电泳纯化,利用琼脂糖凝胶DNA回收试剂盒回收目的基因片段。获得目的基因片段ELn和ALn(n=1、2、3、4)。以基因片段ELn(n=1~4)和 ALn(n=1~4)为模板,以引物E-S-N和A-X-B进行重叠PCR反应,连接肽将酶EcUP的C端连接到酶AmPNP的N端,重叠PCR扩增反应条件同上。纯化后的基因片段与pET-28a(+)质粒,加入NdeI和BamHI限制性内切酶,于37 ℃反应6 h,纯化后得到酶融合蛋白的基因片段产物,再用T4 DNA连接酶16 ℃下连接12 h后转入E.coliBL21(DE3)化学感受态细胞。菌落PCR验证阳性克隆子,样品送至南京思普金生物科技有限公司进行测序,获得对应的重组双酶融合蛋白的工程菌株。
采用优化后的诱导表达条件进行重组双酶融合蛋白的诱导表达:将获得的重组菌接种至终质量浓度为50 μg/mL的Kana液体培养基中,于37 ℃,200 r/min条件下培养12 h作为种子液。种子液按体积分数1%接种到上述培养基中相同条件培养2 h左右(OD600约为0.6),加入终浓度为0.1 mmol/L的异丙基硫代半乳糖苷(IPTG),诱导培养温度为20 ℃,诱导培养8 h后于4 ℃,8 000 r/min离心20 min收集菌体,用等体积pH 8.0 Na2HPO4-KH2PO4(PBS)缓冲液50 mmol/L悬浮菌体,菌体细胞超声破碎10 min后,于4 ℃,12 000 r/min离心20 min获得酶上清液并进行聚丙烯酰胺凝胶电泳(SDS-PAGE)分析。
1.2.3 核苷磷酸化酶及融合酶的酶活力与水解产率的测定
利用HPLC法测定核苷磷酸化酶的活力[15]。核苷磷酸化酶AmPNP的酶学性质,如最适反应温度、pH等条件,参照参考文献[24]。核苷磷酸化酶EcUP的序列与已有的文献报道一致,该酶的酶学性质参照参考文献[25]。核苷磷酸化酶与酶融合蛋白的活力测定方法如下:用pH 8.0、50 mmol/L Na2HPO4-KH2PO4缓冲液,其中含1 mmol/L的乙二胺四乙酸(EDTA)分别配制含有40.0 mmol/L的肌苷、尿苷、鸟苷、腺苷和脱氧尿苷的底物溶液。酶活力测定时,反应体系中分别加入250 μL上述底物溶液和700 μL上述PBS缓冲液,最后加入50 μL稀释适当倍数的酶液(在酶的C端加入了6×His,利用镍柱亲和层析的方法纯化获得的纯酶),于50 ℃条件下反应10 min,取样50 μL立即加入到950 μL甲醇中,终止反应,检测计算各样品中生成产物的量。1个单位(U)核苷磷酸化酶或融合酶的酶活力定义为在上述最适的反应条件下,每分钟催化磷酸化反应消耗1 μmol的核苷底物所需的酶量。
1.2.4 融合酶EcUP-L4-AmPNP催化合成2,6-二氨基嘌呤核苷的反应条件
嘌呤核苷合成的反应条件参照参考文献[24],以pH 8.0的PBS缓冲液(含1 mmol/L的EDTA)配制10 mmol/L的尿苷或脱氧尿苷(核苷糖供体),5 mmol/L的各种嘌呤类碱基(碱基受体);加入合适浓度的嘧啶核苷磷酸化酶和嘌呤核苷磷酸化酶的融合酶(在酶的C端加入了6×His,镍柱亲和层析的方法纯化获得了其纯酶),在恒温振荡反应器中50 ℃反应,进行嘌呤核苷产物的合成。反应一定时间后,取50 μL样品立即加入950 μL甲醇终止反应。样品预处理后,采用HPLC检测相应的产物[14-15],检测分析条件:Discovery C18 色谱柱(250 mm×4.6 mm,5 μm),进样量10 μL,流动相V(甲醇)∶V(纯水)=1∶ 9,波长为254 nm,柱温30 ℃,流速为1.0 mL/min。
2 结果与讨论
2.1 嘧啶核苷磷酸化酶EcUP与嘌呤核苷磷酸化酶AmPNP基因的获取
以菌株AneurinibacillusmigulanusAM007总DNA基因组为模板,利用相应的引物,PCR扩增获得了编码嘌呤核苷磷酸化酶AmPNP的基因,电泳条带大小与预期的嘌呤核苷磷酸化酶AmPNP基因长度相符(图1),并进行测序,验证了其大小为813 bp。以大肠杆菌(E.coli) 的总DNA基因组为模板,利用相应的引物,PCR扩增获得嘧啶核苷磷酸化酶EcUP的基因,电泳分析表明:嘧啶核苷磷酸化酶EcUP基因长度与预期相符(图1)并进行测序,验证了其大小为762 bp。

M—Marker;PNP—嘌呤核苷磷酸化酶AmPNP的基因产物;EcUP—嘧啶核苷磷酸化酶EcUP基因产物图1 嘌呤核苷磷酸化酶基因与嘧啶核苷磷酸化酶基因PCR的扩增产物Fig.1 PCR amplification product of purine nucleosidephosphorylase and pyrimidine nucleoside phosphorylase gene
2.2 核苷磷酸化酶的融合表达菌株构建与融合蛋白的表达量影响
嘌呤核苷磷酸化酶AmPNP(编码270个氨基酸)与嘧啶核苷磷酸化酶EcUP(编码253个氨基酸)可分别在大肠杆菌E.coliBL21(DE3)中实现高效表达。嘌呤核苷磷酸化酶AmPNP在GenBank中的登记号为MH992394,嘌呤核苷磷酸化酶AmPNP的氨基酸列在本文研究申请的发明专利中也有详细记载[24],嘧啶核苷磷酸化酶EcUP在GenBank中的登记号为QBF93483。
选用不同特性的典型刚性/柔性连接肽,分别构建了EcUP与AmPNP的4种融合蛋白的重组菌,考察了连接短肽对双酶融合表达的影响,双酶融合蛋白的表达情况见图2。如图2所示:SDS-PAGE分析表明,嘧啶核苷磷酸化酶EcUP与嘌呤核苷磷酸化酶AmPNP融合表达后,在分子量6.3×104处有明显的蛋白条带,与预期融合蛋白的理论分子量大小相符。4种融合蛋白EcUP-L1-AmPNP,EcUP-L2-AmPNP,EcUP-L3-AmPNP,EcUP-L4-AmPNP均可以实现异源表达;但不同连接肽获得的融合蛋白的可溶性表达水平差异较大。以柔性连接肽L1、L2、L3构建获得的融合蛋白表达以包涵体为主,仅有少部分的可溶性蛋白。使用刚性连接短肽L4 (EEEEEEKKK)构建获得的融合蛋白EcUP-L4-AmPNP的可溶性部分比较多,包涵体部分的量极少。可见酶AmPNP与酶EcUP融合时,刚性连接肽对其融合蛋白的可溶性表达有利,可实现融合蛋白的正确折叠,能形成具有较高酶活性的双酶融合体。

M—蛋白Marker;1—EcUP-L1-AmPNP的破碎上清;2—EcUP-L1-AmPNP的破碎沉淀(包涵体);3—EcUP-L2-AmPNP的破碎上清;4—EcUP-L2-AmPNP的破碎沉淀(包涵体);5—EcUP-L3-AmPNP的破碎沉淀(包涵体);6—EcUP-L3-AmPNP的破碎上清;7—EcUP-L4-AmPNP的破碎上清;8—EcUP-L4-AmPNP的破碎沉淀(包涵体)图2 不同连接肽对核苷磷酸化酶融合蛋白表达影响的SDS-PAGE分析图Fig.2 Effect of different linker on the recombinant fusion protein of purine nucleoside phosphorylase and pyrimidine nucleoside phosphorylase by SDS-PAGE analysis
2.3 融合酶EcUP-Linker-AmPNP的活性及其对核苷底物的水解产率影响
笔者克隆表达获得的尿嘧啶核苷磷酸化酶EcUP只能水解嘧啶核苷类底物,不能水解嘌呤核苷类底物;嘌呤核苷磷酸化酶AmPNP只能水解嘌呤核苷类底物,但不能水解嘧啶核苷类底物。这两个酶对核苷类底物的反应性能情况与一些现有的报道相似[9]。通过双酶的融合表达可能实现融合酶对多种类核苷底物的反应活性。笔者分别测试分析了4种双酶融合体EcUP-L1-AmPNP,EcUP-L2-AmPNP,EcUP- L3-AmPNP,EcUP-L4-AmPNP对几种核苷类底物的反应情况。结果表明:以包涵体较多的融合酶EcUP-L1-AmPNP,EcUP-L2-AmPNP,EcUP-L3-AmPNP可溶性蛋白与包涵体部分均没有反应活性或极低的反应活性。在大肠杆菌中能大部分可溶性表达的融合酶EcUP-L4-AmPNP具有较高的活性。核苷磷酸化酶的融合体EcPNP-L4-AmUP对尿苷、肌苷等核苷类底物的酶活力情况(表2)。由表2可知:融合酶EcUP-L4-AmPNP对嘌呤和嘧啶核苷类底物的水解比活力大小顺序为尿苷、肌苷、脱氧尿苷、鸟苷、腺苷;融合酶EcUP-L4-AmPNP对嘌呤和嘧啶核苷类底物的水解产率的大小依次为脱氧尿苷、尿苷、肌苷、腺苷、鸟苷。从反应热力学方面来看:酶融合蛋白EcUP-L4-AmPNP对嘧啶核苷的水解产率都大于嘌呤核苷,这可能是融合酶EcUP-L4-AmPNP中的嘧啶核苷磷酸化酶EcUP催化嘧啶类核苷的水解反应活性相对比较高,而嘌呤核苷磷酸化酶AmPNP催化磷酸化反应合成嘌呤核苷活性相对比较高导致的。利用连接肽将嘧啶核苷磷酸化酶EcUP和嘌呤核苷磷酸化酶AmPNP相互融合,并成功地实现了可溶性表达;获得了对嘌呤和嘧啶类底物均有活性的融合蛋白EcUP-L4-AmPNP,拓展了其可催化反应的核苷类底物类型,该融合蛋白可能适用于生物催化合成嘌呤核苷类产物。
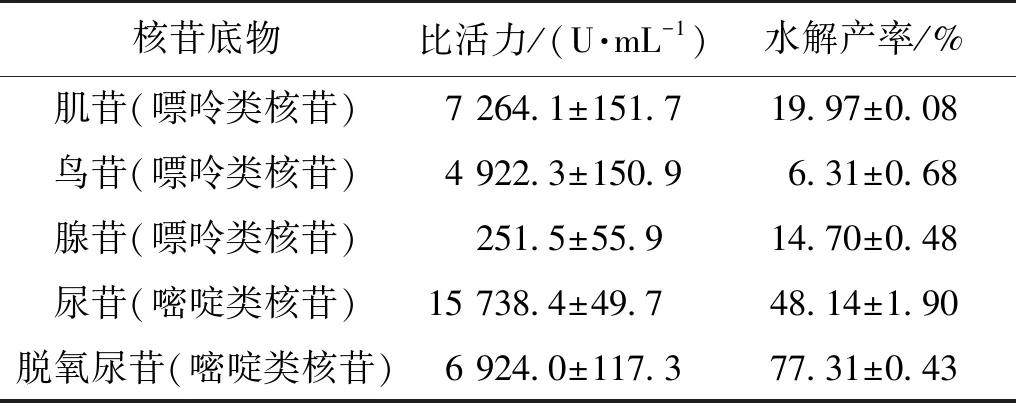
表2 双酶融合蛋白EcPNP-L4-AmUP的水解嘌呤核苷类与嘧啶核苷类底物的活力情况与水解产率Table 2 The phosphorolysis reaction activity and hydrolyzing yield of fusion enzyme EcPNP-L4-AmUP towards purine nucleosides and pyrimidine nucleosides
2.4 融合酶EcUP-L4-AmPNP催化合成2,6-二氨基嘌呤核苷的反应进程曲线
游离双酶催化合成2,6-二氨基嘌呤核苷产物的反应优化后,其反应条件为50 mmol/L、pH 8.0磷酸缓冲(含1 mmol/L EDTA),反应温度为50 ℃,核苷糖供体为嘧啶类尿苷(10 mmol/L),嘌呤碱基受体为2,6-二氨基嘌呤(5 mmol/L)。反应体系中分别加入游离的尿嘧啶核苷磷酸化酶EcUP与嘌呤核苷磷酸化酶AmPNP(摩尔比为1∶ 1混合),该条件下游离双酶催化合成2,6-二氨基嘌呤核苷产物的最高产率约63.0%(图3)。利用双酶融合体EcUP-L4-AmPNP为生物催化剂,研究其催化合成2,6-二氨基嘌呤核苷产物的反应进程曲线,双酶融合体EcUP-L4-AmPNP催化合成2,6-二氨基嘌呤核苷产物的情况(HPLC分析图谱见图4),产物经与2,6-二氨基嘌呤核苷标准品比较,并进行质谱分析确证。测定了融合酶EcUP-L4-AmPNP催化合成2,6-二氨基嘌呤核苷产物的反应进程曲线(图3)。由图3可知:当反应达到60 h时,融合酶EcUP-L4-AmPNP催化合成2,6-二氨基嘌呤核苷产物的反应趋于平缓,产率最高可以达到98.4%。已有报道利用来源于AeropyrumpernixK1的嘧啶核苷磷酸化酶和嘌呤核苷磷酸化酶合成2,6-二氨基嘌呤核苷的产率大约为60.0%[14]。Zhou等[15]使用来源于Thermusthermophilus的核苷磷酸化酶(PNP)和来源于Geobacillusthermoglucosidasius的嘧啶核苷磷酸化酶(PyNP)“一锅法”合成2,6-二氨基嘌呤核苷的产率可以达到95.3%(底物浓度及比例为尿苷∶ 2,6-二氨基嘌呤为2∶ 1)。本研究获得的融合酶EcUP-L4-AmPNP合成2,6-二氨基嘌呤核苷产物的产率高于现有的一些文献报道,并且合成嘌呤核苷的反应底物浓度水平显著高于目前已有的报道。推测可能是融合蛋白中AmPNP与EcUP微观空间上的距离更加接近,形成了一定的底物通道效应,可能有利于增加在溶液中的中间体产物的局部浓度,提高中间体物质的传质效率,从而提高了其催化合成嘌呤核苷类产物的产率。

图3 融合酶EcUP-L4-AmPNP催化合成2,6-二氨基嘌呤核苷的反应进程曲线Fig.3 Time course of purine nucleoside synthesized reaction catalyzed by fusion enzyme EcUP-L4-AmPNP

图4 融合酶EcUP-L4-AmPNP催化合成2,6-二氨基嘌呤核苷产物的HPLC分析图Fig.4 HPLC analysis of purine nucleoside product catalyzed by fusion enzyme EcUP-L4-AmPNP
2.5 融合酶EcUP-L4-AmPNP高效生物催化合成的嘌呤核苷类产物
融合酶EcUP-L4-AmPNP对尿苷、脱氧尿苷(嘧啶类核苷)具有较高的水解活性,结果见表2。由表2可知:融合酶EcUP-L4-AmPNP也可以利用较为廉价的尿苷、脱氧尿苷(嘧啶类核苷)为糖供体,以嘌呤碱基为受体合成嘌呤核苷类产物。游离双酶(将酶AmPNP与酶EcUP按1∶ 1的比例添加到反应体系中)与融合酶EcUP-L4-AmPNP均能催化合成几种嘌呤核苷类产物(嘌呤核苷产物的编号分别为A1、A2、A3、A4、B1、B2、B3、B4,具体见图5)。研究比较了游离双酶与融合酶EcUP-L4-AmPNP催化合成多种嘌呤核苷类产物的产率情况(图6)。
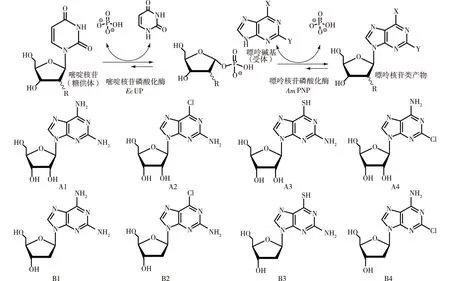
图5 尿嘧啶核苷磷酸化酶EcUP与嘌呤核苷磷酸化酶AmPNP双酶法催化合成嘌呤核苷类产物(A1~B4)的反应示意图Fig.5 Dual enzyme catalyzed the reaction of purine nucleosides biosynthesis by purine nucleoside phosphorylase EcUP and pyrimidine nucleoside phosphorylase AmPNP,products (A1-B4)
以尿苷为核苷糖供体,反应体系中分别加入游离双酶(尿嘧啶核苷磷酸化酶EcUP与嘌呤核苷磷酸化酶AmPNP,比例为1∶ 1)催化合成几种嘌呤核苷类产物的产率在47%~63%;而使用融合酶EcUP-L4-AmPNP催化合成嘌呤核苷类产物的产率在85.6%~98.3%(图6)。在嘌呤核苷产物的合成产率方面,融合酶EcUP-L4-AmPNP比游离双酶提高了约1.5~1.8倍。以2′脱氧尿苷为核苷糖供体,反应体系中分别加入游离双酶(尿嘧啶核苷磷酸化酶EcUP与嘌呤核苷磷酸化酶AmPNP,比例1∶ 1)催化合成几种2′脱氧嘌呤核苷类产物的产率在33.7%~60.5%(图6);而使用融合酶EcUP-L4-AmPNP催化合成2′脱氧嘌呤核苷类产物的产率为70.4%~96.5%。在2′脱氧嘌呤核苷产物的合成产率方面,融合酶EcUP-L4-AmPNP比游离双酶提高了约1.6~2.0倍。游离双酶与融合酶EcUP-L4-AmPNP均能合成抗白血病作用的克拉屈滨核苷类产物,融合酶EcUP-L4-AmPNP合成克拉屈滨的产率较高,可达70.4%(图6)。可能是由于双酶融合表达,酶与酶分子之间产生了一定临近效应,形成了底物通道效应,从而提高了其催化合成嘌呤核苷产物的产率[16]。
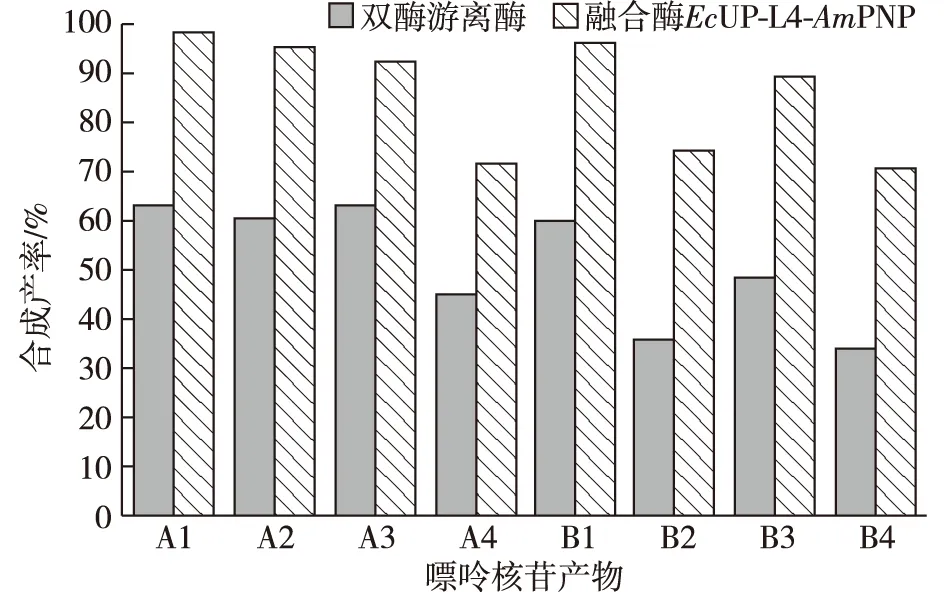
图6 双酶游离酶与融合酶EcUP-L4-AmPNP催化合成几种嘌呤核苷类产物的比较Fig.6 Biosynthesizing yield of several purine nucleoside products by free dual enzyme and fusion enzyme EcUP-L4-AmPNP
3 结论
本研究设计了不同的连接肽(Linker)将E.coli来源的嘧啶核苷磷酸化酶EcUP和AneurinibacillusmigulanusAM007来源的嘌呤核苷磷酸化酶AmPNP进行融合表达。不同特性(刚性、柔性)的连接肽对这两个酶融合时的可溶性表达有着较大影响,使用刚性短肽连接起来的融合酶EcUP-L4-AmPNP可溶性表达水平较高,并实现了其对嘧啶类和嘌呤类核苷底物均具有的水解活性,且嘌呤核苷的水解率远小于嘧啶核苷,有利于融合酶高效催化合成嘌呤核苷产物。相较于分别添加酶EcUP和酶AmPNP的游离双酶反应体系,利用融合酶EcUP-L4-AmPNP作为生物催化剂合成2,6-二氨基嘌呤核苷、克拉屈滨等嘌呤核苷类产物的产率显著提高,融合酶EcUP-L4-AmPNP催化合成2,6-二氨基嘌呤核苷产物的产率最高可以达到98.4%,融合酶EcUP-L4-AmPNP合成克拉屈滨的产率可达70.4%。融合酶EcUP-L4-AmPNP催化合成嘌呤核苷类产物的产率可达85.6%~98.3%,比分别加入酶EcUP和AmPNP的游离双酶体系提高了约1.5~1.8倍。融合酶EcUP-L4-AmPNP催化合成2′脱氧嘌呤核苷类产物的产率为70.4%~96.5%,比分别加入酶EcUP和AmPNP的双酶游离酶体系提高了约1.6~2.0倍,可能是酶EcUP与酶AmPNP融合后在微观空间上更加接近,酶分子之间可能形成了底物通道效应,从而使得嘌呤核苷产物的合成产率提高。双酶的融合表达设计有助于实现双酶的高效协同催化,对于双酶催化反应的优化设计具有重要的意义。

