细粒棘球蚴感染羊肝脏包囊纤维化形成的病理形态学观察
翟少华,胡美荷,李淑娴,刘来珍,阿尔祖古丽·阿卜力孜,王 楠,梁 天,刘海燕
(新疆农业大学动物医学学院,乌鲁木齐830052)
细粒棘球蚴病(包虫病)是由细粒棘球蚴寄生于人或动物体内而感染的一种人兽共患寄生虫病,俗称“虫癌”[1]。我国是世界上包虫病最严重的国家之一,新疆是高发区,在新疆家畜包虫病感染情况调查中,肝脏棘球蚴平均感染率为50.24%;包虫病感染率超过60%的有巴州、阿勒泰、伊犁和喀什4个地区,其中伊犁的感染率最高,达78.15%[2]。在我国分布的主要是细粒棘球绦虫和多房棘球绦虫[3]。前者的幼虫会引起细粒棘球蚴病,又称囊型包虫病,病例数占所有病例的90%以上;后者的幼虫会引起多房棘球蚴病,又称泡型包虫病[4]。
囊型棘球蚴病对人体器官的损害中以对肝脏的损害居首位[5]。中间宿主食用被细粒棘球蚴虫卵污染的食物或水后,在宿主消化液作用下发育成六钩蚴经肠壁进入血液,主要在肝和肺中发育成包囊,若包囊破裂释放出原头节可再次感染[6]。细粒棘球蚴在感染宿主过程中,对宿主致病的机制十分复杂,包括对宿主组织器官造成压迫性损伤、炎症反应、过敏反应以及免疫逃避等多方面问题[7]。肝包虫包囊纤维化早已被人熟知,但其炎症细胞的变化和形成机制尚不明确。因此,本研究旨在运用病理组织学、细胞化学和超微形态学的相关知识,将病理组织切片观察与细胞化学染色切片观察结合起来,共同探讨细粒棘球蚴对羊肝脏的损伤性变化和肝脏包囊的形成过程,为阐释细粒棘球蚴对机体的感染过程、肝脏纤维化以及肝细胞损伤的分子病理机制的形成提供研究基础,对该病的诊断、治疗具有重要意义。
1 材料与方法
1.1 病料的采集 2019年8月至10月期间,收集于乌鲁木齐市新市区华凌屠宰场所宰杀的阿勒泰羊中出现明显包囊的完整羊肝脏,共10份。
1.2 试剂 10%福尔马林固定液、Bouin固定液、无水乙醇、二甲苯、苏木素染液、1%伊红染液均购自天津市致远化学试剂有限公司;苏木紫、猩红、复红、磷钼酸、磷钨酸、浅绿染料购自北京化工厂;冰醋酸溶液购自天津市北方化玻购销中心。
1.3 感染羊肝脏病变组织的采集与观察 选取屠宰过程中出现包囊的羊肝脏,沿包囊周围与正常组织交界处剪取1.5 cm×1.5 cm×1.5 cm的病变组织,置于10%中性福尔马林固定液中固定12 h,其包囊直径范围在2~6 cm。共10个样品。
1.4 感染羊肝脏组织病理组织切片制备 取已固定的肝脏包囊病变组织,用流水冲洗2 h。将样品放入自动脱水机中按照70%乙醇(2 h)、80%乙醇(1.5 h)、90%乙醇(45 min)、95%乙醇Ⅰ(30 min)、95%乙醇Ⅱ(30 min)、100%乙醇Ⅰ(30 min)、100%乙醇Ⅱ(30 min)系列梯度逐级脱水;用二甲苯Ⅰ(二甲苯/无水乙醇1:1)、纯二甲苯Ⅱ、纯二甲苯Ⅲ,各透明8 min。最后用固体石蜡包埋组织、切片5 μm厚度。通过脱蜡、复水、苏木素-伊红染液染色各1 min,通过75%乙醇、80%乙醇、85%乙醇、90%乙醇、95%乙醇、100%乙醇,逐级脱水各2 min。甲苯Ⅰ(二甲苯与无水乙醇1∶1)、二甲苯Ⅱ,各透明1 min,滴加中性树脂胶封片,显微镜下观察病理学变化。
1.5 感染羊肝脏细胞化学染色样品制备 石蜡切片脱蜡后置于蒸馏水中,再置入Bouin氏固定液于56℃温箱中固定1 h,冷却10 min;清水冲洗约10 min至切片变透明,再置入蒸馏水中清洗;Weigert氏苏木紫溶液染10 min,清水冲洗10 min,置入蒸馏水中清洗;猩红-酸性复红溶液染10 min,切片置入蒸馏水中清洗;以钼酸-磷钨酸溶液染10~15 min做分色。检查胶质纤维没有被染成红色;使用浅绿溶液做对比染色1 min;以5%磷钨酸溶液分色15 min;以95%乙醇、绝对酒精及二甲苯脱水及透明封片。染色结果判定:肌肉、细胞质及角质呈红色;细胞核呈黑色;胶质纤维呈绿色。
1.6 感染羊肝脏组织扫描电子显微镜样品制备 从自然感染的绵羊肝脏细粒棘球蚴抽取包囊囊液和剪取包囊囊壁,分别将抽取的包囊液经自然沉淀弃去上清液收集原头蚴,滴加至粘贴有碳导电胶的扫描电镜样品台上;同时将剪取的1.5 cm×1.5 cm×1.5 cm包囊囊壁粘贴于扫描电镜样品台碳导电胶上,置于场发射环境扫描电子显微镜观察虫体特征和包囊囊壁结构特点。共7个样品。
2 结果
2.1 感染羊肝脏病变组织的采集与观察 感染羊肝脏表面可见大小不等的包囊凸出,包囊壁呈半透明状,包囊液清亮,有的包囊体积较大向肝组织内侵入生长,充满囊液的棘球蚴均具有一定张力,富有弹性不易塌陷。在肝脏表面的包囊中可以透过角质层清晰的看见颗粒状的生发囊[8],切开后有大量包囊液流出,包囊空虚,包囊壁呈灰白色,质地坚韧。在凸起的包囊周围可见散在的大范围的坏死灶布满整个肝脏,部分病灶相互融合形成较大范围的不规则的融合性病灶。抽取包囊液滴在载玻片上于显微镜下观察,可见大量原头蚴,原头蚴出现明显伸缩蠕动,活力较好,多数头节缩入虫体内,少数头节伸出。原头蚴多呈椭圆形,表面层光滑、透明。部分原头蚴顶突和4个吸盘完全翻出,高倍镜下顶突小钩结构清晰可见,体节内钙颗粒明显(图1)[9]。
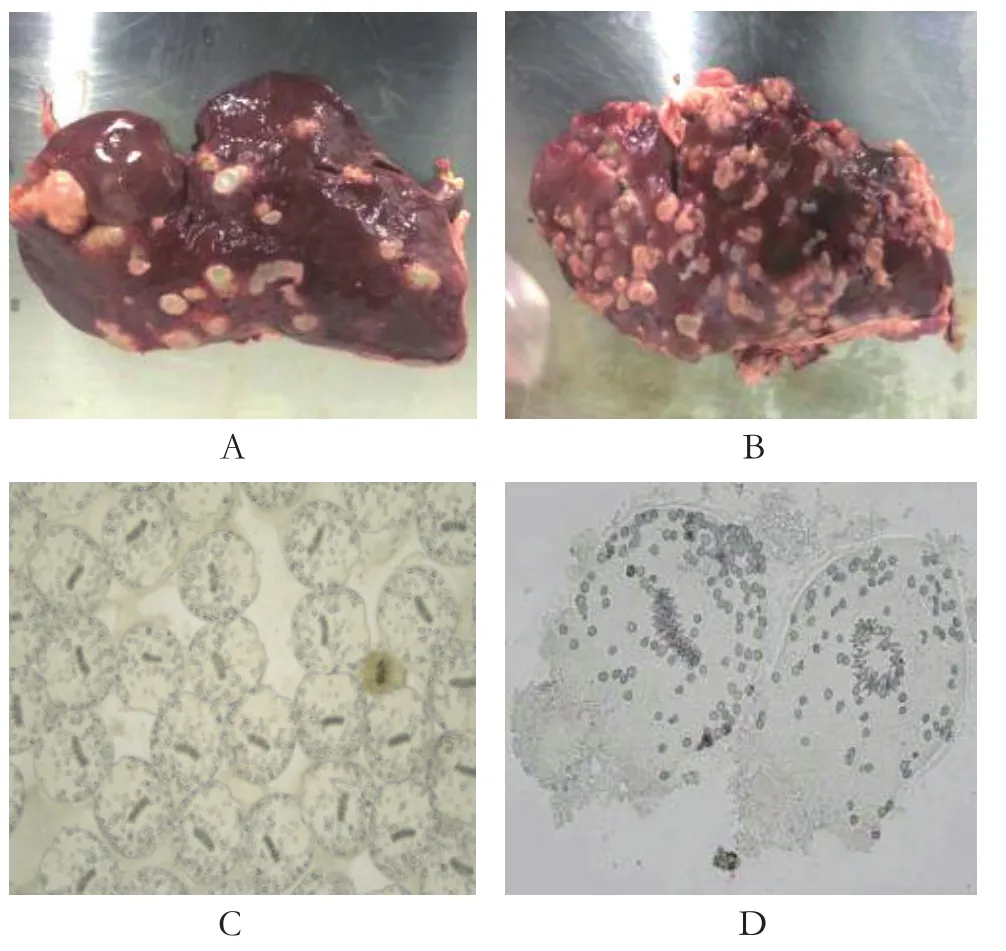
图1 感染羊肝脏包囊与包囊中原头蚴形态Fig.1 Morphology of protocephala in liver cysts and cysts in sheep infected
2.2 细粒棘球蚴的超微形态学观察 在场发射环境扫描电子显微镜下,可见分离的原头蚴呈长梭形,虫体长度平均约120 μm,内部细胞结构、肌纤维清晰。原头蚴上有小钩、吸盘及微细的石灰颗粒,具有感染性。以及包囊壁上可见附着的原头蚴虫体。包囊壁组织结构疏松,囊壁表面可见密集空隙结构(图2)。

图2 扫描电子显微镜下原头蚴与包囊壁的超微结构Fig.2 Ultrastructure of protocephala and cyst wall under scanning electron microscope
2.3 感染羊肝脏血管病理组织学变化 通过感染绵羊的肝脏病理组织学观察,可见肝脏呈局灶性坏死,在坏死组织内血管管壁分解出芽,并向外侧凸起延伸至炎症区域。围绕血管周围有较多的纤维组织增生呈片层结构,增生的胶原纤维自外侧血管壁向周围炎症区域辐射扩散性生长。在出芽的血管周围肝细胞消失,血管内外积聚大量的嗜酸性粒细胞、巨噬细胞、淋巴细胞等炎性细胞浸润。严重病变血管壁纤维组织增生导致血管管腔狭窄,形态不规则(图3)。

图3 感染羊肝脏组织血管病理组织变化Fig.3 Pathological changes of liver blood vessels in infected sheep
2.4 感染羊肝脏组织细胞损伤与炎症反应 在肝脏病变区域内可见沿血管周围的肝细胞大范围局灶性坏死,坏死组织融合成片,嗜伊红性增强,以及大量的炎性细胞浸润。在坏死组织周边肝细胞索断裂,细胞萎缩、形态不规则。肝细胞核消失,胞质空泡化,坏死的炎症区域可见纤维组织的增生(图4)。

图4 感染羊肝脏组织细胞损伤与炎症反应Fig.4 Injury of liver cells and inflammation in infected sheep
2.5 感染羊肝脏组织纤维化和包囊形成 在病变肝组织内增生的纤维组织沿残存的肝细胞周围炎症部位生长,将炎症区域与周围肝组织分离,纤维化包囊逐渐形成。在纤维化包囊形成过程中炎症细胞逐渐减少,多核巨细胞增多,包囊内壁纤维融合形成均质的、强嗜伊红的纤维瘢痕组织(图5)。
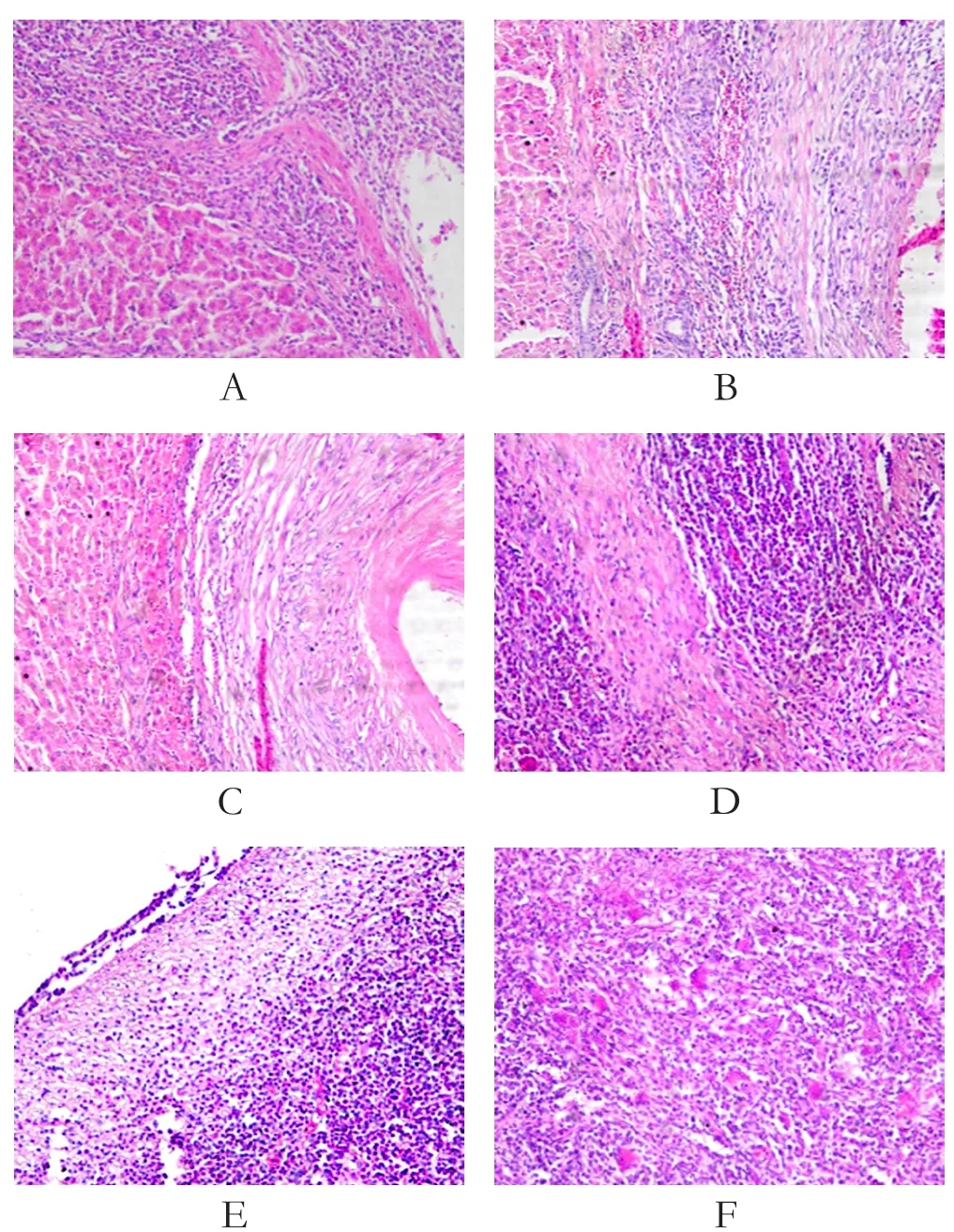
图5 感染羊肝脏组织纤维化和包囊形成Fig.5 Liver tissue fibrosis and cyst formation in infected sheep
2.6 细胞化学染色方法观察感染羊肝脏纤维化形成通过Masson细胞化学染色方法对病变肝组织特殊染色可见,原头蚴感染后肝脏的炎症反应、肝细胞坏死、组织纤维化形成均是以血管为中心所产生。随着炎症的发展,肝细胞坏死范围增加,血管周围纤维组织向炎症区域伸长,所形成的纤维组织沿残存肝细胞周围生长,形成包囊(图6)。
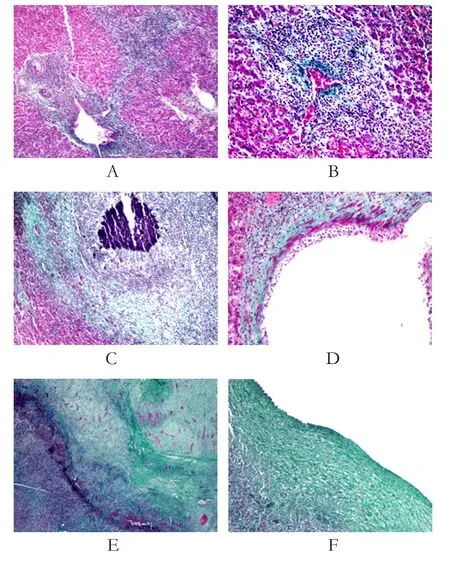
图6 细胞化学染色观察感染羊肝脏纤维化形成Fig.6 Cytochemical staining to observe liver fibrosis in infected sheep
3 讨论
细粒棘球蚴病(包虫病)是我国畜牧地区重要的人畜共患病,严重危害人类健康及畜牧业的发展[1]。其感染途径是由犬科动物(犬、狼)等终末宿主将细粒棘球蚴的虫卵和孕节随粪便排至体外,牛、羊等中间宿主吞食虫卵后而受感染。进入消化道的六钩蚴钻入肠壁,在消化液的作用下囊壁溶解,原头蚴附着在小肠壁上并开始发育。经血流或淋巴散布到体内各处,以肝脏、肺脏两处最多[3]。其中Eg95基因在细粒棘球绦虫六钩蚴侵入小肠绒毛上皮的过程中起重要作用[10]。
细粒棘球蚴对机体的损害可以局限在寄居部位,也可以扩展到机体的其他部位,其损害方式包括:机械损伤、夺取营养、毒素作用及引起的免疫反应。各种损害方式对机体的作用常导致细胞损害,表现为肝细胞的萎缩、凋亡和坏死等[11]。彭心宇等[12]在外科实践中发现囊型包虫寄生人体肝脏后致部分肝细胞“消失”的现象,尤以细粒棘球蚴寄生于肝左叶时此现象更明显,甚至肝左叶实质几乎完全“消失”,实验显示肝纤维化与“外膜”的形成相关,包囊可能是宿主对棘球蚴的免疫而发生异物反应形成肉芽肿样组织并不断纤维化增生的结果[13-14]。
目前对肝包虫囊肿周围纤维囊壁形成机制的认识观点略有差异。昊少廷等[15]研究发现,细粒棘球蚴寄生定位于肝脏后发育成囊肿,并不断增大挤压周围肝实质致成纤维细胞不断增生逐渐形成胶原纤维和纤维包膜即囊,外囊是肝实质纤维化的结果。Farrokh等[16]研究发现,外囊是一层被挤压的非上皮细胞化的纤维组织,与周围肝实质之间无解剖性分离间隙。顾树南等[17]提出,细粒棘球蚴寄生定位于肝脏后,由于人体免疫功能及肝脏的屏蔽作用,在棘球蚴周围的局部组织首先发生异物反应,炎性细胞包括嗜酸性粒细胞、浆细胞及多核巨细胞浸润渗出,由新生的成纤维细胞形成纤维结缔组织包膜包裹在棘球蚴周围形成外囊,这种纤维性的外囊与所寄生的肝脏组织无明显的分界不能分开。外囊壁并非虫体而是机体脏器组织发生局部纤维化所形成的屏壁。Milicevic等[18]研究发现,肝包虫囊肿的外囊来源于宿主器官组织内部包裹着血管及一些小的胆管外层被挤压萎缩的肝细胞,其与周围肝实质之间无明确界线,故外囊切除是非常困难的。
本研究在细粒棘球蚴感染肝脏包囊周围的肝实质组织呈现肝脏大范围局灶性坏死,肝细胞明显萎缩,体积显著缩小,散在肝细胞坏死,细胞核消失,细胞质空泡化,小血管(动脉、静脉)管壁纤维化、玻璃样变以及血管出芽。其原因可能是由于局部血管及胆管的纤维化引起的局部营养不良、淤血,原头蚴不断生长对肝组织的机械性压迫造成肝细胞萎缩(压迫性、营养不良性萎缩)[19]。本研究通过Masson细胞化学染色方法对病变肝组织特殊染色发现,原头蚴感染后肝脏的炎症反应、肝细胞坏死,组织纤维化形成均是以血管为中心所形成。随着炎症的发展,肝细胞坏死范围增加,成纤维细胞向炎症区域伸长,所形成的纤维组织沿残存肝细胞周围生长而形成包囊。
通过本研究结果分析,细粒棘球蚴感染肝脏包囊形成是机体受到虫体刺激后形成的纤维组织。随着包囊的不断增大,对机体的损伤越来越严重,病灶中心区域肝细胞大量坏死,炎症细胞渗出聚集,形成明显的炎症反应界限,成纤维细胞大量增生,炎症反应外周肝组织纤维化形成。包囊组织发生液化性坏死,包囊液形成,包囊开始发育。同时发现肝脏组织局灶性坏死,肝细胞萎缩、坏死、纤维化囊壁的形成都是围绕在血管周围,说明血管是原头蚴进入肝脏的主要途径而不是简单的附着在肝脏表面。上述研究尚属初步,血管病理及纤维化囊壁的形成是其生长过程中一种较普遍的病理现象,是与肝虫病诊断、治疗、愈后密切相关的一个病理学表现[20]。细粒棘球蚴对肝脏的致病机制还需通过建造小鼠模型进一步探索发现血管病理,纤维囊壁形成的时间节点,组织局灶坏死过程以及通过分子病理分析肝脏纤维化形成相关因子的作用等。
本研究通过对感染原头蚴绵羊肝脏包囊形成和肝细胞坏死的病理组织学、细胞化学、超微结构观察,发现原头蚴感染后病变产生于感染组织的血管周围,血管壁纤维组织分解、管壁出芽,分解并增生的纤维组织伸向周围炎症区域内,血管管腔及炎区大量嗜酸性粒细胞浸润,肝细胞萎缩、变性、坏死,增生的胶原纤维沿残存的肝细胞周围围绕病变组织包囊壁形成。

