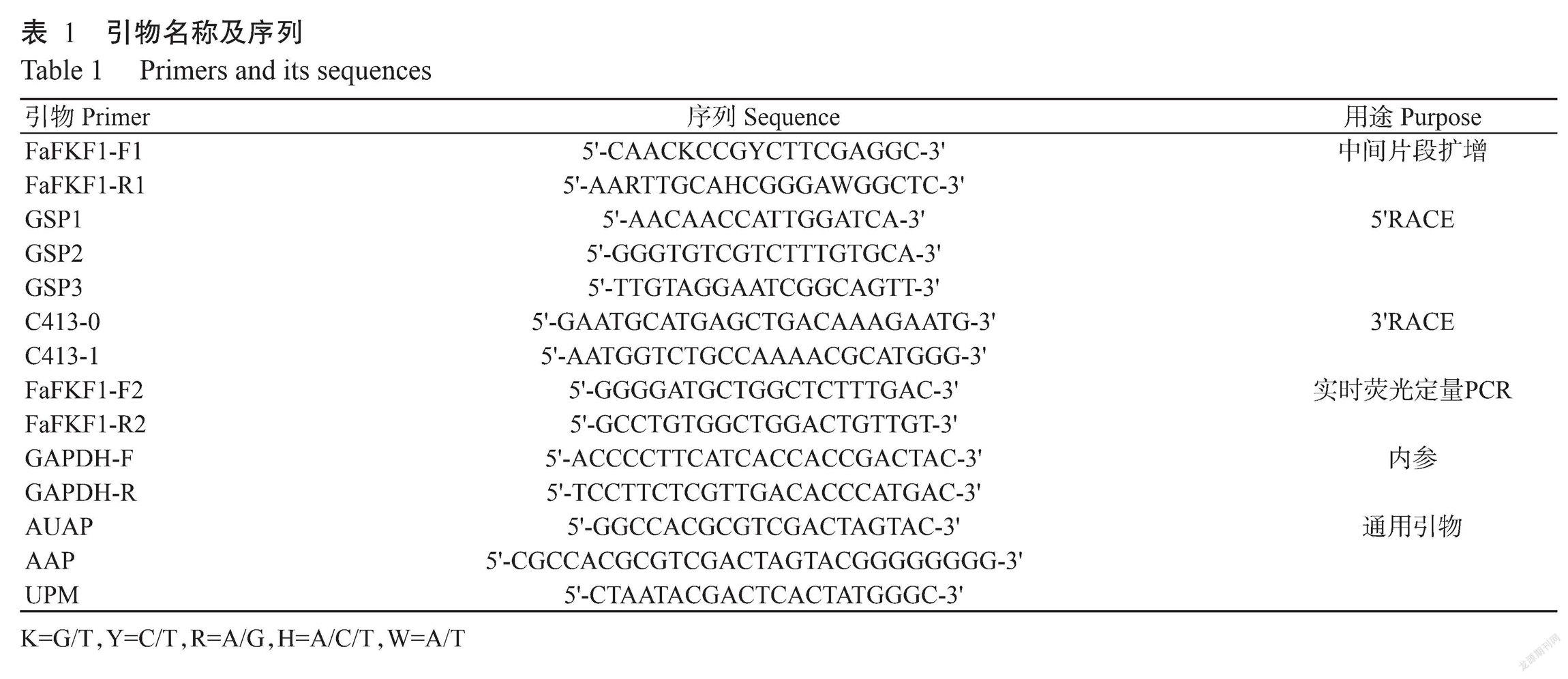
高羊茅FaFKF1基因克隆、亚细胞定位及节律表达分析
舒健虹 王子苑 刘晓霞 王小利
摘要:【目的】克隆高羊茅藍光受体家族基因(FaFKF1),分析其序列特征及亚细胞定位,并检测其在不同光照处理下的节律表达特征,为探索其在成花中的调控机制及高羊茅光周期适应性育种提供理论依据。【方法】采用RACE方法克隆FaFKF1基因cDNA全长序列,对其进行生物信息学分析,并构建pCAMBIA1300-FaFKF1-GFP融合表达载体,通过农杆菌介导转染烟草表皮细胞,观察荧光信号以确定蛋白亚细胞定位情况。同时,利用实时荧光定量PCR检测FaFKF1基因不同光照处理和不同生长阶段的节律表达特征。【结果】克隆获得FaFKF1基因cDNA全长为2266 bp,开放阅读框(ORF)为1881 bp,编码626个氨基酸残基,蛋白分子量为68.89 kD,理论等电点(pI)为5.76,脂肪系数为80.99,不稳定指数为39.81,属于较稳定的亲水性蛋白,亚细胞定位于细胞核。FaFKF1蛋白的二级结构包含α-螺旋(24.92%),无规则卷曲(44.89%)、延伸链(23.16%)和β-转角(7.03%)。FaFKF1蛋白与大豆(NP_001235886.2)、大麦(KAE8795993.1)和二穗短柄草(XP_003577479.1)的氨基酸序列相似性较高,为79.50%~87.68%,且与二穗短柄草FKF1蛋白的亲缘关系最近,其次是大麦和小麦。长日照处理下,FaFKF1基因在苗期、分蘖期、孕穗期和抽穗期的叶片中均有表达,相对表达量变化趋势也较相似,均在ZT8时(即下午16:00)达最高峰,呈现出24 h的昼夜节律,但在孕穗期和抽穗期的相对表达量明显较高。在长日照和短日照基础上施加不同光照处理下,FaFKF1基因均能通过自身调节来适应环境的变化,虽然表达峰出现时间不一致,但整体上能维持24 h的昼夜节律。【结论】FaFKF1基因在细胞核发挥作用,且在不同光照下均呈现节律表达,受光周期的诱导调控。
关键词: 高羊茅;FaFKF1基因;克隆;节律表达;亚细胞定位
中图分类号: S688.403.6 文献标志码: A 文章编号:2095-1191(2021)11-2941-11
Cloning,subcellular location and rhythmic expression analysis of FaFKF1 gene in Festuca arundinacea
SHU Jian-hong,WANG Zi-yuan,LIU Xiao-xia,WANG Xiao-li*
(Institute of Prataculture,Guizhou Academy of Agricultural Sciences,Guiyang 550006, China)
Abstract:【Objective】The blue light receptor family gene(FaFKF1) in Festuca arundinacea was cloned, its sequence characteristics and subcellular localization were analyzed, and its rhythmic expression characteristics under diffe-rent light treatments were detected, so as to provide a theoretical basis for exploring its regulatory mechanism in adult flowers and the adaptive breeding of F. arundinacea optoperiood. 【Method】The RACE technology was used to clone the full length cDNA of FaFKF1 gene. Its bioinformatics analysis was conducted. pCAMBIA1300-FaFKF1-GFP fusion expression vector was constructed, infected tobacco epidermal cells by Agrobacterium mediated transfection to observe the fluorescent signal to determine protein subcellular localization.Meanwhile, the rhythmic expression characteristics of different light treatments and different growth stages of the FaFKF1 gene were detected using real-time fluorescence quantitative PCR. 【Result】The sequence analysis results showed that the full-length cDNA(2266 bp) was obtained with a 1881 bp open reading frame(ORF),which encoded a small molecular protein containing 626 amino acids,the relative molecular weight of FaFKF1 protein was about 68.89 kD and its theoretical isoelectric point(pI) was 5.76,and the fat coefficient 80.99,instability index 39.81,which was a stable hydrophilic protein. Subcellular localization results showed that FaFKF1 was located in the nucleus. In the secondary structure of FaFKF1 protein, 24.92% of alpha helix,44.98% of random coil,23.61% of extended strand and 7.03% of beta turn were observed. FaFKF1 protein had the high amino acid sequence similarity with FKF1 of Glycine max(NP_001235886.2),Hordeum vulgare(KAE8795993.1), and Brachypodium dilatatum (XP_003577479.1),reaching more than 85%. And the genetic distance with B. dilatatum was the shortest, followed by H. vulgare and wheat. Under long-day treatment, FaFKF1 gene was expressed in leaves during seedling, tillering, booting and heading stages, and the relative expression trend was similar, all peaked at ZT8 (16:00 PM), showing a circadian rhythm of 24 h, but the relative expression was high in booting and heading stages. Under different light treatments based on long and short light exposure, the FaFKF1 gene could adapt to the environmental changes through autoregulation. Although the peak expression occurrence time was inconsistent, the overall circadian rhythm was maintained for 24 h. 【Conclusion】FaFKF1 gene may play an important role in the nucleus,and hasa rhythmic expression subcellular location under different lighting conditions,which is induced and regulated by the photoperiod.
Key words: Festuca arundinacea; FaFKF1 gene; cloning; rhythmic expression
Foundation item: National Natural Science Foundation of China(31860674); Special Fund Project of the Guizhou Science and Technology Platform and Talent Team(QKHPTRC〔2018〕5634); Science and Technology Plan Project of Guizhou (QKHPTRC〔2020〕5005)
0 引言
【研究意义】植物不仅利用光作为光合作用的能源,还能感知环境的变化,并调整其发育进程以提高其对当地环境的适应性(Zoltowski and Imaizumi et al.,2014)。开花是植物从营养生长到生殖生长的重要转变过程,并受内源节律基因和环境之间的相互作用调节。光周期是影响开花的重要环境因子,植物可通过感知光周期的变化启动内源相关开花因子来调节启动开花(Han et al.,2015;王亚梁等,2020)。高羊茅(Festuca arundinacea)属禾本科植物,需要长日照才能促进开花,但贵州日照时间短、土壤贫瘠、气候复杂,不能有效产生大量种子,目前高羊茅种子主要依靠进口。FLAVIN-BINDING KELCHREPEAT F-BOX 1(FKF1)基因对植物开花具有重要调控作用。因此,对高羊茅FKF1基因克隆并进行表达分析,探究FKF1基因在高羊茅光周期中的调控机制,对高羊茅的光周期育种具有重要意义。【前人研究进展】植物细胞含有多种不同类别的感光体,可吸收不同光谱的光,主要包括红/远红外光受体植物色素、蓝光受体、隐色色素和光蛋白(Chen et al.,2004)。从模式植物拟南芥中发现新的蓝光受体家族蛋白,包含3个成员,即FKF1、LOV KELCH(LKP2)和ZEITLUPE(ZTL),这些蛋白均参与昼夜节律和开花时间的调节(David et al.,2000;Takase et al.,2011)。其中,FKF1蛋白不仅是蓝光特异性受体,还是SKP-Cullin-Rbx-F-box(SCF) E3连接酶复合体的重要组成部分,首次发现于拟南芥晚花突变体中,其含有3个结构域,即LOV结构域(吸收蓝光)、F-box结构域和Kelch-repeat(Song et al.,2014)。FKF1基因位于开花促进基因(CONSTANS)CO和(Flowe-ring Locus T)FT基因的上游,可被蓝光激活呈节律性表达,表达高峰出现在黄昏时期 (Nelson et al.,2000;Imaizumiet al.,2003)。在光周期调控过程中,FKF1蛋白可诱导CO基因表达,且该过程具有光依赖性,从而说明FKF1基因的调控功能受光调节(Imaizumi et al.,2003)。在长日照条件下,fkf1突变体的开花明显延迟。ZTL和LKP2基因的mRNA表达高峰在早上,而FKF1基因的mRNA表達高峰出现在下午,其蛋白表达水平在傍晚达最大值,且具有节律性(Song et al.,2013)。FKF1基因和节律调控基因GIGANTEA(GI)的表达受生物钟控制,FKF1蛋白在调节CO转录时需要GI蛋白的参与(Fowler et al.,1999)。长日照下,FKF1蛋白与GI蛋白相互作用降解循环自由度因子CYCLING DOF FACTORS(CDF)并激活CO转录(Sawa et al.,2007)。FKF1蛋白还可调节CO基因在转录水平和转录后水平的稳定性(Song et al.,2012)。早上CDF转录因子抑制CO和FT基因表达;下午FKF1蛋白的活性被激活,与GI蛋白形成复合物,从而降解CDF并诱导CO和FT基因转录致使拟南芥提早开花(Fornara et al.,2009)。但短日照下,光线不足会降低FKF1蛋白对GI蛋白的亲和力,CDF升高,且无法诱导CO转录(霍轶琼,2019)。另有研究表明,FKF1蛋白能通过多种反馈机制(包括CO的转录调控和翻译后调控),诱导FT促进开花(Fornara et al.,2009)。大豆GmFKF1基因过表达植株在长日照下表现为晚花,在短日照下有一半植株表现为极早花(李芳,2012),说明GmFKF1基因与拟南芥FKF1基因的作用相反。水稻OsFKF1基因在长日照下能促进水稻开花,可互补拟南芥fkf1突变体的晚花表型(霍轶琼,2019)。【本研究切入点】综上所述,关于FKF1基因研究对象主要是大豆(李芳,2012)、拟南芥(Yuan et al.,2019)和水稻(霍轶琼,2019)。FKF1基因在不同类型植物中的功能可能存在差异。高羊茅作为多功能草种,具有较大的应用前景。但目前鲜见高羊茅FKF1基因(FaFKF1)的相关研究报道。【拟解决的关键问题】本研究以黔草1号高羊茅为试验材料,采用RACE和RT-PCR克隆FaFKF1基因并进行生物信息学分析,通过构建GFP融合表达载体转化烟草进行亚细胞定位分析,同时运用实时荧光定量PCR分析不同光照处理及不同发育阶段的表达模式,为进一步探讨FKF1的生物学功能提供理论参考。
1 材料与方法
1. 1 试验材料
供试的高羊茅品种为黔草1号,由贵州省草业研究所培育而成,2005年通过国家牧草新品种审定。TRIzolTM RNA提取试剂盒、Taq DNA聚合酶和SYBR Green I荧光定量染料均购自宝生物工程(大连)有限公司;琼脂糖DNA回收试剂盒购自OMEGA公司,RevertAid First Strand cDNA Synthesis Kit购自Fermentas公司,RACE试剂盒购自TaKaRa公司;引物合成及测序由生工生物工程(上海)股份有限公司完成。主要仪器设备:RXZ型智能人工气候箱(宁波江南仪器厂)、实时荧光定量PCR仪(Eppeddorf,德国)、DYY-6C型琼脂糖电泳仪(北京六一仪器厂)和凝胶成像系统(Bio-Rad GelDoc)。
1. 2 材料种植及光照处理
选取饱满的高羊茅种子,流水清洗后用70%消毒酒精进行表面消毒,离心后弃上清液,用ddH2O冲洗3次,再用0.7%次氯酸钠溶液消毒15 min,离心弃上清液后用ddH2O冲洗。待种子干后均匀点播在MS培养基上,用封口膜封口后4 ℃进行春化。将营养土与蛭石按1∶1比例混合装盆,提前用水浇透。待培养基上的幼苗长出3~4片叶子时移栽至小花盆中,花盆中加入少许蛭石。将花盆置入光照培养箱中,其中长日照处理(LD,22 ℃,16 h/8 h)、短日照(SD,22 ℃,8 h/16 h),48 h后调节光照培养箱至连续光照(LL)和连续黑暗(DD)处理48 h,最后给于光照/黑暗(L/D,22 ℃,16 h/8 h)和黑暗/光照(D/L,22 ℃ 16 h/8 h)循环模式,定期浇营养液管理。待生长一个月后从早上8点(ZT0)开始取样,每4 h取样一次,分别表示为ZT4、ZT8、ZT12、ZT16和ZT20,连续取样48 h。
1. 3 总RNA提取及cDNA第一链合成
于幼苗期取0.1 g新鲜高羊茅叶片加入液氮研磨,参照TRIzolTM RNA提取试剂盒说明书提取总RNA,置于-80 ℃冰箱保存备用。取1 μg总RNA,1.0 μL oligo(dT)引物,根据RevertAid First Strand cDNA Synthesis Kit说明书反转录合成cDNA第一链,于-20 ℃保存备用。
1. 4 FaFKF1基因cDNA序列克隆
1. 4. 1 中间片段扩增 采用ClustalX设计FaFKF1基因中间片段的2条简并性引物FaFKF1-F1/FaFKF1-R1(表1)。以cDNA为模板进行FaFKF1基因中间片段扩增,反应体系50.0 μL:2×PCR Buffer for KOD FX Neo 25.0 μL,10 mmol/L dNTP Mix 1.0 μL,Ex Taq DNA聚合酶1.0 μL,cDNA模板5.0 μL,上、下游引物FaFKF1-F/FaFKF1-R(10μmol/L)各1.5 μL,ddH2O補足至50.0 μL。扩增程序:94 ℃预变性2 min,94 ℃ 30 s,55 ℃ 30 s,72 ℃ 1 min,进行35个循环,PCR产物4 ℃保存备用。用1.8%琼脂糖凝胶检测PCR产物,利用胶回收试剂盒回收纯化后送至宝生物工程(大连)有限公司测序进行测序。
1. 4. 2 5′RACE 根据中间片段序列,利用Primer Premier 5.0设计3条特异性5′RACE引物。向反应管中加入SuperScript II RT酶和引物GSP1合成cDNA第一链,随后用RNase Mix去除RNA,对纯化后cDNA进行末端加上多聚C,从而获得dC-tailed cDNA模板。将反应管置于冰上进行第一轮PCR扩增:10×PCR Buffer 5.0 μL,25 mmol/L MgCl2 3.0 μL,10 mmol/L dNTP Mix 1.0 μL,10 μmol/L 引物GSP2和AAP各2.0 μL,dC-tailed cDNA模板5.0 μL,Taq DNA聚合酶0.5 μL,加无菌水补足至50.0 μL,扩增程序同上。再用GSP3引物和通用扩增引物AUAP(10 μmol/L)进行第二轮PCR扩增,用1.8%琼脂糖凝胶电泳检测扩增产物,然后切胶回收纯化目的条带,与pMD18-T连接后,挑选阳性克隆进行测序。
1. 4. 3 3′RACE 使用逆转录酶SMARTScribeTM Reverse Transcriptase对总RNA进行逆转录合成cDNA,利用引物C413-0和UPM进行第一轮PCR扩增:10×Advantage 2 PCR Buffer 5.0 μL,10 mmol/L dNTP Mix 1.0 μL,50×Advantage 2 Polymerase Mix 1.0 μL,cDNA模板2.5 μL,10 μmol/L C413-0 1.0 μL,10 μmol/L UPM 5.0 μL,PCR-Grade Water补足至50.0 μL。扩增程序:94 ℃预变性2 min,94 ℃ 30 s和72 ℃ 3 min,进行5个循环;94 ℃ 30 s、70 ℃ 30 s 、72 ℃ 3 min,进行5个循环;94 ℃ 30 s,68 ℃ 30 s,72 ℃ 1 min,进行27个循环。将第一轮PCR产物扩增后稀释50倍加入引物C413-1和UPM进行第二轮PCR,反应体系和程序同第一轮。按照上述方法对PCR产物回收纯化后测序。
利用DNAMAN 6.0将以上3个扩增片段的测序结果进行拼接,从而得到目的基因的cDNA全长序列,将其提交至NCBI数据库进行比对分析并预测其起始密码子和终止密码子。
1. 5 生物信息学分析
利用DNAStar 6.0将拼接获得的cDNA全长序列翻译成氨基酸序列,BLAST比对后并下载同源性较高的部分序列;利用ProtParam(http://www.expasy.org/tools/protp-aram.html)预测分析蛋白的理化性;利用ProtScale(https://web.expas-y.org/cgi-bin/pro-tscale/protscale.pl)进行蛋白的亲/疏水性预测分析;利用SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/secpredsopma.pl)分析蛋白的二级结构组成;利用MEGA 5.0构建系统发育进化树。
1. 6 亚细胞定位
将FaFKF1基因连接至pCAMBIA1300-GFP载体上,以构建pCAMBIA1300-FaFKF1-GFP融合表达载体,将其转化GV3101农杆菌感受态细胞,在含硫酸卡那霉素的LB固体培养基过夜,随机挑选1个单菌落进行菌落PCR鉴定。加入的乙酰丁香酮(AS)和吗啉乙磺酸(MES),28 ℃摇床培养OD值约1.0左右。常温下4000 r/min离心10 min,15 min收集菌体,用含MgCl2重悬菌体至OD值为1.0,加入AS,静置3 h以上,然后用注射器吸取侵染液注射到叶片内作为处理组,以空载体pCAMBIA1300-GFP的烟草叶片为对照组,72 h后取样通过激光共聚焦荧光显微镜检测荧光信号。GFP激发光为488 nm,DAPI激发光为405 nm。
1. 7 基因表达分析
分别称取长日照转连续光照(LD-LL)和连续黑暗(LD-DD)、短日照转连续光照(SD-LL)和连续黑暗(SD-DD)、光照和黑暗循环(L/D和D/L)处理下幼苗期的叶片及长日照处理下不同生长阶段(苗期、分蘖期、孕穗期和抽穗期)的高羊茅叶片各0.1 g,提取总RNA,并反转录合成cDNA第一链,具体方法与1.3相同。将合成的cDNA稀释20倍作为模板,以FaFKF1-F2/FaFKF1-R2为引物,GAPDH(GA)为内参基因,实时荧光定量PCR检测不同处理下高羊茅叶片FaFKF1基因的表达情况(罗维等,2020)。
1. 8 数据统计
利用2-△△Ct法计算FaFKF1基因的相对表达量,试验数据分析和图表绘制采用Excel 2010。
2 结果与分析
2. 1 高羊茅FaFKF1基因扩增
分别对FaFKF1基因的中间片段(673 bp)、5′端(406 bp)和3′端(1390 bp)序列进行PCR扩增,结果如图1所示。将三者进行拼接得到FaFKF1基因的cDNA全长序列,大小为2266 bp,开放阅读框(ORF)为1881 bp,编码626个氨基酸残基(图2)。
2. 2 生物信息学分析结果
将FaFKF1基因编码的氨基酸序列与其他物种的FKF蛋白进行BLAST对比,结果如图3所示。该序列与大豆(Glycine max,NP_001235886.2)、大麦(Hordeum vulgare,KAE8795993.1)、二穗短柄草(Brachypodium distachyon,XP_003577479.1)、高粱(Sorghum bicolor,XP_021317207.1)的FKF1蛋白氨基酸序列相似性较高,分别为79.5%、86.5%、87.68%和83.44%。
ProtParam分析结果显示,FaFK1蛋白分子式为C3037H4740N864O905S33,相对分子量为68.89 kD,等电点(pI)5.76,不稳定指数为39.81,酸性氨基酸残基总数(Asp+Glu)为76,碱性氨基酸残基总数(Arg+Lys)为61,平均亲水系数(GRAVY)为-0.247,脂肪系数为80.99,说明该蛋白为较稳定的亲水性蛋白。ProtScale预测蛋白亲/疏水性结果显示,蛋白亲水性氨基酸均占70%,疏水性氨基酸均占30%,说明FaFKF1蛋白为亲水性蛋白(图4)。SOPMA二级结构分析结果显示,二级结构包含无规则卷曲(占44.89%)、α-螺旋结构(占24.92%)、延伸链(占23.16%)和β-转角(占7.03%)(图5)。
将FaFKF1蛋白的氨基酸序列提交到NCBI数据库进行BLASTp比对分析,搜索下载不同物种的同源序列,采用MEGA 5.0构建系统发育进化树,结果如图6所示。FaFKF1蛋白与二穗短柄草、大麦和小麦的FKF1蛋白处于同一小分支,说明三者的亲缘关系较近,其中,与二穗短柄草FKF1的亲缘关系最近,与大豆、舞草和高粱FKF1的亲缘关系较远。
2. 3 亚细胞定位
将构建的融合表达载体pCAMBIA1300-FaFKF1-GFP通过农杆菌介导转染烟草表皮细胞,然后置于激光共聚焦显微镜下观察荧光信号,结果显示,对照组细胞核和细胞质可见明显的绿色荧光,处理组仅在烟草表皮细胞的细胞核检测到绿色荧光信号,即FaFKF1蛋白定位于细胞核中(图7)。
2. 4 FaFKF1基因的表达分析结果
2. 4. 1 长日照处理下FaFKF1基因在不同发育阶段的表达情况 利用实时荧光定量PCR检测长日照处理下FaFKF1基因在高羊茅苗期、分蘖期、孕穗期和抽穗期叶片中的表达情况,结果如图8所示。FaFKF1基因在不同生长阶段的叶片均有表达,整体呈现先上升后下降的趋势,且4个时期的相对表达量变化趋势也较相似,均在ZT8时(即下午16:00)达最高峰,呈现出24 h的昼夜节律。不同的是,FaFKF1基因在孕穗期和抽穗期的相对表达量明显增加。表明FaFKF1基因主要在抽穗前发挥调控作用。
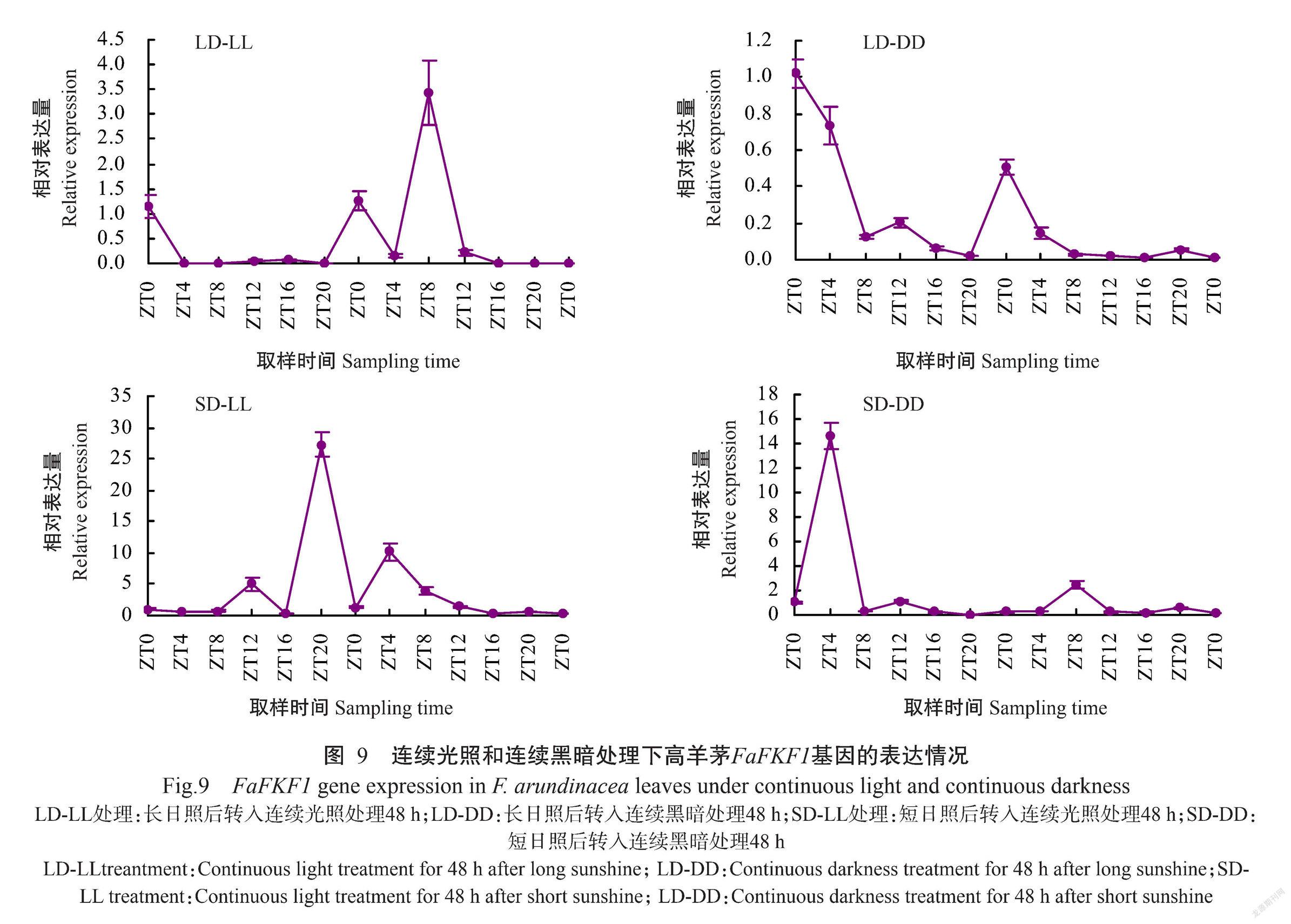
2. 4. 2 FaFKF1基因在长日照和短日照分别转入连续光照和连续黑暗下的表达情况 采用实时荧光定量PCR检测在长日照和短日照分别转入连续光照和连续黑暗处理下高羊茅叶片中FaFKF1基因表达情况,如图9所示。LD-LL处理下,FaFKF1基因在第1个光周期内ZT0时相对表达量最大,随着光照时间增加其相对表达量逐渐降低;在第2个光周期也是ZT0处出现一个小的表达峰,在ZT8时相对表达量最大。LD-DD处理下,FaFKF1基因在2个光周期的表达规律基本一致,且表达峰均出现在ZT0。SD-LL处理下,FaFKF1基因的相对表达量比LD-LL处理下的相对表达量高,在第1个光周期内ZT12处有1个小的表达峰,随后ZT20时相对表达量达最大值;在第2个光周期的表达峰提前,在ZT4时相对表达量达最大。SD-DD处理下,FaFKF1基因在第1个光周期的相对表达量高于第2个光周期,两个光周期的表达峰分别出现在ZT4和ZT8。综上所述,连续光周期处理后,FaFKF1的表达高峰出现的时间有所改变 ,说明FaFKF1基因能自我调节从而最大程度适应光照的改变。
2. 4. 3 FaFKF1基因在光照和黑暗循环处理下的表达情况 FaFKF1基因在L/D处理下的相对表达量最大,在光照ZT8时出现表达峰,第2个光周期ZT20即凌晨相对表达量最大(图10-A)。L/D-D/L处理下,FaFKF1基因的表达量较L/D处理急剧下降,表达峰都出现在ZT20(图10-B)。在D/L处理下,FaFKF1基因在第1个光周期开始相对表达量基本无变化,直到ZT16时开始增加,ZT20时达最大,并在第2个光周期内ZT4和ZT12有2个次级表达峰,最高峰仍出現在ZT20(图10-C)。L/D-L/D处理下,第1个光周期内相对表达量高于第2个光周期,且表达峰均出现在ZT12(图10-D)。综上所述,FaFKF1基因在光照时的表达水平高于黑暗时的表达水平。
3 讨论
自2000年FKF1基因被克隆以来,其功能不断被发掘(Nelson et al.,2000)。FKF1、ZTL和LKP2蛋白的结构相似,同属于ZTL家族,但三者在光周期调控植物开花途径中有所不同,其中,ZTL基因在短日照下对开花作用不明显,而LKP2基因无论长日照还是短日照均能增强拟南芥ztl突变体表型(Somers et al.,2004)。Takase等(2011)通过二级结构预测和三级结构建模确定FKF1蛋白含有LOV结构域,可形成稳定的二聚体,表明FKF1蛋白较稳定。本研究利用ProtParam预测发现,FaFKF1蛋白的不稳定系数为39.84(<40.00),推测其为稳定蛋白,与Takase等(2011)的研究结果一致。利用NCBI數据库将FaFKF1蛋白与其他物种同源蛋白进行BLAST对比分析,结果发现其与禾本科植物FKF1蛋白的氨基酸序列相似性较高,且系统发育进化树也显示FaFKF1蛋白与禾本科植物二穗短柄草、大麦和小麦的FKF1蛋白亲缘关系较近,进一步说明FaFKF1蛋白的进化关系稳定,具有一定的保守性。本研究将构建的融合表达载体pCAMBIA1300-FaFKF1-GFP通过农杆菌介导转染烟草表皮细胞,然后置于激光共聚焦显微镜下观察荧光信号,结果显示,FaFKF1蛋白定位于细胞核,与拟南芥(Tomoyuki et al.,2011)、大豆(李芳,2012)和玉米(刘玲,2014)的FKF1蛋白定位一致。
拟南芥AtFKF1基因在长日照处理下可促进开花,且表达峰出现在早上10点左右,在短日照下促进作用不明显(Imaizumi et al.,2003),其表达峰较长日照提前3 h。大豆GmFKF1转基因植株在长日照处理下表现大部分晚花,短日照处理下有一半表现为极早花。大豆GmFKF1基因在长日照下中午12点达表达峰,短日照下早上10点达最大(Li et al.,2013)。水稻OsFKF1基因在长日照下的表达峰时间与野生型(WT)相似,但比fkf1-2突变体要早。洋葱AcFKF1无论长日照还是短日照表达峰都出现在早上7~8点左右(Taylor et al.,2010)。关于FKF1基因表达的调控研究对象以大豆、水稻等植物居多,鲜见以高羊茅为材料的相关研究报道,其原因可能是高羊茅为六倍体,基因组信息了解较少,大多研究只停留在长日照和短日照光照处理方面。本研究在长日照和短日照基础上施加不同光照处理,结果发现无论给予何种光照处理,FaFKF1基因均能通过自身调节来适应环境的变化,虽然表达峰出现时间不一致,但整体上能维持24 h的昼夜节律。目前,研究发现拟南芥(Yuan et al.,2019)、水稻(霍轶琼,2019)等FKF1基因在不同组织中均有表达,且均在叶片中的表达水平最高。霍轶琼(2019)研究证实了FaFKF1基因在水稻中的表达量随着发育时期总体呈现先上升后下降的趋势。本研究对长日照处理下FaFKF1基因的表达模式进行分析,结果发现FaFKF1基因从早上8:00开始总体呈先升后降的趋势,该结果与水稻不同发育时期的表达相似(霍轶琼,2019)。在苗期、分蘖期、孕穗期和抽穗期其表达峰均出现在ZT8时,即下午16:00,后续可通过构建超表达载体和基因敲除等方法来进一步验证高羊茅FaFKF1基因的调控功能。
4 结论
FaFKF1基因在细胞核发挥作用,且在不同光照下均呈现节律表达,受光周期的诱导调控。
参考文献:
霍轶琼. 2019. O sFKF1调控水稻开花期的分子机理研究[D]. 沈阳:沈阳农业大学. [Huo Y Q. 2019. Molcular mechanisams of OsFKF1on regulating flowering time in rice[D]. Shenyang:Shenyang Agricultural University.] doi:10.27327/d.cnki.gshnu.2019.000005
李芳. 2012. 大豆FKF1和GI基因克隆、表达模式及功能分析[D]. 北京:中国农业科学院. [Li F. 2012. Molecular cloning,expression profiles and functional analysis of FKF1 and GI gene in soybean(Glycine max)[D]. Beijing:Chinese Academy of Agricultural Sciences.]
刘玲. 2014. 玉米光周期途径中蓝光响应节律基因ZmFKF1的分子进化与关联分析[D]. 成都:四川农业大学. [Liu L. 2014. Molcular evolution and association analysis of ZmFKF1,a clock-controled gene in maize[D]. Chengdu:Sichuan Agricultural University.]
罗维,舒健虹,刘晓霞,王子苑,牟琼,王小利,吴佳海. 2020. 高羊茅FaRVE8基因的克隆、亚细胞定位及表达分析[J]. 草业学报,29(7):60-69. [Luo W,Shu J H,Liu X X,Wang Z Y,Mu Q,Wang X L,Wu J H. 2020. Cloning,subcellular localization and expression analysis of the RVE8 gene from Festuca arundinacea[J]. Acta Prataculturae Sinica,29(7):60-69.]
王亚梁,朱德峰,陈惠哲,向镜,张义凯,徐一成,张玉屏. 2020. 水稻叶龄变化对短日长的响应[J]. 江苏农业学报,36(2):265-270. [Wang Y L,Zhu D F,Chen H Z,Xiang J,Zhang Y K,Xu Y C,Zhang Y P. 2020. Response of leaf age in rice to short day length[J]. Jiangsu Journal of Agricultural Sciences,36(2):265-270.]doi: 10.3969/j.issn.1000-4440.2020.02.002.
Chen M,Chory J,Fankhauser C. 2004. Light signal transduction in higher plants[J]. Annual Review of Genetics,38:87-117. doi:10.1016/S0070-2153(10)91002-8.
David E S,Thomas F S,Maureen M,Steve A K. 2000. ZEITLUPE encodes a novel clock-associated PAS protein from Arabidopsis[J]. Cell,101(3). doi:10.1016/s0092-8674(00)80841-7.
Fornara F,Panigrahi K C,Gissot L,Sauerbrunn N,Rühl M,Jarillo J A,Coupland G. 2009. Arabidopsis DOF transcription factors act redundantly to reduce CONSTANS expression and are essential for a photoperiodic flowering response[J]. Developmental Cell,17(1):75-86. doi:10.1016/ j.devcel.2009.06.015.
Fowler S,Lee K,Onouchi H,Onouchi H,Samach A,Richardson K,Morris B,Coupland G,Putterill J.1999. GIGANTEA:A circadian clock-controlled gene that regulates photoperiodic flowering in Arabidopsis and encodes a protein with several possible membrane-spanning domains[J]. Embo Journal,18(17):4679-4688. doi:10.1093/emboj/18.17.4679.
Han S H,Yoo S C,Lee B D,An G,Paek N C. 2015. Rice FLAVIN-BINDING,KELCH REPEAT,F-BOX 1(OsFKF1) promotes flowering independent of photoperiod[J]. Plant Cell Environment,38(12):2527-2540. doi:10. 1111/pce.12549.
Imaizumi T,Tran H G,Swartz T E,Briggs W R,Kay S A. 2003. FKF1 is essential for photoperiodic-specific light signalling in Arabidopsis[J]. Nature,426(6964):302-306. doi:10.1038/nature02090.
Li F,Zhang X,Hu R Ruibo Hu,Wu F,Ma J H, Meng Y,Fu Y F. 2013. Identification and molecular characterization of FKF1 and GI homologous genes in soybean[J]. PLoS One,8(11):e79036. doi:10.1371/journal.pone.0079036.
Nelson D C,Lasswell J,Rogg L E,Cohen M A,Bartel B. 2000. FKF1,a clock-controlled gene that regulates the transition to flowering in Arabidopsis[J]. Cell,101(3):331-340. doi:10.1016/s0092-8674(00)80842-9.
Sawa M,Nusinow D A,Kay S A,Imaizumi T. 2007. FKF1 and GIGANTEA complex formation is required for day-length measurement in Arabidopsis[J]. Science,318(5848):261-265. doi:10.1126/science.1146994.
Somers D E,Kim W Y,Geng R.2014. The F-box protein ZEITLUPE confers dosage-dependent control on the circadian clock,photomorphogenesis,and flowering time[J]. The Plant Cell,16(3). doi:10.1105/tpc.016808.
Song Y H,Estrada D A,Johnson R S,Kim S K,Lee S Y,MacCoss M J,Imaizumi T. 2014. Distinct roles of FKF1,Gigantea,and Zeitlupe proteins in the regulation of Constans stability in Arabidopsis photoperiodic flowering[J]. Proceedings of the National Academy of Sciences of the United States of America,111(49):17672-17677. doi:10. 1073/pnas.1415375111.
Song Y H,Ito S,Imaizumi T. 2013. Flowering time regulation:Photoperiod- and temperature-sensing in leaves[J]. Trends in Plant Science,18(10):575-583. doi:10.1016/j.tplants. 2013.05.003.
Song Y H,Smith R W,To B J,Millar A J,Imaizumi T. 2012. FKF1 conveys timing information for CONSTANS stabilization in photoperiodic flowering[J]. Science,336(6084):1045-1049. doi:0.1126/science.1219644.
Takase T,Nishiyama Y,Tanihigashi H,Ogura Y,Miyazaki Y,Yamada Y, Kiyosue T. 2011. LOV KELCH PROTEIN2 and ZEITLUPE repress Arabidopsis photoperiodic flowe-ring under non-inductive conditions,dependent on FLAVIN-BINDING KELCH REPEAT F-BOX1[J]. Plant Journal,67(4):608-621. doi:10.1111/j.1365-313X.2011.046 18.x.
Taylor A,Massiah A J,Thomas B. 2010. Conservation of Arabidopsis thaliana photoperiodic flowering time genes in onion(Allium cepa L.)[J]. Plant and Cell Physiology,51(10):1638-1647. doi:10.1093/pcp/pcq120.
Yuan N,Balasubramanian V K,Chopra R,Mendu V. 2019. The photoperiodic flowering time regulator FKF1 negatively regulates cellulose biosynthesis[J]. Plant Physiology,180(4):2240-2253. doi:10.1104/pp.19.00013.
Zoltowski B D,Imaizumi T. 2014. Structure and Function of the ZTL/FKF1/LKP2 group proteins in Arabidopsis[J]. Enzymes,35:213-239. doi:10.1016/B978-0-12-801922-1.00009-9.
收稿日期:2020-10-26
基金項目:国家自然科学基金项目(31860674);贵州省高层次创新人才培养项目(黔科合平台人才〔2018〕5634);贵州省科技计划项目(黔科合平台人才〔2020〕5005)
通讯作者:王小利(1977-),https://orcid.org/0000-0002-2868-9386,研究员,主要从事牧草分子生物学研究工作,E-mail:wangxiao-lizhenyuan@126.com
第一作者:舒健虹,(1972-),https://orcid.org/0000-0002-7899-3167,高级农艺师,主要从事牧草育种与生物技术研究工作,E-mail: gzsjhong@126.com

