1株非洲猪瘟病毒自然变异毒株的鉴定
张艳艳,张静远,杨金金,杨金梅,韩 桪,米立娟,张 菲,齐 宇,张守峰,王 颖,周鑫韬,岳慧贤,王述超,陈 腾,扈荣良
(军事科学院 军事医学研究院 军事兽医研究所,吉林 长春 130122)
非洲猪瘟(African swine fever,ASF)是由非洲猪瘟病毒(African swine fever virus,ASFV)感染引起的一种主要以家猪急性出血性疾病为特征的高感染率和高死亡率的烈性传染病,主要临床症状为发热、厌食、腹泻或便秘、卧地、皮肤发绀和全身性出血等。ASF于1909年首先发生于东非地区[1],随后扩散至欧洲、南美洲国家[2],21世纪初扩散至东欧国家和地区[3],但大部分国家均通过扑杀政策和严格的生物安全措施实现了家猪ASF的消除[4-5],除了非洲地区和意大利萨丁岛呈地方性流行以外,欧洲地区的野猪群中ASF自流行以来持续存在[6]。2018年8月,我国首次报告家猪ASF[7-8],随后在各省区相继暴发疫情,流行速度较快,死亡率较高,曾一度导致我国生猪、猪肉及相关产品出现供应紧张局面。亚洲其他一些国家也陆续报道ASF流行情况[5]。目前,在我国ASF常态化防控政策下[9],各养殖企业纷纷采取“拔牙”等方法控制疫情或采用高楼养猪、网格化管理等不同生物安全防范措施防止ASF发生。按照国家统计局和农业农村部发布的数据,至2020年9月,我国能繁殖母猪数量已达到3 822万头,能繁母猪逐渐恢复[10]。
经过2年流行,ASF疫情在我国大多数地区已不再呈现暴发式发生,流行趋势逐渐放缓,但在不少地区出现了临床症状表现趋多,死亡率逐渐降低,发病不易察觉等情况。
ASFV是一种线性的有囊膜的双链DNA病毒,是非洲猪瘟病毒科、非洲猪瘟病毒属的唯一成员,也是唯一的媒传DNA病毒[5]。病毒全基因组长170~194 kb[11-12],变异程度较高。基因组编码160多种蛋白。根据p72结构蛋白基因3′端序列可将ASFV分为24个基因型[13],不同基因型或同一基因型的不同分离株毒力差异较大[14],感染猪表现超急性型、急性型、亚急性型、慢性型和亚临床感染症状[15]。在ASF呈现地方性流行的非洲和意大利萨丁岛等地区均发现了不同基因型或不同毒力株,ASFV自然变异株不断有报道,如OUR T88/3[16](Ⅰ型,低毒力)、NH/P68[17](Ⅰ型,低毒力)、Lv17/WB/Rie1[18](Ⅱ型,低毒力)、Estonia 2014[19](Ⅱ型,低毒力)都是从田间分离得到的自然变异株,这些毒株均残留某种程度的毒力,可引起如关节炎、皮肤溃疡等。可以预测,随着我国ASF流行时间的延长,ASFV自然变异株也将不可避免地陆续出现。
为了充分了解ASF在我国的流行特点,我们进行了ASF临床调研,并开展了病原生态学监测,在疫情流行特征与早期流行表现不同的地区的自由菜市场采集了样品。采用世界卫生组织(OIE)推荐的实时荧光定量PCR (qPCR)方法对组织样品进行检测,进而采用p72(B646L)及CVR、p30(CP204L)、EP153R-EP402R和MGF505-3R等基因引物对阳性样品做进一步扩增和测序分析,并进行了病毒分离和全基因组测序。结果表明,我国可能已经出现了不同于早期ASFV流行株的毒力自然变异株。
1 材料与方法
1.1 细胞原代猪肺泡巨噬细胞(PAM),无菌采自无猪源性病毒污染的家猪肺脏组织。
1.2 样品带骨的猪肌肉组织,分别购买自吉林、河北、湖北3个省的自由菜市场。
1.3 主要试剂Premix Taq(Ex Taq Version 2.0 plus dye)和Premix Ex Taq(Probe qPCR)为TaKaRa公司产品;RPMI 1640 培养基为Gibco公司产品;特级胎牛血清为呼和浩特草原绿野生物公司产品;裂解液由本实验室自制;FITC-p30单克隆抗体由本实验室制备。
1.4 主要仪器组织研磨仪为上海净信实业发展有限公司产品;Eco实时荧光定量PCR仪为Illumina公司产品。
1.5 样品处理用灭菌的不锈钢药匙从带骨猪肉的骨髓中刮取黄豆粒大小样品,加入500 μL PBS(0.01 mol/L,pH7.2),在组织研磨仪中研磨30 s(100次/s),离心后取上清液备用。取50 μL上清液加入50 μL裂解液,沸水中5 min,12 000×g离心1 min,取上清进行后续PCR扩增。
1.6 引物qPCR和PCR扩增各基因所对应的引物信息见表1。
1.7 PCR扩增
1.7.1反应体系和反应条件 针对ASFV诊断时,采用OIE推荐的qPCR方法;针对p72、p30、CVR、EP153R-EP402R、MGF505-3R基因测序时,采用普通PCR方法。qPCR检测出的阳性样品需进一步进行普通PCR扩增和产物测序。qPCR和普通PCR反应体系均为20 μL:Premix Taq(Ex Taq Version 2.0 plus dye)或Premix Ex Taq(Probe qPCR)10 μL,上下游引物(10 μmol/L)各1 μL,模板2 μL,灭菌蒸馏水补足至20 μL。qPCR反应条件:95℃ 30 s;95℃ 5 s,60℃ 45 s,40个循环。PCR反应条件:95℃ 5 min;95℃ 30 s,57℃ 30 s,72℃ 30~150 s,35个循环;72℃延伸10 min。
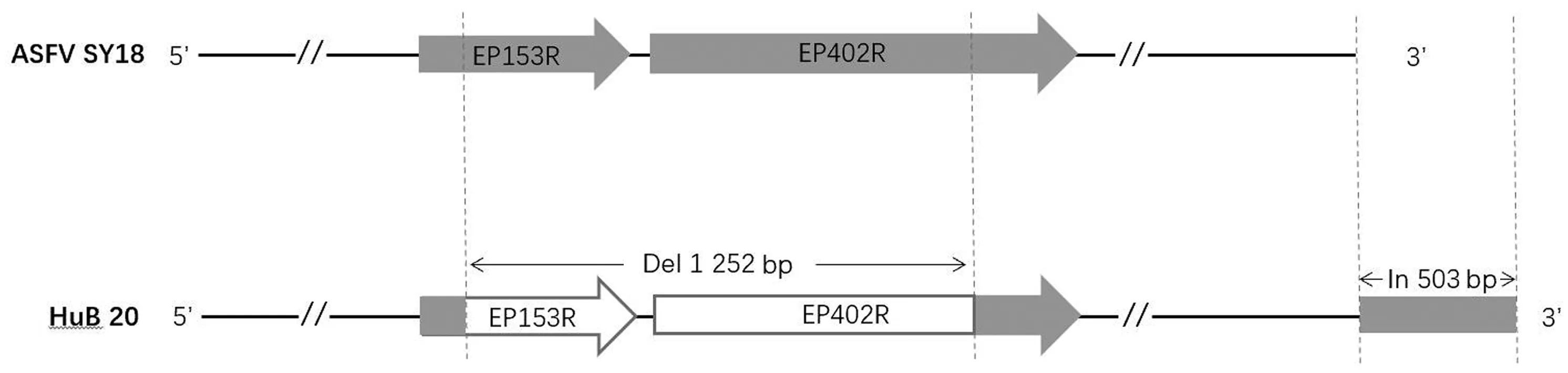
1.7.2结果判定 qPCR结果判定:Ct值≤38 判为ASFV阳性,无Ct值判为阴性。38 PCR结果判定:PCR产物经1%琼脂糖凝胶电泳,OIE-p72引物扩增产物出现278 bp、CVR引物扩增产物出现763 bp、p30引物扩增产物出现344 bp、MGF505-3R引物扩增产物出现357 bp、EP153R-EP402R引物扩增产物出现2 250 bp特异性条带时,判定为阳性,否则,判为阴性。各引物扩增产物大小见表1。 表1 ASFV基因检测引物信息 1.8 病毒培养和病毒特性测定 1.8.1病毒培养 qPCR检测为阳性和疑似阳性的样品上清液,按5%比例接种原代PAM细胞,在37℃、5%CO2培养箱中培养96~120 h。培养过程中,每日显微镜下观察。待细胞出现病变后,将细胞培养皿(瓶)在-20℃以下的低温环境中冻融2次,分装保存。 1.8.2病毒含量测定 将PAM细胞铺于96孔板,2.5×106个/孔,在37℃、5%CO2培养箱培养。将0.1 mL 病毒液与0.9 mL细胞培养液混合,再取混合液0.1 mL与0.9 mL细胞培养液混合,依次获得7个倍比稀释液,每个稀释度加入8个PAM细胞孔,每孔0.1 mL。37℃、5%CO2条件下培养3 d后,使用80%冷丙酮、4℃条件下固定细胞30 min,弃丙酮,晾干,加入0.1 mL 工作浓度的FITC荧光标记的p30单克隆抗体稀释液,在37℃避光孵育1 h;使用PBS(含0.5% Tween 20)洗涤3次,静置3 min/次,荧光显微镜下观察。病毒培养和含量检测的操作均在BSL-3实验室进行。 1.8.3血吸附特性 根据OIE推荐方法[20],略作改良,采用原代PAM细胞进行血吸附特性试验。简言之,将100 μL PAM细胞铺于96孔板,1×106个/孔,2 h后,将细胞培养物50 μL接种于PAM细胞(5 MOI)的96孔板上,同时设ASFV SY18毒株(本实验室2018年分离自国内首次ASF疫情,为强毒株,具有血吸附特性)感染PAM细胞和正常PAM细胞对照。感染24 h后,将0.5%猪红细胞按30 μL/孔加入96孔板,孵育0.5~3.0 d,显微镜下观察。 1.9 扩增产物测序、全基因组测序、验证和分析将普通PCR扩增的阳性产物送至吉林省库美生物科技有限公司测序。利用在线网站(https://blast.ncbi.nlm.nih.gov/Blast.cgi)对测序结果进行同源性搜索和比对,分析核苷酸序列的同源性。对新分离毒株的细胞培养物利用二代测序技术(北京诺禾致源生物信息科技有限公司)进行病毒全基因组测序,与SY18毒株全基因组序列(MH766894.2)比对,分析新分离毒株是否出现其他变异位点。对于出现变异的核苷酸位点,根据其所在基因或核苷酸片段位置两侧的核苷酸序列合成引物,同上方法PCR扩增后送吉林省库美生物科技有限公司测序进行验证,以确定突变。 2.1 PCR检测结果自吉林、河北、湖北3个省共随机购买带骨猪肉样品127份,通过qPCR方法检测到4份阳性样品。进一步采用p72(B646L)、p30(CP204L)、EP153R-EP402R、MGF505-3R基因引物进行扩增,其中,2~4号样品的p72(B646L)、p30(CP204L)、MGF505-3R、EP153R-EP402R基因的扩增条带大小和测序结果与SY18毒株的完全一致。而样品1中其他基因大小和序列与SY18毒株完全一致,但EP153R-EP402R基因的扩增条带大小与SY18毒株明显不同,扩增产物经过测序,其EP153R-EP402R基因均发生部分缺失,共缺失1 252 bp。 M.DL5000 DNA Marker;P.ASFV SY18毒株;1~4.样品1~4 2.2 病毒分离及生长特性利用PAM细胞针对样品1进行了分离培养,结果接种的PAM细胞出现了细胞肿胀、空泡等细胞病变,获得P1~P6代次细胞培养物,且第2,3代病毒含量分别为103.5,106.75TCID50/mL,随后逐渐升高,第6代时病毒滴度达107.25TCID50/mL,与SY18毒株细胞培养的病毒含量相似。 2.3 全基因组测序及验证结果分析通过第2代测序技术,对第6代细胞培养物提取基因组进行测序,获得ASFV基因组总长为188 643 bp。与国内提交GenBank的全部ASFV毒株相比,新分离毒株的基因组核苷酸变化主要表现在3个方面的差异:(1)发生EP153R基因和EP402R基因的部分大片段缺失,该区域与国内ASFV毒株的比对结果见图2,可以看出,EP153R基因为3′端部分缺失,CD2v为5′端部分缺失,缺失总长度为1 252 bp。(2)在多个基因编码区和基因间隔区出现碱基突变、缺失或插入(表2),这些突变和国内已经发表的10个ASFV毒株基因组中的碱基均不相同,具有本毒株特异性,其中部分突变导致编码氨基酸的改变乃至开放阅读框(ORF)的改变,后者包括多肽链的截短或延长,或失去编码蛋白的功能。(3)基因组3′末端503 bp串联重复片段的插入,与国内毒株比对结果见图3。 基于以上结果,故认为该毒株为我国ASFV的1个新变异株,故将其命名为HuB20株。与ASFV SY18毒株相比,其基因组结构简图如图4所示。 2.4 血吸附特性HuB20株和ASFV SY18毒株分别感染PAM细胞 24 h后,在96孔板接种细胞的每孔中加入30 μL 0.5%猪红细胞悬液,继续放置37℃、5%CO2培养箱中培养。12 h后,感染ASFV SY18毒株的PAM细胞即出现了红细胞吸附现象,感染HuB20株的PAM细胞和正常细胞未观察到红细胞吸附。至加入红细胞72 h,感染HuB20株的PAM细胞和正常细胞仍无红细胞吸附(图5)。 自2020年初以来,我国ASF不再呈大规模暴发流行,多表现疫情减缓,临床症状不明显,发病猪场死亡率30%~40%。根据农业农村部通报,2020年下半年以来,我国ASF疫情仅有零星发生,说明我国ASF的大流行可能已经过去。由于一些疫情发生地ASF临床症状大多不明显,死亡率不高,与急性型ASF相比,在流行早期难以发现,采用之前的所谓“拔牙”等手段很难将ASF清除,场内感染较难控制。本实验室根据承担的课题任务开展了ASFV的主动监测,在我国某些ASF疫情发生地区的自由菜市场购买了带骨的猪肉样品,经检测证明样品具有一定比例的带毒率。本研究中鉴定的自然变异毒株,其样品来自湖北某地,但由于样品来源于集市,故具体发病猪场不详,不能完全排除其来源于进口猪肉的可能。根据我们在当地询问的情况,样品来源地为ASF流行缓慢、病死率较低的地区。针对该毒株毒力的验证研究正在进行中。 p72基因末端的测序结果表明,4个阳性样品均为ASFV基因Ⅱ型,p72、p30等基因序列未发生改变,但其中样品1(命名为HuB20株)CD2v和EP153R基因处发生了缺失。从缺失的位点来看,CD2v为5′端部分缺失,其上游的EP153R基因也发生了3′端部分缺失,缺失总长度为1 252 bp。这和目前已知实验室在研疫苗的CD2v缺失区域不同,在该处无荧光蛋白基因插入或人为设计的核苷酸序列。为了对该流行株进行更为全面的分析,我们开展了全基因组二代测序。与国内提交的不同株ASFV的全基因组比对后发现,该毒株有多处独有的碱基变化。除了在EP153R、CD2v处发生缺失外,第2个明显的变化是位于基因组3′末端的503 bp串联重复序列的插入,该插入片段与国内毒株Wuhan2019-1基因组5′末端的部分序列高达77%同源性,与国内其他毒株基因组3′末端达28%同源性,与很多国外ASFV基因组的两端序列高度同源,有的高达96%;第3个明显的变化是在A238L、I9R等多个基因的编码区出现碱基突变、缺失或插入,导致编码氨基酸的改变乃至开放阅读框变化。这些缺失、插入、突变是否和国内报道的疫情状况相关联,需要进一步通过动物试验进行验证。 灰色区域为同源性100%,蓝色区域为无同源性;虚线区域为HuB20株独有序列,与其他序列无同源性 该自然变异株体外表型的变化导致其血吸附特性丧失。ASFV的血吸附特性据报道与CD2v有关。CD2v由EP402R基因编码,与T细胞CD2黏附受体同源,直接参与了ASFV在感染细胞中诱导的血吸附现象[22]。EP153R基因的表达产物C型凝集素由153个氨基酸组成,包含1个中央跨膜区、1个C型动物凝集素样结构域和1个细胞附着(RGD)序列,与人及动物CD44分子氨基酸序列具有较高同源性。有报道认为,CD2v的血吸附特性的稳定性似乎与C型凝集素有关联[23]。文献中报道的血吸附特性丧失的自然变异株包括NH/P68、OUR T88/3、Lv/17/WB/Rie1等。其中,OUR T88/3是2004年从西班牙猪场软蜱中分离得到的,为基因Ⅰ型,其缺失核苷酸片段较大,与本自然变异株不属于同一基因型[24]。NH/P68为慢性感染猪场中分离到的1株弱毒,也是基因Ⅰ型,其血吸附特性的丧失是因CD2v基因中碱基突变导致读框发生移位所致[17]。Lv/17/WB/Rie1株是2017年从野猪体内分离到的一个基因Ⅱ型的自然弱毒株,无血吸附特性,则是由1个核苷酸缺失导致读框移位提前终止所致[18]。本变异株血吸附特性的丧失与国外报道的毒株均不一样,是因基因片段的缺失所致。因此,据我们所知,本变异株(HuB20株)应为我国境内首次出现和鉴定的无血吸附特性及毒力可能致弱的自然变异株。 灰色区域为所有毒株同源性100%,蓝色区域为HuB20株独有序列;虚线区域为其他毒株同源区域 表2 HuB20株单(或多重)核苷酸变异统计表 续表2 图4 新分离ASFV HuB20株与国内毒株基因组差异 图5 ASFV HuB20变异株和SY18毒株血吸附结果 HuB20株在体外的复制能力未受到影响。GLADUE等[25]在ASFV-G-Δ9GL基础上对CD2v和EP153R进行缺失,缺失毒的生长曲线显示,ASFV-G-Δ9GL/ΔCD2v/ΔEP153R在PAM细胞中复制能力低于ASFV-G-Δ9GL和ASFV-G-Δ9GL/ΔCD2v,后两者的复制能力无差异,三者的复制能力均低于亲本毒株Georgia 2007;说明9GL和EP153R基因对病毒复制可能具有重要影响。但本实验室在对HuB20株培养过程中发现,最初3代病毒繁殖滴度较低,后期病毒增殖滴度和SY18毒株没有明显差别,在没有9GL基因缺失的情况下,EP402R、EP153R的联合缺失对于病毒的复制并未产生明显影响。但由于本变异株中存在多处碱基变化,不能排除其他基因的改变对本病毒的体外复制产生了有利影响。 自然变异株的产生,可能系多方面原因促成。首先,我国生猪养殖基数大,品种多,ASFV在不同种群中长期存在,为病毒在不同易感性猪品种内的适应和变异提供了机会;第二,随着ASF大流行的过去,耐过猪数量增多,在抗体和免疫选择的压力下,病毒出现变异是可能的;第三,ASFV本身的特性决定了其易变的可能。其基因组长度变异较大,不同毒株为170~194 kb,一般认为其中间125 kb为恒定区,左侧38~47 kb和右侧13~15 kb为可变区,病毒自然发生变异的频率较高[26]。本研究证明的自然变异株仅为我国某一地区的分离株,可能是众多变异株中的1株,不能排除在我国其他地区出现了其他变异株的可能。因此,有必要加强监测,根据流行和变异株的特征来调整和确定防控策略。 另外,根据ASFV的遗传特性,在不实行扑杀的常态化疫情防控措施下,尤其是目前很多养殖场通过“拔牙”的方法,或使用免疫增强药物,或使用基因工程改造的微生态制剂以及试图使用治疗药物控制疫情的情况下,都将会随着流行时间的延长以及对野毒株流行的“纵容”,加速变异株的产生。因此,加强对ASF流行病学和分子流行病学的监测,应当是我们每个兽医从业者尤其是研究人员的责任。 自然变异株的出现,都是病毒为了自身更好地生存而作出的繁殖策略的改变,与体内复制有限、不能水平传播的人工缺失致弱株相比,自然变异株在猪体内更容易生存和繁殖,也更容易在猪群中散播。自然变异株由于致病力发生一定程度减弱,其传播不易引起注意,更容易造成大面积扩散,对其根除也将变得困难。因此,其危害性与引起最急性和急性型症状的强毒株相比更加隐蔽,因而更加广泛和严重,值得我国养猪行业的关注。应当毫不犹豫地清除自然变异株感染猪群,只有这样,通过生物安全清除ASF才不是空谈。
2 结果

3 讨论