5-氮杂-2′-脱氧胞苷对肺癌SPC-A1细胞增殖及SFRP1、MGMT甲基化蛋白表达的影响
华丛书,叶 静,陈 海,葛腾飞,陈晓宇
(1.安徽医科大学胸科临床医院,安徽省胸科医院胸外科,安徽 合肥 230022 ;2.安徽医科大学第二附属医院呼吸内科,安徽 合肥 230601;3.安徽医科大学形态实验中心,安徽 合肥 230032)
肺癌为常见的原发性肺部恶性肿瘤,其发病机制未明。在肺癌发生发展中,Wnt信号通路为保守的信号通路,通过细胞外因子与细胞膜跨膜受体结合,再由胞质连锁蛋白(β-catenin) 结合,进入细胞核内后,与核内转录因子等共同作用,激活靶基因[1]。从细胞生物学水平揭示肺癌的基因表达调控,可提高肺癌早期诊疗水平[2]。研究表明[3],在肺腺癌发病中,负调控因子分泌型卷曲相关蛋白1(secreted frizzled related protein 1,SFRP1)基因启动子区5′端CpG岛的甲基化是导致Wnt信号通路沉默的重要原因。O6-甲基鸟嘌呤-DNA 甲基转移酶(O6-methylguanine-DNA-methyltransferase,MGMT)为DNA修复酶,可移除鸟嘌呤O6-甲基的烷化基团,还原鸟嘌呤,防止细胞被烷化剂损伤而恶变[4]。DNA甲基转移酶抑制剂5-氮杂-2′-脱氧胞苷(5-aza-2′-deoxycytidine,5-Aza-CdR)具有与嘧啶类似的结构,可共价结合DNA甲基转移酶,抑制其酶活性,恢复甲基化的CPG岛的抑癌功能[5]。故SFRP1、MGMT基因去甲基化可能在肺癌发病中有一定作用,有望成为潜在的肺癌个体化治疗靶点[6]。目前,5-Aza-CdR对肺癌SPC-A1细胞甲基化基因、蛋白和机制影响未明,本研究拟体外观察5-Aza-CdR对肺癌SPC-A1细胞增殖、细胞迁移和凋亡的影响,探讨SFRP1和MGMT甲基化改变,旨在为临床早期诊疗肺癌提供实验依据。
1 材料与方法
1.1 材料与试剂人肺癌细胞株SPC-A1购于中国医学科学院上海肿瘤细胞库,本研究室保存并传代培养。5-氮杂-2′-脱氧胞苷(批号2352-33-5,上海物竞化工);兔抗人SFRPl多克隆抗体(货号 ABP55900,英国 Abcam公司),兔抗人MGMT多克隆抗体(货号 LS-C205541,美国LSBio),兔抗人GAPDH多克隆抗体(货号 SY0636,北京百奥莱博);DMEM培养基、胎牛血清(美国Gibco生物技术公司);甲基化特异性PCR试剂盒、TRIzol试剂盒、逆转录聚合酶链反应(RT-PCR)试剂盒(美国Introgen公司); PCR引物由上海生工生物有限公司合成。BCA蛋白定量试剂盒(美国Pierce公司);羊抗兔辣根过氧化物酶标记二抗(北京中杉金桥生物技术公司);青链霉素溶液、CCK-8试剂盒、ECL化学发光试剂盒(上海碧云天生物试剂公司),其他试剂为国产分析纯。倒置荧光显微镜(Ti2型,日本Nikon公司);酶标仪(IMARK型,美国BIO-RAD公司);凝胶成像分析系统(Chemi Doc型,美国BIO-RAD公司)。
1.2 人肺癌细胞株SPC-A1细胞培养和细胞增殖实验
1.2.1SPC-A1细胞培养 SPC-A1细胞培养于10%胎牛血清的DMEM培养基(内含1%青、链霉素双抗),置于37 ℃、饱和湿度、5% CO2培养箱中,每2 d更换液1次,至SPC-A1细胞70%-80%融合时,胰酶消化传代。
1.2.2CCK-8法检测不同浓度5-Aza-CdR对SPC-A1细胞增殖的影响 96孔培养板中,每孔加入100 μL的1.0×105个SPC-A1细胞,细胞贴壁后,加药处理,设不同浓度的5-Aza-CdR处理(0.5、1、3、5、10、30、60、100、200 μmol·L-1),以不含5-Aza-CdR(0 μmol·L-1)细胞培养液作为对照组,每孔细胞设5个复孔。培养24 h后,每孔加入10 μL CCK-8工作液,培养箱中继续作用4 h。酶标仪(芬兰雷勃公司)检测450 nm处测定吸光度(Absorbance,A)值。计算5-Aza-CdR对细胞SPC-A1细胞生长抑制率:细胞生长抑制率/%=(1-给药组A值/对照组A值)×100%。实验重复3遍。
1.3 划痕实验测定5-Aza-CdR对SPC-A1细胞迁移能力的影响将浓度为1.0×107·L-1的SPC-A1接种于6孔培养板培养24 h,弃去培养基,沿6孔板中轴线,使用微量吸管枪头在贴壁肺癌SPC-A1细胞表面划痕,PBS漂洗5 min×3次,去除细胞残渣,加入含5-Aza-CdR(终浓度0、3、10、30 μmol·L-1)的DMEM培养基,再在CO2培养箱中常规培养48 h,拍照,计算5-Aza-CdR对SPC-A1抑制细胞划痕愈合率,细胞划痕愈合率/%=(初始划痕宽度-48 h划痕宽度)/初始划痕宽度×100%。
1.4 Hoechst 33258荧光染色检测5-Aza-CdR处理后SPC-A1细胞细胞凋亡情况对数生长期的肺癌SPC-A1细胞,1 × 107个·L-1细胞接种于6孔板中,预先在6孔板中放入涂有多聚赖氨酸的盖玻片。37 ℃、5%CO2培养箱中孵育 24 h,并加入5-Aza-CdR(终浓度为 0、3、10、30 μmol·L-1),继续培养 48 h 后,取出盖玻片,丙酮固定10 min,PBS漂洗10 min ×3次;1% Triton X-100透化10 min,加入5 mg·L-1的Hoechst 33258染液,避光染色10 min,PBS 漂洗10 min×3次,封片,Nikon倒置荧光显微镜观察。
1.5 5-Aza-CdR处理SPC-A1细胞中SFRP1、MGMT mRNA表达SPC-A1细胞按每孔2×105个的密度接种于6孔板中,收集5-Aza-CdR(0、3、10、30 μmol·L-1)处理24 h的细胞,加入TRIzol裂解细胞后收取细胞悬液于1.5 mL EP管中,充分裂解;加入氯仿混匀,4 ℃离心15 min,取上清加异丙醇混匀,4 ℃离心10 min,沉渣加75%乙醇洗涤、离心;加入10 μL DEPC水,冰上溶解,分光光度计检测RNA浓度和纯度。按逆QPS-201转录试剂盒说明书反转录,Real-time PCR检测SPC-A1细胞中SFRP1mRNA、MGMT mRNA表达量,以GAPDH mRNA为内参,引物序列如下:SFRP1引物,F 5′-CGA GTTTGCACTGAGGATGA-3′,R 5′-CAGCACAAGCTT CTTCAGGTC-3′; MGMT引物,F 5′-AGTAGGAGGA GCGATGAGGAG-3′,R 5′-AGAAGCCACTCTCTTTCAC ATCT-3′; GAPDH引物,F 5′-AGGTGAAGGTCGGA GTCAACG-3′,R 5′-AGGGGTCATTGATGGCAACA-3′。PCR反应体系为10 μL、上游、下游引物各 1 μL、cDNA 2 μL、ddH2O 6 μL。根据2-△△Ct法计算各组相对SFRP1 mRNA、MGMT mRNA相对含量。
1.6 5-Aza-CdR处理SPC-A1细胞中SFRP1、MGMT蛋白表达1 × 107个·L-1对数生长期的SPC-A1细胞接种于6孔板,CO2培养箱中常规培养24 h,加入不同浓度(0、3、10、30 μmol·L-1)的5-Aza-CdR处理24 h,收集细胞,RIPA 裂解液提取总蛋白质,BCA试剂盒定量。30 μg蛋白质上样,SDS-PAGE凝胶电泳,蛋白分离、转膜,兔抗人SFRP1多克隆抗体(1 ∶2 000)、MGMT多克隆抗体(1 ∶1 500)、内参GAPDH(1 ∶2 500),4 ℃孵育过夜,再加入辣根过氧化物酶标记的羊抗兔二抗,37 ℃孵育2 h,ECL曝光、定影、显影。采用ImageJ 软件分析SFRP1/GAPDH、MGMT/GAPDH相对蛋白定量分析,实验重复3次,计算平均光密度值。
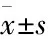
2 结果
2.1 5-Aza-CdR对SPC-A1细胞增殖的影响5-Aza-CdR作用SPC-A1细胞48 h后,CCK-8法检测SPC-A1细胞增殖情况,结果如Fig 1所示,与对照组(5-Aza-CdR 0 μmol·L-1)相比,5-Aza-CdR抑制SPC-A1细胞的增殖呈浓度依赖性(P<0.05,P<0.01),其IC50值为21.2 μmol·L-1。

Fig 1 Effects of different concentrations of 5-Aza-CdR on proliferation of SPC-A1 cells
2.2 不同浓度5-Aza-CdR对细胞划痕实验的影响划痕实验结果如Fig 2所示,5-Aza-CdR作用48 h后,不同浓度的5-Aza-CdR可抑制肺癌细胞的迁移能力,以对照组(0 μmol·L-1的5-Aza-CdR)为100%计算,浓度为3、10、30 μmol·L-1的5-Aza-CdR对肺癌细胞划痕愈合分别为(89.4±2.6)%、(73.6±4.2)%、(56.7±4.5)%。

Fig 2 Cell scratch experiments at different concentrations of 5-Aza-CdR for 48 h(×10)
2.3 Hoechst 33258 荧光染色检测5-Aza-CdR对SPC-A1细胞凋亡情况不同浓度的5-Aza-CdR处理肺癌SPC-A1细胞 48 h后,在荧光显微镜下,经紫外光激发,可见5-Aza-CdR(3、10、30 μmol·L-1)出现典型的肺癌SPC-A1细胞凋亡形态学改变,表现为核染色质浓缩、碎裂。而未给5-Aza-CdR的对照组(0 μmol·L-1)细胞核呈较为均匀的蓝色荧光,见Fig 3。

Fig 3 Fluorescence staining results of Hoechst 33258 (×200)
2.4 RT-PCR法检测甲基化mRNA表达情况肺癌SPC-A1细胞RT-PCR检测发现,与无5-Aza-CdR 作用时相比较,随着5-Aza-CdR处理浓度的升高,SPC-A1细胞中SFRP1 mRNA、MGMT mRNA呈上升趋势,且随着5-Aza-CdR浓度(3、10、30 μmol ·L-1)的升高,SFRP1 mRNA、MGMT mRNA显著升高,差异有显著性(P<0.05,P<0.01),见Fig 4。

Fig 4 Methylated mRNA expression in SPC-A1 cells after 5-Aza-CdR treatment detected by RT-PCR n=3)
2.5 Westernblot法检测甲基化蛋白表达情况肺癌SPC-A1细胞蛋白免疫印迹检测发现,无5-Aza-CdR 作用时,SPC-A1细胞中SFRP1、MGMT蛋白呈低表达状态;随着5-Aza-CdR处理浓度的升高,SPC-A1细胞中SFRP1、MGMT蛋白呈上升趋势,见Fig 5A。SFRP1/GAPDH、MGMT/GAPDH相对蛋白图像扫描半定量统计结果表明,且随着5-Aza-CdR浓度(3、10、30 μmol·L-1)的升高,SFRP1、MGMT蛋白表达较对照组升高,差异有显著性(P<0.05,P<0.01),见Fig 5B。

Fig 5 Effect of methylated protein expression in SPC-A1 cells after 5-Aza-CdR treatment detected by Western blot
3 讨论
肿瘤细胞DNA 异常甲基化是一种常见的表观遗传学改变,在基因碱基序列没有改变的情况下,通过碱基序列增减甲基而使基因结构改变,影响癌基因和抑癌基因表达;同时,也为临床治疗肿瘤、改变肿瘤遗传特性提供一种新的方法[2]。5-Aza-CdR是核苷类甲基化调节物,可以特异性抑制DNA 甲基转移酶活性,下调细胞周期的S期基因甲基化水平,阻断细胞甲基化反应,从而抑制肿瘤的生长[7]。本研究通过CCK-8法,检测5-Aza-CdR对人肺癌SPC-A1细胞生长的影响,结果表明,5-Aza-CdR对肺癌细胞增殖呈抑制作用,且该作用与5-Aza-CdR浓度呈正相关。
抑制肿瘤细胞侵袭转移和促进肿瘤细胞凋亡是临床肿瘤化疗的基础,本研究通过5-Aza-CdR作用肺癌SPC-A1细胞24h后,肺癌细胞迁移能力下降,且随着5-Aza-CdR浓度的增加而增多,提示5-Aza-CdR抑制肺癌细胞增殖活力的机制可能与其抑制肺癌细胞侵袭转移有关。凋亡形态学改变早期表现为核染色质的结构改变,DNA特异性染料Hoechst 33258通过A-T键结合,荧光显微镜观察细胞核可诊断[8]。本研究观察到Hoechst 33258荧光染色在无5-Aza-CdR作用下,细胞核荧光染色均匀一致,应用5-Aza-CdR后,出现典型的细胞凋亡形态,细胞核染色质浓缩或碎裂,且随着5-Aza-CdR浓度升高,该现象更加明显,表明5-Aza-CdR可诱导肺癌SPC-A1细胞凋亡。
肺癌的发生发展进程中,启动子区DNA甲基化是导致基因失活的重要原因,通过降低基因组甲基化水平或上升基因启动子区域甲基化,引起基因功能缺失,引起肿瘤发生;若能通过去甲基化抑制剂逆转启动子区DNA甲基化异常状态,则有可能发挥起抑制肿瘤生长的功效[9]。本研究证实,甲基化抑制剂5-Aza-CdR对肺癌SPC-A1细胞增殖有抑制作用。在机制研究中,异常激活的Wnt/β-catenin 信号通路可引起细胞恶变,SFRPs 类是Wnt通路的抑制因子,SFRP1 是SFRPs 家族成员,SFRP1 基因甲基在DNA 甲基转移酶调控下,把甲基(供体为S-腺苷甲硫氨酸)转移到胞嘧啶的第5 位碳原子CpG岛上,形成5-甲基胞嘧啶,引起SFRP1 表达降低,导致肿瘤的进展和转移[10]。本课题组前期证实,与癌旁组织比较,NSCLC 组织中SFRP1 基因甲基化率显著升高,且与肿瘤的分化程度和淋巴结转移相关[11]。DNA修复酶O6-甲基鸟嘌呤-DNA 甲基转移酶(MGMT)可移除鸟嘌呤O6-甲基的烷化基团,使鸟嘌呤还原,避免细胞被烷化剂损伤而产生恶变[4,12]。本实验采取不同浓度的5-Aza-CdR作用肺癌SPC-A1细胞株,观察作用前后SFRP1、MGMT表达,结果表明,在无5-Aza-CdR处理时,肺癌SPC-A1细胞中SFRP1、MGMT mRNA和蛋白呈低表达,5-Aza-CdR处理24 h后,去甲基化产物SFRP1、MGMT表达明显增多,且与5-Aza-CdR浓度相关。进一步证实5-Aza-CdR可激活并上调SFRP1、MGMT mRNA和蛋白表达,从而抑制肺癌SPC-A1细胞生长,具有抗肿瘤效应。
综上,本研究证实,DNA甲基转移酶抑制剂5-Aza-CdR可抑制肺癌SPC-A1细胞增殖,降低SPC-A1细胞侵袭转移,促进SPC-A1细胞凋亡,上调去甲基化产物SFRP1、MGMT mRNA和蛋白表达。本研究为将5-Aza-CdR应用于临床肺癌治疗提供一定的理论依据。

