苍术内酯II对骨关节炎大鼠软骨损伤、血清炎症因子和氧化应激的调节作用及机制研究*
杨光,惠越,陈奎,王伟,饶楚炳
1.湖北医药学院附属东风医院,湖北 十堰 442000; 2.十堰市太和医院,湖北 十堰 442000
骨性关节炎(osteoarthritis,OA)是常见于老年人群体中的一种慢性退行性关节疾病,其发病率随年龄的增长而升高,主要的病理改变表现为关节软骨缺损及软骨下骨质增生[1-2]。目前OA的发病机制依然不够清楚,但氧化应激、炎症因子、维生素D、肥胖等因素都被证明是OA的危险因素[3-4],其中炎性因子诱发的软骨细胞外基质的过度降解和软骨退化被认为是OA的主要因素[5]。苍术内酯II(atractylenolide II,AT-II)是从中药白术中分离的1种倍半萜烯,具有很好的抗炎、抗癌[6-8]及口服生物利用度,常用于治疗黑色素瘤[9]。目前鲜有AT-II用于OA治疗的相关研究。本研究通过木瓜蛋白酶制成OA大鼠模型,并用不同浓度AT-II处理3周后,观察AT-II对各组大鼠软骨损伤、细胞凋亡、炎症反应及氧化应激等过程的调控机制,以期为AT-II治疗OA提供相关理论依据。
1 材料
1.1 动物SPF级8~10周龄雄性SD大鼠30只,体质量260~280 g,购于武汉大学动物实验中心,动物合格证号:SCXK(鄂)2019-0004,饲养于十堰市人民医院SPF级饲养环境,许可证号:SYXK(鄂)2017-0098,培育室温度20~25 ℃,湿度保持在65%~70%,进行人工光照(12 h/昼、12 h/夜)。
1.2 药品与试剂苍术内酯II(中国食品药品检定研究院,货号180508);兔抗MMP-13、Coll-II、Aggrecan、Caspase-3、Caspase-9、Bcl-2、Bax、p-P65、P65、P-STAT3、STAT3、GAPDH多克隆抗体(美国Abcam公司,货号:180622、180509、180429、180713、180613、180521、180729、180524、180603、180512、180719、180515);超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(monochrome display adapter,MDA)、乳酸脱氢酶(lactate dehydrogenase,LDH)、谷胱甘肽(glutathione,GSH)试剂盒(武汉博士德生物技术有限公司,货号分别为:180118、180213、180321、180312);肿瘤坏死因子-α(tumor necrosis factor,TNF-α)、白细胞介素-1β(interleukin-1β,IL-1β)、白细胞介素-6(interleukin-6,IL-6)、白细胞介素-10(interleukin-10,IL-10)试剂盒(上海高创化学科技有限公司,货号分别为:170428、170524、170324、170329);总RNA提取试剂盒、反转录试剂盒及荧光定量PCR试剂盒(北京庄盟国际生物基因科技有限公司,货号分别为:ZP401、ZR102、ZF201);MMP-13、Coll-II、Aggrecan及β-Actin引物由上海捷瑞公司合成。
1.3 仪器小动物手术器械(北京众实嘉合生物科技有限公司);JT-P型石蜡包埋机(武汉俊杰电子有限公司);RM2235型病理切片机(德国徕卡公司);KD-P型组织摊片机(金华市科迪仪器设备有限公司);Olympus型光学显微镜(上海普赫光电科技有限公司);实时荧光定量PCR仪(德国Eppendorf公司)。
2 方法
2.1 动物模型制备及分组给药构建早期膝骨性关节炎大鼠模型[10]。将30只SD大鼠随机分为5组,腹腔注射10%的水合氯醛(3 mL·kg-1)麻醉,在第1、3、5 天给其中4组大鼠左膝关节腔内注射0.03 mol·L-1的L-半胱氨酸和5%(w/v)木瓜蛋白酶混合液,另外1组作为对照组注射等量生理盐水,注射后伤口用碘伏消毒,之后放于笼中,自由活动,密切关注伤口感染及其他并发症情况。注射生理盐水的大鼠作为对照组,其余4组分为模型组,AT-II(低、中、高剂量)组,各组大鼠均在造模后 48 h 开始给药。AT-II低、中、高剂量组分别进行腹腔注射5 mg·kg-1、10 mg·kg-1、20 mg·kg-1的 AT-II 溶液,对照组和模型组腹腔注射同等体积的生理盐水,连续给药3周,每天1次。
2.2 相关指标检测
2.2.1 染色检查大鼠软骨损伤情况将大鼠麻醉于冰盒上取膝关节胫骨内侧胫骨平台后1/2处,用手术刀剪成0.5 cm×0.2 cm×0.5 cm的小骨块,漂洗后用4%的多聚甲醛固定24 h,流水冲洗1 h用10%EDTA脱钙液脱钙2个月,行常规标本脱水,浸蜡,包埋制成石蜡块,连续切片为5 μm厚切片,进行HE、番红氧、Masson染色后,中性树胶封固,显微镜下观察软骨损伤情况。
2.2.2 qRT-PCR检测按照总RNA提取试剂盒说明书上操作步骤提取各组大鼠软骨组织中的总RNA,提取后用紫外分光光度计检验OD[(A260/A280)=1.8~2.0]值,并用凝胶电泳检测RNA的完整性。按照反转录试剂盒说明书进行 cDNA 的合成。反转录体系(10μL):2×miRNA反应混合液 5 μL,0.1%BSA 1 μL,miRNA PrimeScript®RT酶混合物1 μL,总RNA 0.5 μL,去RNA酶ddH2O 2.5 μL。反应条件设置:37 ℃ 60 min,85 ℃ 5 s,4 ℃ 30 min。PCR体系10 μL:SYBR®Prmix Ex Tap II(2×)5 μL,上游引物0.4 μL,下游引物0.4 μL,ROX Reference Dye II(50×)0.2 μL,cDNA 1 μL,ddH2O 3 μL。详细操作见试剂盒说明书。PCR反应参数设置:50 ℃激活聚合酶5 min,95 ℃预变性30 s,95 ℃变性5 s,60 ℃退火和延伸34 s,反应进行40个循环。溶解曲线绘制:95 ℃ 15 s,60 ℃ 60 s,85 ℃ 15 s,60 ℃ 15 s。每个样孔设置3个复孔。用2-△△Ct法计算mRNA的表达量。
2.2.3 Western blot检测提取大鼠软骨组织中的总蛋白,采用Bradford调整各组蛋白浓度一致,经SDS-PAGE凝胶电泳、电转膜至甲醛处理过预处理过的PVDF膜,密封2 h,加入兔抗人MMP-13、Coll-II、Aggrecan、Caspase-3、Caspase-9、Bcl-2、Bax、P-P65、P65、P-STAT3、STAT3、GAPDH一抗(1500)4 ℃孵育过夜,TBST漂洗40 min,加入HRP标记的二抗(1500)孵育1 h,TBST漂洗 40 min,ECL发光液将PVD膜显色,暗室曝光到X线片上,采用Image System软件分析各组条带灰度值,依据相对灰度值进行统计学分析。
2.2.4 血清中MDA、LDH、SOD、GSH水平的检测取大鼠外周血,离心后取血清,检测MDA、LDH、SOD、GSH水平。
2.2.5 血清中炎性细胞因子水平的检测取大鼠外周血,离心后取血清,利用EILSA法检测IL-1β、IL-6、IL-10、TNF-ɑ水平。

3 结果
3.1 AT-II改善模型大鼠软骨损伤情况HE染色显示,模型组大鼠关节软骨面骨裂隙形成,软骨面破坏达到移行层、辐射层、钙化层,且关节浅层表面逐渐缺失,深层细胞增生紊乱,用不同浓度AT-II处理后,关节软骨表面逐渐变得光滑,细胞增生情况减少,细胞排列变得较为规整,且潮线破坏程度降低。番红氧染色显示,模型组大鼠软骨出现大量的缺损及裂隙,细胞数减少,潮线消失,番红氧染色重度或完全失染,AT-II低剂量组软骨表面有裂隙生成,深达中间层,软骨细胞增多,同源细胞群增多,番红氧染色中重度失染,AT-II中剂量组软骨表明裂隙较少,表面平整,番红氧染色轻中度失染;AT-II高剂量组软骨表明无明显裂隙,表面平整,番红氧染色均匀,无失染情况。Masson染色显示,模型组大鼠软骨组织结构破坏明显,有大量炎性细胞浸润及红细胞渗出,软骨细胞间隔增宽,AT-II处理后能够显著减缓模型引起的软骨组织损伤,并减少了炎性细胞的浸润及红细胞的渗出,软骨细胞间的间隔变窄。见图1。

图1 HE、番红氧、Masson染色观察各组大鼠软骨损伤情况
3.2 AT-II抑制OA大鼠软骨组织细胞外基质降解qRT-PCR结果显示,与对照组相比,模型组大鼠软骨组织中MMP-13mRNA相对表达显著升高,CollagenIImRNA、AggrecanmRNA相对表达显著降低(P<0.01),与模型组相比,AT-II低、中、高组大鼠软骨组织中MMP-13mRNA相对表达显著降低,CollagenIImRNA、AggrecanmRNA相对表达显著升高(P<0.01)。见图2A。
Western Blot检测结果显示,与对照组相比,模型组大鼠软骨组织中MMP-13蛋白表达显著升高,Collagen II、Aggrecan蛋白表达显著降低(P<0.01);与模型组相比,AT-II低、中、高组大鼠软骨组织中MMP-13蛋白表达显著降低,Collagen II、Aggrecan 蛋白表达显著升高(P<0.01)。见图2B。
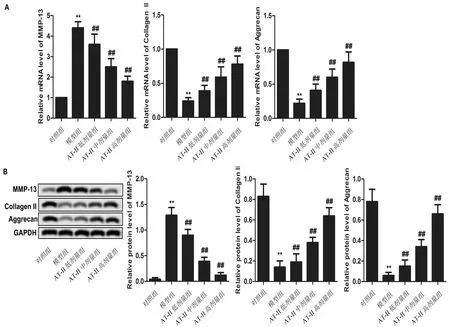
注:A:各组大鼠软骨组织中MMP-13 mRNA、Collagen II mRNA、Aggrecan mRNA相对表达情况;B:各组大鼠软骨组织中MMP-13、Collagen II、Aggrecan蛋白表达情况。与对照组相比,**P<0.01;与模型组相比,##P<0.01图2 AT-II对模型大鼠软骨组织中MMP-13、Collagen II、Aggrecan表达的影响
3.3 AT-II抑制模型大鼠软骨组织细胞凋亡Western Blot检测结果显示,与对照组相比,模型组大鼠软骨组织中Caspase-3、Caspase-9、Bax蛋白表达显著升高,Bcl-2蛋白表达显著降低(P<0.01);与模型组相比,AT-II低、中、高组大鼠软骨组织中Caspase-3、Caspase-9、Bax蛋白表达显著降低,Bcl-2蛋白表达显著升高(P<0.01)。见图3。

注:与对照组相比,*P<0.05;与模型组相比,#P<0.05图3 AT-II对大鼠软骨组织中细胞凋亡蛋白表达的影响
3.4 AT-II降低模型大鼠氧化应激反应与对照组相比,模型组大鼠外周血中SOD、GSH水平显著降低,MDA、LDH水平显著升高(P<0.01);与模型组相比,AT-II低、中、高组大鼠外周血中SOD、GSH水平显著升高,MDA、LDH水平显著降低(P<0.01)。见图4。
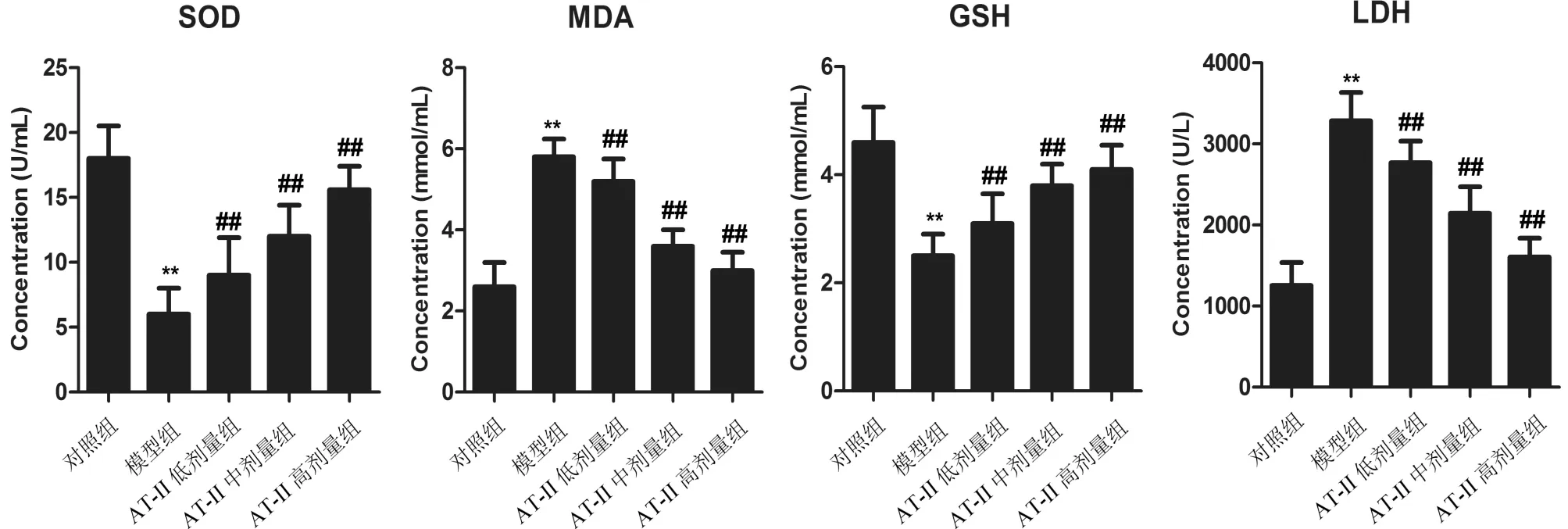
注:与对照组相比,*P<0.01;与模型组相比,##P<0.01图4 AT-II对大鼠血清中SOD、GSH、MDA、LDH水平的影响
3.5 AT-II降低模型大鼠炎症反应与对照组相比,模型组大鼠外周血中IL-6、IL-1β、TNF-α水平显著升高,IL-10水平显著降低(P<0.01),与模型组相比,AT-II低、中、高组大鼠外周血中IL-6、IL-β、TNF-α水平显著降低,IL-10水平显著升高(P<0.01)。见图5。

注:与对照组相比,**P<0.01;与模型组相比,##P<0.01图5 AT-II对大鼠血清中IL-6、IL-10、TNF-α、IL-1β水平的影响
3.6 AT-II抑制P65和STAT3蛋白磷酸化Western blot结果显示,与对照组相比,模型组大鼠软骨组织中p-P65/P65、p-STAT3/STAT3水平明显升高(P<0.05);与模型组相比,AT-II低、中、高组大鼠软骨组织中P-P65/P65、P-STAT3/STAT3水平明显降低(P<0.05)。见图6。
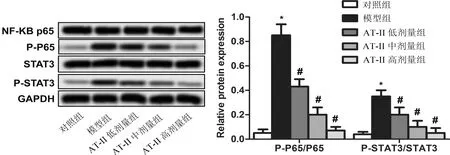
注:与对照组相比,*P<0.05;与模型组相比,#P<0.05图6 AT-II对模型大鼠软骨组织中P-P65/P65、P-STAT3/STAT3的影响
4 讨论
现有研究表明,OA是在机械性及生物性因素的相互作用下,导致关节软骨细胞、细胞外基质及软骨下骨降解及合成紊乱进而引起的一种退行性疾病[11]。关节软骨是由99%的软骨基质和1%的软骨细胞组成的。因此,软骨发挥正常的生理功能与其内组分的形态及代谢稳定关系密切[12]。Collagen II、Aggrecan是细胞外基质(ECM)的主要成分,当软骨组织遭受破坏时,会导致ECM异常降解,同时ECM的合成也减少,软骨组织退化加重,从而导致OA的发生[13-14]。MMP-13作为基质金属蛋白酶家族的重要成员,能显著降解EMC中的Collagen II、Aggrecan[15]。本研究结果显示,软骨组织染色发现,木瓜蛋白酶处理大鼠后,软骨细胞损伤严重,大量炎性细胞及红细胞渗出,骨裂隙明显,用不同浓度 AT-II 处理后发现软骨组织的损伤得到了不同程度的改善,且改善程度呈AT-II浓度依赖;还发现模型组大鼠软骨组织中Collagen II、Aggrecan表达明显降低,MMP-13表达显著升高,而不同浓度 AT-II 处理后,Collagen II、Aggrecan表达升高而MMP-13表达降低,表明AT-II处理能够抑制软骨组织EMC异常降解,促进EMC组分的合成,进而缓解OA的关节损伤。秦梦等[16]研究结果表明,MMP-13表达下调、Collagen II表达上调是EMC降解破坏改善的表现,本研究与前人结果一致,表明AT-II能够有效缓解EMC降解破坏引起的软骨组织损伤。
近年来有研究者发现,OA的严重程度与软骨组织细胞凋亡数量之间存在显著的相关性[17]。Caspase-3、Caspase-9作为细胞凋亡过程中发挥着重要作用的Caspase家族成员,是介导细胞凋亡的执行者,其表达水平上调会诱导细胞凋亡[18]。Bcl-2和Bax蛋白在调控细胞凋亡的过程中发挥着重要的作用,两者相互拮抗[19-20]。本研究结果显示,模型组大鼠软骨组织中Caspase-3、Caspase-9、Bax蛋白的表达显著升高,而Bcl-2的表达显著降低,而不同浓度AT-II处理后,Caspase-3、Caspase-9、Bax蛋白表达显著降低,而Bcl-2的表达显著升高,表明AT-II处理后能够显著抑制软骨组织中细胞凋亡,且浓度越高对细胞凋亡的抑制越强烈。
目前研究表明,炎症反应和氧化应激反应在OA的发生及发展中都发挥着非常重要的作用[21-22]。炎症细胞因子除能够影响软骨细胞的相关代谢之外,还可通过逐级放大级联反应,促使软骨细胞异常肥大,使软骨细胞外基质的分泌受到抑制,同时还会降解细胞外基质[23-24]。IL-1β是最为常见的一种促炎症因子,它除了自身可以促进软骨细胞炎症反应外,还可通过促进软骨细胞分泌NO、TNF-ɑ、IL-6等炎性因子,进一步激活其他炎症反应信号通路,促进软骨细胞外基质的降解[25]。正常情况下,机体内的活性氧物质会在SOD、GSH等的作用下保持动态平衡,当SOD水平升高功能受到损伤时,ROS水平也升高,会攻击线粒体DNA、酶、生物膜、蛋白质、核酸等物质,引起蛋白质变性、基因突变及脂质过氧化,导致膜结构及功能损伤[26];MDA就是脂质过氧化的最终产物之一,其水平标志着氧化应激状态[27]。本研究结果发现,AT-II处理能提高模型大鼠血清中SOD、GSH、IL-10水平,降低MDA、LDH、IL-1β、IL-6、TNF-α水平,表明 AT-II 处理能够显著改善模型大鼠的炎症反应及氧化应激反应。
NF-κB信号通路途径在机体内炎症、细胞凋亡、免疫等过程中发挥着重要调控作用,很多药物的抗炎作用都是通过抑制NF-κB信号通路来完成的[28-29]。JAK2/STAT3信号通路途径对多种疾病的发生发展都起到了重要的调控作用,STAT3的活化能够有效控制炎症反应并修复氧化损伤[30]。本研究结果显示,AT-II处理后,p-P65、p-STAT3蛋白表达降低,表明AT-II可能是通过抑制 NF-κB 和STAT3相关途径来调控大鼠的氧化应激及炎症反应过程。
综上所述,AT-II可能是通过抑制NF-κB和STAT3信号转导途径,抑制细胞凋亡蛋白表达,促进抗凋亡细胞表达,抑制软骨细胞凋亡;同时促进SOD、GSH的合成,恢复体内氧化还原平衡,减少对脂膜的攻击,降低氧化产物MDA、LDH的水平;提高抗炎症细胞因子IL-10水平,降低促炎性细胞因子IL-1β、IL-6、TNF-α等的水平,缓解软骨组织中的炎症反应,从而减轻大鼠软骨损伤。本研究初步揭示了 AT-II 治疗OA的相关机制,但还需要继续深入研究,为AT-II临床使用提供更有力的理论依据。

