MPT64在MTB利福平和异烟肼耐药性检测方法中的应用
杨瑜?李华?邓丽?雷杰?王楠?谢贝?吴玲?刘志辉?孟繁荣
【摘要】目的建立一種以MPT64为指标的结核分枝杆菌(MTB)耐药性检测的快速方法,探讨MPT64在MTB利福平(RFP)和异烟肼(INH)耐药性检测中的应用。方法 应用胶体金免疫层析法(GICA)分别检测MTB敏感株和耐多药株在含(观察组)与不含(对照组)RFP、INH的Middlebrook 7H9液体培养基上培养3、7、10 d的培养液中的MPT64,通过凝胶成像仪白光源拍照进行条带灰度分析(Image Jab Software 3.0),比较敏感株和耐多药株间的灰度比值的差异,依据受试者工作特征(ROC)曲线下面积(AUC)分析确定RFP、INH耐药的灰度比值界值;以比例法检测结果为金标准,评价新建方法的准确度、灵敏度、特异度、阳性预测值和阴性预测值。结果 对照组中,随着培养时间的延长,12株MTB敏感株和11株耐多药株的灰度比值增大;观察组中,敏感株在不同的培养时间的灰度比值没有显著变化,而耐多药株则明显增大。3、7、10 d敏感菌与耐多药菌在药物培养基中MPT64检测灰度比值差异均有统计学意义(P均< 0.05)。依据观察组灰度比值分别绘制以MPT64指示的RFP和INH耐药性检测的ROC曲线,两者的3 d
AUC分别为0.84和0.77,灰度比值界值均为0.05;7、10 d AUC均为1.00,7 d的灰度比值界值分别为0.23与0.20;10 d的灰度比值界值分别为0.49和0.48。GICA检测MPT64用于34株MTB的RFP、INH耐药性鉴定的准确度分别为97%和94%,灵敏度分别为93%和86%,特异度均为100%,阳性预测值均为100%,阴性预测值分别为95%和91%。结论 GICA检测MPT64于MTB培养7 d时能准确检测抗结核药物RFP、INH耐药性,MPT64可作为MTB药敏试验的有效检测指标。
【关键词】结核分枝杆菌;MPT64;药物耐药性;胶体金免疫层析法
Application of MPT64 in detecting rifampicin and isoniazid resistance in Mycobacterium tuberculosis Yang Yu, Li Hua, Deng Li, Lei Jie, Wang Nan, Xie Bei, Wu Ling, Liu Zhihui, Meng Fanrong. Institute of Pulmonary Diseases, Guangzhou Chest Hospital, Guangzhou 510095, China
Correspongding author, Meng Fanrong, E-mail: rendong.mfr@ 163. com
【Abstract】Objective To establish a rapid method for detecting drug resistance of Mycobacterium tuberculosis (MTB) by using an indicator of MPT64 and to evaluate the application of MPT64 in detecting rifampicin (RFP) and isoniazid (INH) resistance of MTB. Methods The expression levels of MPT64 in the Middlebrook 7H9 liquid medium containing (observation group) and non-containing (control group) RFP and INH, separately cultured by MTB sensitive strains and multidrug-resistant strains for 3, 7, 10 days were detected by using gold immunotomographic assay (GICA). The grayscale of the experimental strip was analyzed by photographs with white light source of gel imaging instrument (Image Lab Software 3.0). The grayscale ratio was compared between the sensitive and multidrug-resistant strains. The cutoff value of the grayscale ratio for RFP and INH resistance was determined based on the analysis of the area under the receiver operating characteristic (ROC) curve (AUC). The accuracy, sensitivity, specificity, positive and negative prediction values of this new method were evaluated with the proportional test results as the gold standard. Results With the prolongation of culture time, the grayscale ratios of 12 MTB sensitive strains and 11 multidrug-resistant strains were increased in the control group. The grayscale ratios of sensitive strains at different culture times did not change significantly in the observation group, whereas those of the multidrug-resistant strains were significantly increased. The MPT64 grayscale ratios of sensitive and multidrug-resistant strains in the drug medium significantly differed at 3, 7 and 10 days (all P < 0.05). According to the grayscale ratio in the observation group, the ROC curves of the RFP and INH resistance detection were plotted with the indicator of MPT64. On day 3, the AUCs of RFP and INH were 0.84 and 0.77, and the grayscale ratios were both 0.05. On day 7 and day 10, the AUCs were both 1.00. On day 7, the grayscale ratios were 0.23 and 0.20. On day 10, the grayscale ratios were 0.49 and 0.48. The accuracy of GICA in detecting RFP and INH drug-resistance of 34 MTB was 97% and 94%, 93% and 86% for the sensitivity, 100% and 100% for the specificity, 100% and 100% for the positive prediction value, and 95% and 91% for the negative prediction value, respectively. Conclusions MPT64 detection by GICA can accurately and rapidly identify the RFP and INH resistance on day 7 of MTB culture. MPT64 can be used as an effective detection indicator for MTB drug sensitivity.
【Key words】Mycobacterium tuberculosis;MPT64;Drug resistance;Gold immunochromatographic assay
MPT64是结核分枝杆菌(MTB)早期生长繁殖过程中大量分泌的一种蛋白,在非MTB和卡介苗株中不存在,是能快速鉴别MTB的重要抗原[1-2]。我们前期研究表明MPT64与MTB生长高度相关,可作为MTB生长指标,那么其是否可以作为抗结核药物药敏或耐药的检测指标呢[3-4]?理论上,体外液体培养MTB进行药敏试验时,若为敏感株,MTB生长抑制,MPT64分泌减少;相反,耐药则MPT64分泌不受影响。为此,本研究应用胶体金免疫层析法(GICA)对不同药物作用下不同培养时期的MTB上清液中MPT64进行检测,初步建立一种准确快捷、简单易行的药物耐药性检测方法,报道如下。
材料与方法
一、材 料
1.菌 株
实验所用的MTB菌株均源于我院的生物菌株库。菌株均已通过生化和分子方法鉴定为MTB以及通过药敏试验比例法鉴定为“敏感”或“耐多药”。
2.试剂与仪器
MTB抗原检测试剂盒(GICA)为杭州创新生物检控技术有限公司生产,Middlebrook 7H9/7H10培养基由美国BD公司生产,利福平(RFP)与异烟肼(INH)药物粉剂为美国SIGMA公司生产等;细菌超声分散仪BACspreaderTM 1100(体必康)、凝胶成像系统仪(BioRad)、细菌培养箱等。
二、方 法
1.复苏菌株
-80℃冰箱里取出冻存菌,置水浴箱快速解冻,吸取1 ml转接于约7 ml新鲜配置的7H9液体培养基1周,而后取200 ?l菌液涂布于斜面7H10固体培养基,置于37℃培养箱2 ~ 3周。
2.调整菌液浓度
分别刮取新鲜培养于7H10固体培养基上的12株MTB敏感株和11株耐多药株,置于生理盐水中,超声匀散为悬液,转移至15 ml离心管,
12 000 转/分离心10 min,弃上清;再加入7 ml生理盐水振荡混匀,离心弃上清,重复此步骤2 ~ 3次,充分去掉培养基斜面上分泌的蛋白。生理盐水重悬菌体并调整菌浓度为0.1(麦氏比浊管)备用。
3. MTB接种
分装对照培养基与药物培养基7 ml/管,其中药物培养基RFP与INH的终浓度分别为1.0 μg/ml和0.2 μg/ml。吸取上述各备用菌100 μl分别接种对照与药物培养基,即菌接种量为0.01 mg,于37℃培养。
4. GICA检测MPT64
于培养3、7、10 d收集培养上清,12 000转/分离心5 min,移取上清用于MPT64检测。取100 μl
上清加入检测板的样本孔内,室温放置15 min后观察结果。出现质控带表示结果有效,无质控带出现表示试剂失效,需重测。其中质控带和测试带都出现表示MPT64检测阳性,而只有质控带则表示检测阴性。应用凝胶成像仪白光源拍照进行条带灰度分析,设质控条带灰度值为“1”,计算灰度比值(样本检测带灰度值/质控带灰度值)
(Image Lab Software 3.0)。
三、鉴定实验
选择药敏结果(比例法)明确的34株MTB,其中比例法操作方法参考文献所述[5]。根据最佳检测时间和确定的灰度比值界值,进行GICA检测MPT64鉴定MTB的RFP及INH敏感性,比较新建方法与比例法的药敏结果,评估其准确度、灵敏度、特异度、阳性预测值和阴性预测值。
四、统计学处理
采用SPSS 17.0进行统计分析,非正态分布资料以中位数(下四分位数,上四分位数)表示,比较采用两独立样本的秩和检验。应用受试者工作特征(ROC)曲线确定GICA检测MPT64在MTB的RFP、INH耐药性检测中的界值。配对χ2检验用于GICA检测MPT64法与比例法检测药敏结果一致性的比较分析,P < 0.05为差异有统计学意义。
结果
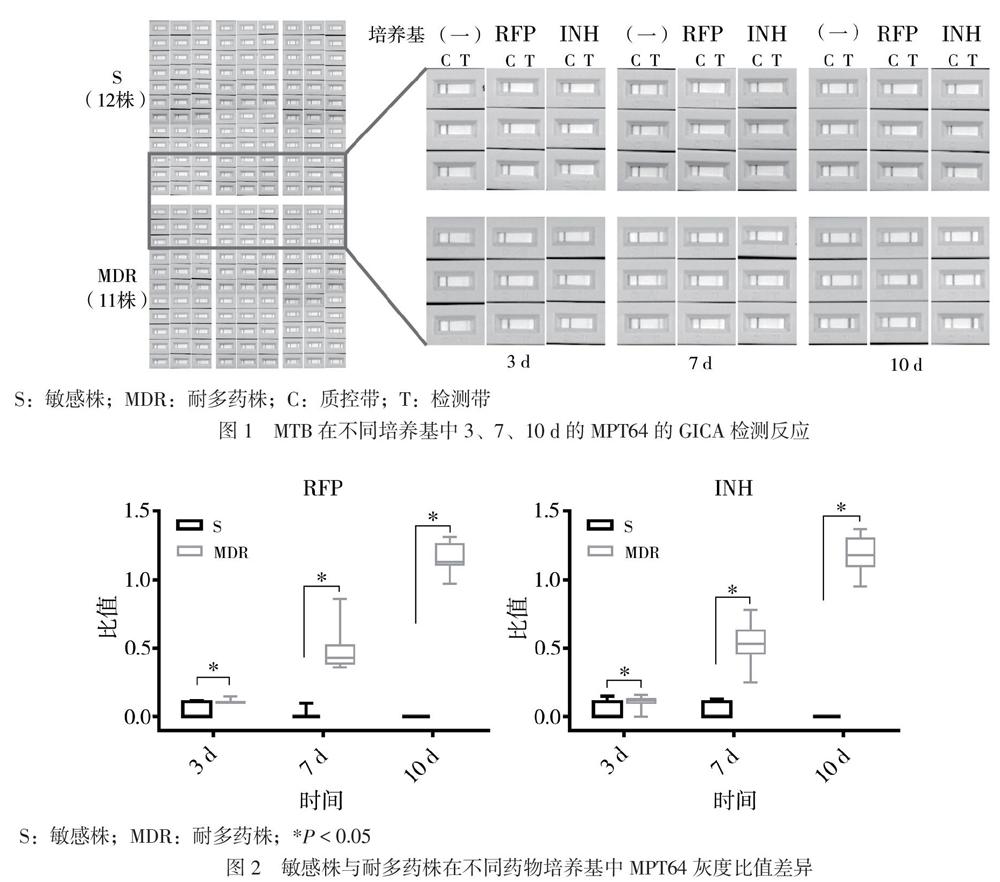
一、MTB在不同培养基中MPT64的GICA检测反应变化
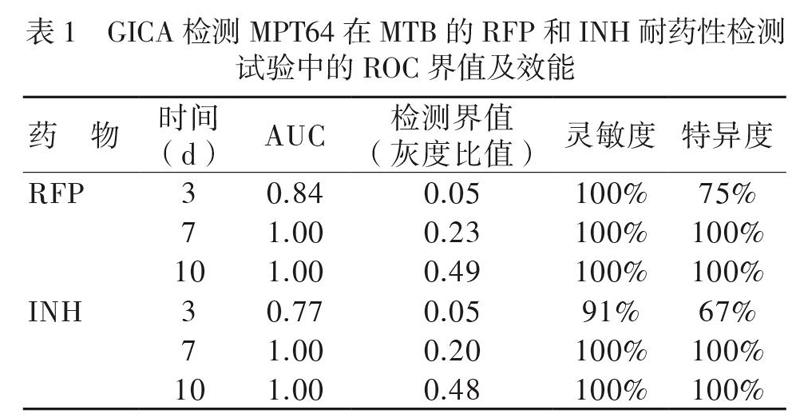
对照培养基中,随着培养时间的增加,MTB敏感株和耐多药株的样本检测带逐渐明显,培养7、10 d呈阳性反应;药物培养基中,敏感株各时间点检测带无明显变化,呈阴性反应,而耐多药株检测带逐渐明显,呈阳性反应,见图1。相应地,对照培养基中敏感株、耐多药株各时间点MPT64检测带的灰度比值增大;而药物培养基中敏感株各时间点MPT64检测带的灰度比值几乎为0,耐多药株则增大,见图2。培养时间3、7和10 d敏感株与耐多药株在RFP培养基中MPT64的检测带灰度比值均存在差异,Z值分别为2.892、4.304和4.387,P 均< 0.05。同样,在含有INH的培养基中,培养时间3、7和10 d敏感株与耐多药株MPT64的检测带灰度比值均存在差异,Z值分别为2.232、4.150和4.384,P 均< 0.05。
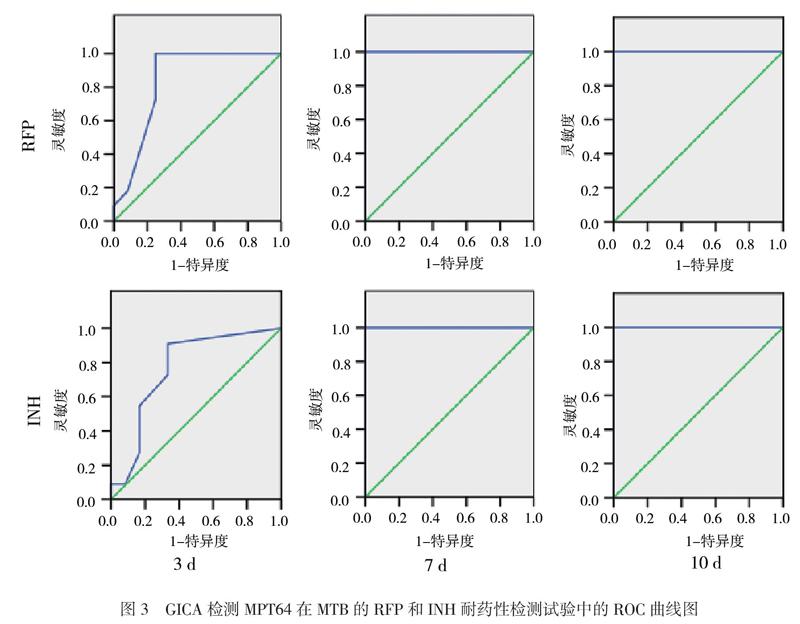
二、GICA检测MPT64在RFP和INH耐药性检测试验中的界值
依据观察組灰度比值分别绘制以MPT64指示的RFP和INH耐药性检测的ROC曲线,两者的3 d ROC曲线下面积(AUC)分别为0.84和0.77,灰度比值界值均为0.05;7、10 d的AUC均为1.00,7 d的灰度比值界值分别为0.23与0.20,10 d的分别为0.49和0.48,见表1和图3。本实验选择MPT64检测时间点为7 d,其RFP、INH的药敏判定界值分别为0.23和0.20,表示2种药物耐药性检测试验中,灰度比值大于0.23则为对RFP耐药,大于0.20则为对INH耐药。
三、应用界值鉴定MTB的RFP/INH耐药性
应用上述界值对34株MTB进行GICA检测MPT64,结果为对RFP耐药性检测21株为敏感株,13株为耐药株,与比例法的结果比较,差异无统计学意义(P = 1.000);对INH耐药性检测22株为敏感株,12株为耐药株,与比例法的结果比较,差异无统计学意义(P = 0.500)。以比例法的結果为金标准,GICA检测MPT64用于RFP、INH耐药性鉴定的准确度分别为97%和94%,鉴定RFP、INH耐药性的灵敏度分别为93%和86%,特异度均为100%,阳性预测值均为100%,阴性预测值分别为95%和91%,见表2。
讨论
MPT64是MTB重要的分泌蛋白之一,于MTB培养上清中大量表达,具有很强的抗原性,被广泛用于结核诊断、潜伏筛查以及疫苗研制等[6-7]。目前已有基于MPT64免疫层析检测的的商品化试剂盒得以开发,然而多用于快速鉴定MTB感染,少见用于耐药结核病的诊断[8-9]。GICA是一种快速的免疫反应检测法,其原理是将抗原或抗体固定在硝酸纤维素膜载体一端,待测菌液上清点在另一端,通过样品液体横向流动,与固定的抗原或抗体结合,阳性反应则颜色条带显示。本研究结果显示在对照培养基中,敏感株与耐多药株GICA反应均为阳性,说明在无药物压力下,2种菌株正常生长,随着培养时间的增长,培养上清中有大量的MPT64。当置于药物培养基时,尽管培养3 d时有些敏感株能检测到微量的MPT64(颜色条带显示非常弱),而7、10 d完全无颜色条带显示,表明敏感株在药物培养基中生长受到抑制,分泌MPT64显著减少;耐药株于3 d时为弱条带,但7、10 d可见明显的阳性反应条带,说明耐药株在药物培养基中生长未受到抑制,MPT64随着时间分泌增多。这与我们先前的实验结果MPT64可能为较好的药敏试验指示物相符[10]。
为了进一步评估GICA检测MPT64的RFP、INH药物耐药性检测效能,将该检测结果相对定量,即胶体金检测板拍照并条带灰度分析,获得灰度比值。经统计分析,我们发现培养3、7、10 d敏感株与耐多药株在RFP与INH药物培养基中MPT64检测灰度比值差异有统计学意义。然而通过ROC曲线分析,3 d MPT64检测判断RFP、INH药物耐药性的特异度偏低,分别为75%和67%;7和10 d判断该两种药物耐药性的灵敏度和特异度均为100%,以快速为目的,7 d是较为理想的检测点。34株MTB菌株GICA检测MPT64鉴定RFP和INH的耐药性,与比例法检测结果比较,配对χ2检验P值为1.000,说明2种检测方法无显著差异,结果有很好的一致性,且准确度较高。GICA检测MPT64判断RFP、INH耐药性均有较高的灵敏度和特异度。尽管已有研究表明MPT64可有效指示药敏试验结果,但仍需要仪器辅助判读,且只是针对RFP和INH两种药,是否能做到无需仪器,并适用于其他抗结核药物呢[11]?这是我们后续将要进行的实验,与此同时,扩大检测样本量,优化接种菌浓度和药物浓度,探讨更短检测时间点。另外据相关文献报道,部分MTB的MPT64表达基因存在突变,无法检测到抗原,会导致检测结果假阴性[12-13]。尽管MTB的MPT64基因突变概率低,但为了提高检测准确度,我们将同时检测MTB其他分泌蛋白,筛选最佳的分泌蛋白组合用于MTB药敏试验检测[14]。
综上所述,GICA检测MPT64能在7 d时准确快速鉴定MTB菌抗结核药物耐药性,并且不需要非常昂贵特殊的仪器。MPT64可作为MTB药敏试验的有效检测指标。
参 考 文 献
[1] Mannan A, Iram S, Ahmad A, Hussain S, Ahmad BM. Identification of TBc: using MTP 64 protein and cord formation. J Pak Med Assoc, 2017, 67(10):1600-1603.
[2] Purohit MR, Sviland L, Wiker H, Mustafa T. Rapid and specific diagnosis of extrapulmonary tuberculosis by immunostaining of tissues and aspirates with anti-MPT64. Appl Immunohistochem Mol Morphol, 2017, 25(4):282-288
[3] 许婉华,黄业伦,刘燕文,胡丽环,罗少珍,孟繁荣,刘志辉.应用MPT64分泌为结核杆菌生长指示的适宜检测时点研究.实用医学杂志,2012,28(13):2262-2264.
[4] 何霞,谭守勇,罗春明,蔡杏珊,刘志辉. 应用MPT64为靶标快速检测结核分枝杆菌生长的研究. 广东医学,2010,31(2):222-224.
[5] 綦迎成,李君连,陈美娟. 实用结核病实验室诊断.北京:人民军医出版社,2012.
[6] Bekmurzayeva A, Sypabekova M, Kanayeva D. Tuberculosis diagnosis using immunodominant, secreted antigens of Myco-bacterium tuberculosis. Tuberculosis (Edinb),2013,93(4):381-388.
[7] Sibley L, Reljic R, Radford DS, Huang JM, Hong HA, Cranenburgh RM, Cutting SM. Recombinant bacillus subtilis spores expressing MPT64 evaluated as a vaccine against tuberculosis in the murine model. FEMS Microbiol Lett, 2014, 358(2):170-179.
[8] Kumar N, Agarwal A, Dhole TN, Sharma YK. Rapid identification of Mycobacterium tuberculosis complex in clinical isolates by combining presumptive cord formation and MPT64 antigen immunochromatographic assay.Indian J Tuberc,2015,62(2):86-90
[9] Tadele A, Beyene D, Hussein J, Gemechu T, Birhanu A, Mustafa T, Tsegaye A, Aseffa A, Sviland L. Immunocy-tochemical detection of Mycobacterium tuberculosis complex specific antigen, MPT64, improves diagnosis of tuberculous lymphadenitis and tuberculous pleuritis. BMC Infect Dis, 2014, 14(1):585.
[10] 尹小毛,謝贝,罗春明,黄丽晶,蔡杏珊,李昕洁,刘志辉. 应用MPT64检测建立结核分枝杆菌药敏新方法的初步探索.实验与检验医学,2011,29(4):371-372.
[11] Chutichetpong P, Cheeveewattanagul N, Srilohasin P, Rijirava-nich P, Chaiprasert A, Surareungchai W. Rapid screening drug susceptibility test in tuberculosis using sandwich electrochemical immunosensor. Anal Chim Acta, 2018,1025:108-117.
[12] Singh K, Kumari R, Tripathi R, Gupta A, Anupurba S. Mutation in MPT64 gene influencing diagnostic accuracy of SD Bioline assay (capilia). BMC Infect Dis, 2019, 19(1):1-6.
[13] Qiu Y, Wan L, Liu H, Wan K, Guan C, Jiang Y. Impact of 63-bp deletion and single-base mutation in mpt64 gene on M.tb diagnosis. Int J Clin Exp Pathol, 2015, 8(3): 3210-3214.
[14] 毛欣茹,张诗蒙,尹小毛. 结核分枝杆菌mpt64基因突变研究. 实验与检验医学,2016,34(2):137-139.
(收稿日期:2020-11-10)
(本文编辑:杨江瑜)

