基于Rho/Rho-kinase 信号通路探讨丙泊酚减轻大鼠脑缺血再灌注损伤的效果
邓 莉赵延礼何宗钊司立宁吕志坚
(1.青海大学附属医院麻醉科, 西宁 810001; 2.青海大学医学院基础医学部, 西宁 810001;3.青海省人民医院重症医学科, 西宁 810007; 4.青海大学附属医院重症医学科, 西宁 810001)
缺血性中风是导致全球成人死亡和获得性残疾的主要因素之一。 目前,大约有1500 万中风患者,每年因此造成500 万人死亡[1-2]。 脑缺血/再灌注损伤的发生主要有如下几种机制,包括兴奋性毒性,炎症,神经元凋亡和脑水肿。 此外,众所周知,急性炎症反应和细胞凋亡在由脑再灌注损伤产生的神经元细胞的继发性损伤中起关键作用[3]。 Rho是小分子GTPase 超家族的一部分,在多种细胞过程中起关键作用,包括基因转录,细胞迁移,运动,凋亡,神经再生和细胞形态,并能够通过磷酸化调节细胞肌动蛋白的重组Rho 激酶(Rho-kinase),Rhokinase 是一种丝氨酸/苏氨酸蛋白激酶,Rho-kinase激活并调节多种细胞功能,包括形态,粘附,运动性和增殖。 研究结果表明,Rho-kinase 被抑制后,可减少神经元的炎症和细胞凋亡,并在脑缺血/再灌注中维持神经功能[4],抑制Rho 激酶可以保护神经细胞免受内皮素1 诱导的缺血性损伤[5]。 丙泊酚为烷基酸类的短效静脉麻醉药。 静脉注射后迅速分布于全身,40 s 内可产生睡眠状态,进入麻醉迅速、平稳。 丙泊酚的镇痛效应较弱,可使颅内压降低、脑耗氧量及脑血流量减少。 对呼吸系统有抑制作用,可出现暂时性呼吸停止;对循环系统也有抑制作用,可出现血压降低。 先前的研究表明[6],丙泊酚在体内对大鼠心肌缺血再灌注损伤(MIRI)发挥了有益的作用;丙泊酚对MIRI 大鼠模型的保护作用涉及抗氧化和抗炎症过程[7]。 本研究拟基于Rho/Rho-kinase 信号通路探讨丙泊酚减轻大鼠脑缺血再灌注损伤的效果,为脑缺血再灌注损伤的治疗提供理论依据。
1 材料和方法
1.1 实验动物
清洁级SD(Sprague Dawley)大鼠100 只,年龄6周;体重225 ~243 g,雌雄各半;青海大学医学院动物实验中心提供并饲养[SCXK(青) 2018-0013][SYXK(青) 2017-0014],本研究经青海大学附属医院科研伦理委员会批准(20180815),大鼠饲养环境为:22℃~24℃;50%~55%;12 h 黑暗/光照循环。实验研究过程中严格遵循3R 原则。
1.2 主要试剂与仪器
戊巴比妥钠(30 mg/kg; H31020240,上海新亚洲制药有限公司,中国 上海);TRIzol(sigma 美国,56262);RNeasy Mini Kit(TaKaRa,中国,2544);RIPA 缓冲液(Santa Cruz,USA,52547);BCA 试剂盒(赛默飞世,美国,20147);12%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE,sigma,45955);聚偏二氟乙烯(PVDF,sigma,854175);牛血清白蛋白(BSA, 碧 云 天 科 技, 410254); 兔 抗 大 鼠 Rho(ab54835;1 ∶1000; Abcam,Cambridge,MA,USA);Rho-kinase(ab45171,1 ∶2000; Abcam,Cambridge,MA,USA);β-actin 单克隆抗体(ab134181;1 ∶1000;Abcam,Cambridge,MA,USA);山羊抗兔二抗(C86 SSA004;1 ∶1000,上海Canspec 科技有限公司,中国上海);NanoDrop2000c 分光光度计(美国塞默飞世);Applied Biosystems 7500(美国通用)。
1.3 实验方法
1.3.1 动物分组
根据体重随机分成5 组:对照组、模型组、丙泊酚低剂量组(20.0 mg/kg)、丙泊酚中剂量组(40.0 mg/kg)、丙泊酚高剂量组(80.0 mg/kg)、每组20只,雌雄各半。 前期预实验求出丙泊酚对脑缺血再灌注大鼠LC50为160 mg/kg,以1/2 LC50为高剂量,2倍间距求出中、低剂量。
1.3.2 各实验组的制备及神经运动功能评分
模型组、丙泊酚各剂量组通过腹膜内注射用3%戊巴比妥钠麻醉大鼠,并固定头和四肢放在不锈钢手术台上。 刮毛和灭菌后进行宫颈正中切口,暴露左颈内动脉(ICA)后,将尼龙手术丝插入其中,当远端遇到阻力时,停止插入,并用根据Koizumi 方法测量的插入深度结扎ICA,闭塞2 h 后,取下线以允许缺血区域的完全再灌注,然后建立大脑中动脉闭塞(MACO)的大鼠模型。 术后给予20 万U 青霉素肌肉注射,连续使用3 d。 对照组除不阻断大鼠大脑中动脉外,其余操作同上。 丙泊酚各剂量各剂量术后第1 天开始腹腔给予相应药物,持续给予4 周,对照组和模型组给予等体积生理盐水。 试验结束后(第29 天),对每只大鼠的神经功能缺损评分。 包括运动、感觉、反射和平衡能力测试等。 采用以下评分制度:0 级,无赤字;1 级,右前爪未能伸展; 2级,向右旋转;3 级,从右到右;4 级,无法自发行走,意识水平降低。
1.3.3 贴纸去除及平衡木行走实验
实验结束后(第29 天), 依据相关文献对大鼠行贴纸去除及平衡木行走实验[8-9]。 简而言之:边长为10 mm 的正方形黏性纸粘住大鼠前肢掌面,记录大鼠去除黏性纸的时间;大鼠于平衡木上行走,平衡木长80 cm、宽2.5 cm,距离地面高10 cm 并,记录大鼠穿越平衡木的时间。
1.3.4 各组大鼠海马区病理结构观察
实验结束后(第29 天)处死大鼠,获取海马组织,对海马组织常规脱水、脱腊,HE 染色观察病理结构变化。 简而言之:(1)二甲苯(Ⅰ)15 min、二甲苯(Ⅱ)15 min、二甲苯:无水乙醇=1 ∶1 2 min、100%乙醇(Ⅰ)5 min、100%乙醇(Ⅱ)5 min、80%乙醇5 min、蒸馏水5 min、苏木精液染色5 min、水洗10 min或流水冲洗5 min、1%盐酸乙醇30 s、水洗30 s、蒸馏水过洗5 s、0.5%伊红液染色1 ~3 min、蒸馏水稍洗30 s、80%乙醇稍洗30 s、95%乙醇(Ⅰ)1 min、95%乙醇(Ⅱ)1 min、无水乙醇(Ⅰ)3 min、无水乙醇(Ⅱ)3 min、二甲苯(Ⅰ)3 min、二甲苯(Ⅱ)3 min、中性树胶封固。
1.3.5 各组大鼠海马区病理评分
在高倍视野下(×40),每1/10 病变面积计一个单位,一个单位的变性评为0.2 分,一个单位的坏死评为2 分。
1.3.6 大鼠脑组织海马区中Rho、 Rho-kinase mRNA 水平的测定
试验结束后(第29 天)处死大鼠,获取脑组织海马区,TRIzol 提取脑组织海马区总RNA。 使用NanoDrop2000c 分光光度计(A260:A280>1.8)测量RNA 的纯度和浓度,通过琼脂糖凝胶电泳结合溴化乙锭染色评估RNA 的完整性。 根据制造商提供的说明使用RNeasy Mini Kit 进行逆转录反应。 简而言之,在42℃下用DNA 酶从1 μg 总RNA 中去除污染的基因组DNA 2。 接下来,将1 μL 包含寡核苷酸(dT)和随机引物的逆转录引物混合物,1 μL 逆转录酶,4 μL 5×逆转录缓冲液和4 μL DEPC 处理过的水添加到上述DNase 处理的RNA 中模板中的总反应体积为20 μL。 将反应液在37℃孵育15 min,然后在85℃孵育5 s,然后保存在4℃下。 使用Applied Biosystems 7500 检测系统进行实时PCR。实 时 PCR 的 引 物 序 列 如 下: Rho: 5′-TACCCTGGGAGACAGAATGAAAAGC-3′(正 向) 和5′-CACCTGTGTTTCTCAGCCCTTCTCT-3′ ( 反 向);Rho-kinase:5′-ATGACAGGGCTGGAAGTGACC-3′(正向) 和 5′-ACTATGTCCCAGTCAGGGCTCT-3′ ( 反向); β 肌动 蛋 白:5′-CTTAGTTGCGTTACACCCTT TCTTG-3′(正 向) 和5′-CTGTCACCTTCACCGTTCC AGTTT-3'(反向)。 引物由生工科技合成(上海,中国)。 对于反应,将1 μL cDNA,12.5 μL 2× SYBR Green I Master Mix,10 pmol 特定正向引物,10 pmol反向引物和0.5 μL ROX II 合并,并用DEPC 处理过的水加入最终体积为25 μL。 反应参数包括在95℃下孵育30 s,然后在95℃下进行40 次循环,每次5 s,然后在60℃下进行34 次循环。 使用2-ΔΔCt方法计算相对靶基因定量,其中ΔΔCt =[Ct(治疗组)靶基因- Ct(治疗组)内部对照]-[Ct(对照组)靶基因-Ct(对照组)内部控制]。 β-肌动蛋白用作内部对照。
1.3.7 大鼠脑组织海马区中Rho、Rho-kinase 蛋白水平的测定
实验结束后(第29 天)处死大鼠,获取脑组织海马区,用预冷的PBS 洗涤,并在RIPA 缓冲液中裂解,然后使用BCA 试剂盒测量蛋白质浓度。 用12%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离25 μg蛋白质样品,并通过半干电泳转移将其转移到聚偏二氟乙烯膜上。 用5%牛血清白蛋白封闭过夜后,将标本与兔抗大鼠Rho,Rho-kinase 和β-actin 单克隆抗体在摇床上于4℃放置2 h。 然后将PVDF 膜与山羊抗兔二抗在摇床上孵育4 h。 随后进行化学发光,并使用Quantity One 软件进行定量分析。
1.4 统计学方法
采用SPSS 23.0 对数据进行录入、统计学分析。计量资料以平均数±标准差()表示,采用单因素方差分析比较,多重比较采用LSD-t检验,检验水准α 为0.05。
2 结果
2.1 各组大鼠神经运动功能评分及海马组织病理评分的比较
模型组神经功能缺损评分、双侧贴纸去除时间、平衡木过杆时间、海马组织病理评分明显高于对照组(P<0.05);丙泊酚各剂量组神经功能缺损评分、双侧贴纸去除时间、平衡木过杆时间、海马组织病理评分明显低于模型组(P<0.05);且随着丙泊酚给药剂量的增加,神经功能缺损评分、双侧贴纸去除时间、平衡木过杆时间、海马组织病理评分逐渐降低,剂量-效应关系明显(P<0.05)(见表1)。
2.2 丙泊酚对各组大鼠海马结构的影响
图1 可见,对照组海马区神经元细胞完整,排列紧密;模型组海马区神经元排列松散,细胞深染固缩,有片状坏死,神经细胞间质隔离;丙泊酚高剂组神经元细胞趋于正常;丙泊酚中、低剂量组较模型组而言,神经细胞疏松、固缩程度轻,神经元细胞核仁清楚可见。
2.3 各组大鼠脑组织海马区Rho、Rho-kinase mRNA 表达水平的比较
模型组Rho、Rho-kinase mRNA 表达水平明显高于对照组(P<0.05);丙泊酚各剂量组Rho、Rhokinase mRNA 表达水平明显低于模型组(P<0.05);且随着丙泊酚给药剂量的增加,Rho、Rho-kinase mRNA 表达水平逐渐降低,剂量-效应关系明显(P<0.05)(见表2)。
2.4 各组大鼠脑组织海马区Rho、Rho-kinase 蛋白表达水平的比较
模型组Rho、Rho-kinase 蛋白表达水平明显高于对照组(P<0.05);丙泊酚各剂量组Rho、Rhokinase 蛋白表达水平明显低于模型组(P<0.05);且随着丙泊酚给药剂量的增加,Rho、Rho-kinase 蛋白表达水平逐渐降低,剂量-效应关系明显(P<0.05),见表3 及图2。
表1 各组大鼠神经运动功能评分及海马组织病理评分的比较(,n =20)Table 1 Comparison of neuromotor function score and hippocampal histopathology score of rats in each group

表1 各组大鼠神经运动功能评分及海马组织病理评分的比较(,n =20)Table 1 Comparison of neuromotor function score and hippocampal histopathology score of rats in each group
注:与对照组比较,1)P<0.05;与模型组比较,2)P<0.05;与丙泊酚组低剂量比较,3)P<0.05;与丙泊酚组中剂量比较,4)P<0.05。Note.Compared with the control group,1)P<0.05.Compared with the model group, 2)P<0.05.Compared with the low dose of the propofol group,3)P<0.05.Compared with the dose in the propofol group, 4)P<0.05.
组别Groups剂量(mg/kg)Dose神经功能缺损评分(分)Neurological impairment score (points)双侧贴纸去除时间(s)Double-sided sticker removal time平衡木过杆时间(s)Balance beam crossing time海马组织病理评分(分)Hippocampal histopathology score(points)对照组Control group - 0.00±0.00 26.34±6.87 1.99±0.34 0.00±0.00模型组Model group - 10.66±0.4711) 103.63±25.6511) 16.54±6.8711) 9.96±0.561)丙泊酚组Propofol Group 20 8.14±0.3411)2) 80.76±8.1211)2) 12.30±0.5111)2) 8.65±0.441)2)40 6.23±0.2311)2)3) 51.28±9.8811)2)3) 8.65±0.5111)2)3) 5.98±0.481)2)3)80 5.35±0.1611)2)3)4) 50.32±9.1611)2)3)4) 4.71±0.5011)2)3)4) 3.99±0.391)2)3)4)

图1 丙泊酚对各组大鼠海马结构的影响(HE 染色)A, Control group.B, Model group.C, Propofol group low-dose group.D, Propofol group medium-dose group.E, Propofol group high-dose group.Figure 1 Effect of propofol on the hippocampus structure of each group of rats(HE staining)
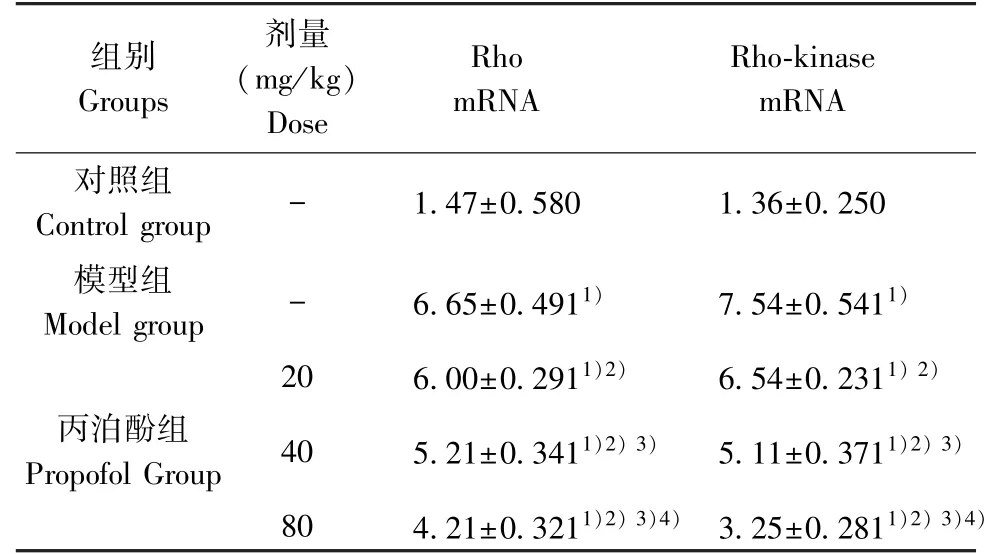
表2 各组大鼠脑组织海马区Rho、Rho-kinase mRNA表达水平的比较(n=20)Table 2 Comparison of Rho and Rho-kinase mRNA expression levels of rats in each group

表3 各组大鼠脑组织海马区Rho、Rho-kinase蛋白表达水平的比较(n=20)Table 3 Comparison of Rho and Rho-kinase protein expression levels of rats in each group

图2 各组大鼠脑组织海马区Rho、Rho-kinase 蛋白表达水平的比较Note.A, Control group.B, Model group C, Propofol group low-dose group.D, Propofol group medium-dose group.E, Propofol group high-dose group.Figure 2 Comparison of Rho and Rho-kinase protein expression levels of rats in each group
3 讨论
丙泊酚是一种短效的静脉催眠麻醉剂,可通过多种机制为脑缺血再灌注提供保护。 丙泊酚(2,6-二异丙基苯丙醇)是一种速效,持续时间短的静脉内催眠麻醉剂,在脑手术期间和之后被广泛使用。异丙酚的化学结构类似于具有抗氧化特性的α-生育酚(维生素E)的活性核[10]。 本研究结果显示;丙泊酚各剂量组神经功能缺损评分、双侧贴纸去除时间、平衡木过杆时间、海马组织病理评分明显低于模型组。 这说明,丙泊酚能减轻大鼠脑缺血再灌注神经功能损伤。 根据先前的研究,炎症,氧化应激和细胞凋亡是脑缺血再灌注损伤有害过程的三个主要机制,被证明是全球第二大常见致死因素,也是成人神经系统残疾的主要原因。 此外,凋亡是脑缺血再灌注损伤的主要原因之一,因此,抑制神经元凋亡是治疗缺血性中风的关键目标。 证据表明凋亡在缺血后神经细胞死亡中起重要作用,这表明抑制凋亡性细胞死亡的治疗性干预措施可能会减轻脑缺血再灌注损伤。 近期研究表明[11-12],丙泊酚可抑制神经细胞线粒体细胞色素c 的释放,进而抑制神经细胞凋亡。 本次研究病理结果显示:对照组海马区神经元细胞完整,排列紧密;模型组海马区神经元排列松散,细胞深染固缩,有片状坏死,神经细胞间质隔离;丙泊酚高剂组神经元细胞趋于正常;丙泊酚中、低剂量组较模型组而言,神经细胞疏松、固缩程度轻,神经元细胞核仁清楚可见。 这与上述讨论一致。
本研 究 结 果 显 示: 模 型 组Rho、 Rho-kinase mRNA 和蛋白表达水平明显高于对照组;丙泊酚各剂量组Rho、Rho-kinase mRNA 和蛋白表达水平明显低于模型组;且随着丙泊酚给药剂量的增加,Rho、Rho-kinase mRNA 表达水平逐渐降低,剂量-效应关系明显。 这说明,丙泊酚能抑制Rho、Rho-kinase mRNA 和蛋白表达水平的表达进而抑制Rho/Rhokinase 信号通路的激活。 炎症反应,神经细胞内钙超载和细胞凋亡已被证明是脑I/R 损伤的主要原因。 属于高度保守的先天免疫受体GTPase 超家族的Rho 可以识别从死亡/垂死细胞释放的外源病原体或与损伤相关的分子模式(DAMP)。 Rho 是第一个被表征的哺乳动物GTPase,主要在小胶质细胞,星形胶质细胞,神经元和内皮细胞中表达。 许多研究表明,Rho 在脑缺血/再灌注的病理过程中起关键作用,并且在缺血后小鼠脑中Rho 的mRNA 上调[13-14]。 免疫组织化学研究表明,在MCAO 小鼠模型中,缺血/再灌注后Rho 阳性细胞从1 h 逐渐增加至22 h。 此外,在缺血/再灌注后,Rho-KO 小鼠的梗死面积和神经功能缺损均低于野生型小鼠[15]。 Rho可以激活Rho-kinase 和有丝分裂原激活的蛋白激酶(MAPK)信号传导途径,导致神经炎症反应。 c-jun氨基末端激酶(JNK)是Rho-kinase 的主要组成部分,已被证明在脑缺血/灌注损伤后的神经元凋亡中起关键作用[16]。 大量证据表明,Bcl-2 充当Rhokinase 的非核底物,并通过调节线粒体膜的通透性在细胞内凋亡信号转导中发挥关键作用。 Caspase-3是凋亡执行过程中的关键分子,抑制其激活可能在凋亡级联反应的最后一步起作用并阻止凋亡细胞的死亡[17-18]。 结合本次研究结果,提示对Rho/Rho-kinase 信号通路的抑制可能是治疗脑缺血再灌注损伤的新方向。
综上所述,丙泊酚能减轻大鼠脑缺血再灌注神经功能损伤;其机制与丙泊酚能抑制Rho、Rhokinase mRNA 和蛋白的表达进而抑制Rho/Rhokinase 信号通路的激活有关。

