婴幼儿奶粉中阪崎肠杆菌增菌培养对PCR快速检测的影响
张清平,张懿翔,刘洋
(上海市质量监督检验技术研究院国家食品质量监督检验中心(上海),上海 200233)
0 引言
阪崎肠杆菌(Enterobacter sakazakii)是一种自然界中普遍存在的微生物,它能够从多种介质和环境中分离得到,包括食品、奶粉原料、废水、食品生产线以及家庭和医院等,奶粉和其生产加工环境是该菌传播的主要媒介[1-4]。该菌是一种食源性条件致病菌,主要引起婴幼儿,尤其是早产儿发生脑膜炎、败血症和坏死性结肠炎的感染,死亡率高达50%~80%[5-7],近些年来爆发了多起阪崎肠杆菌的重大感染事件[8-10]。2006年,针对婴幼儿配方奶粉受阪崎肠杆菌污染的高风险和污染后的巨大危害,原国家质检总局颁布了婴幼儿配方奶粉中阪崎肠杆菌每批必检的市场准入要求。
GB4789.40-2016作为阪崎肠杆菌检测的金标准,一直被广泛采用,但该方法检测周期长,满足不了阪崎肠杆菌快速筛选的需求,因此,多年来针对阪崎肠杆菌的快速检测技术也一直在不断发展,其中以DNA为基础的PCR检测技术发展最为迅速[11-15]。而这些快速检测方法的一个共同特征即是需要从待测样本中获取阪崎肠杆菌的基因组DNA。由于从待测样本中提取阪崎肠杆菌DNA,需要一定数量的目标菌,所以目前已发布的阪崎肠杆菌检测方法标准中,其首要步骤就是对待检样本进行增菌培养[16-17]。
据调查,实际流通食品中致病菌的含量通常较低,多数奶粉中阪崎肠杆菌的污染水平小于1 CFU/100 g[18],目前与阪崎肠杆菌相关的快速测方法都达不到如此低的检出限。已报道的基于DNA检测的阪崎肠杆菌快检方法的检出限达到103CFU/mL(g)[19-20],因此,采用传统的增菌培养方法对目标菌进行增殖,使其快速达到一定的数量是目前各快速检测方法必不可少的关键步骤。据报道,阪崎肠杆菌的最适生长温度为35~40℃,在36℃的培养条件下,该菌的生长延滞期较短[21]。目前国家标准中阪崎肠杆菌的前增菌时间为18±2 h,为了摸索出适合荧光PCR快速检测方法的阪崎肠杆菌最佳前增菌时间,本研究对婴幼儿奶粉中阪崎肠杆菌的前增菌培养条件及影响因素进行全面研究,以期建立稳定的阪崎肠杆菌快速检测技术。
1 材料与方法
1.1 材料与试剂
实验菌株:阪崎肠杆菌ATCC25944;干扰菌株:大肠杆菌ATCC8099,沙门氏菌ATCC 13311,金黄色葡萄球菌ATCC6538,阴沟肠杆菌ATCC 35030。选用的3种婴幼儿奶粉均购自市场,采用GB4789.40的检测方法进行检测,均未检出阪崎肠杆菌。
培养基及试剂:缓冲蛋白胨水(BPW)、营养肉汤,营养琼脂、平板计数琼脂及阪崎肠杆菌显色培养基均购自北京陆桥技术有限公司;细菌DNA提取试剂盒DP302-02来自天根生化科技(北京)有限公司;Premix Ex TaqTM (Probe qPCR)(Cat#RR 390A)购自大连宝生物公司;荧光PCR引物及探针由上海生工合成:上游引物5’-GGCGAGCGGCGAATATTAT-3’;下游引物5’-CGGGTTTTCCCAGTTGAGATC-3’;探针5’-CACCAGTTTTCGGTGCGCCAGC-3’。
1.2 仪器与设备
生化培养箱(Shellab,G16-2),美国Shellab公司;生物安全柜(labconcoB2),美国Lanconco;麦氏比浊仪,法国梅里埃;台式高速冷冻离心机(Eppendorf,5430R),德国Eppendorf公司;超微量紫外可见分光光度计(DeNovix DS-11),美国DeNovix公司;荧光定量CR仪(ABI 7500 Fast),赛默飞世尔科技(中国)有限公司;Vortex Genie2漩涡振荡器,德国Heidolph公司;移液器(2,10,100,1 000μL)(Eppendorf Research Plus),德国Eppendorf公司。
1.3 实验方法
1.3.1 阪崎肠杆菌平板计数
阪崎肠杆菌的计数采用两种平板计数法(倾注培养法和阪崎肠杆菌显色培养基涂布法),倾注培养法按GB4789.2的操作进行,阪崎肠杆菌显色培养基涂布法参照GB4789.2的要求进行梯度稀释后,取0.2 mL涂布两块阪崎肠杆菌显色培养基,倒置于36±1℃培养24±2 h后进行计数。
1.3.2 实验菌株菌悬液的制备
阪崎肠杆菌标准菌株及干扰菌株经营养肉汤复活后转接营养琼脂斜面,36±1℃培养24±2 h,用生理盐水将营养琼脂斜面上的菌苔洗下,制成菌悬液,用比浊仪测定各菌悬液的麦氏浓度,并按GB4789.2和阪崎肠杆菌显色培养基涂布法进行回收计数,实验证明平板计数法所回收的菌落数与比浊仪参考表推算出的初始菌液浓度基本吻合,如表1所示。在人工染菌实验时,奶粉样品中的人工加菌量将按照比浊仪测得的比值进行估算。
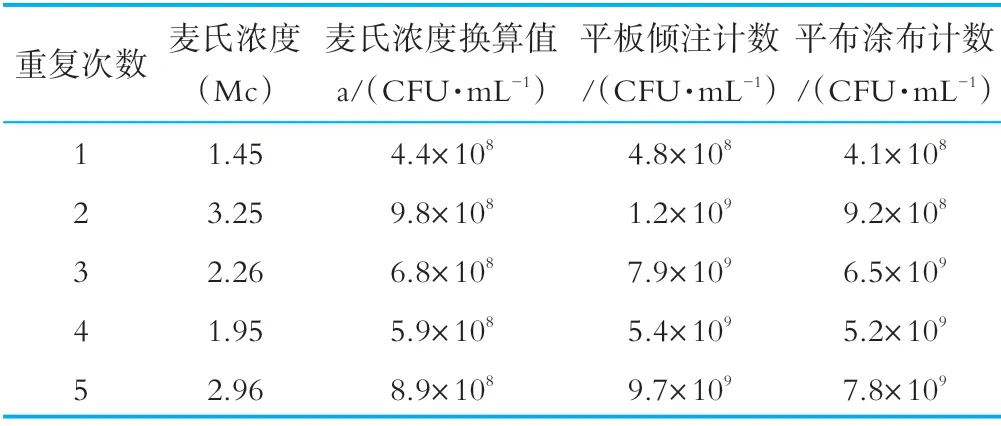
表1 菌液浓度计算预实验
1.3.3 不同初始菌量下阪崎肠杆菌的生长实验
称取100 g奶粉加入到900 mL的BPW增菌液中,充分均匀后,分别加入菌液浓度为103、102、101CFU/mL及1~9 CFU/mL菌液各1 m L,每种加菌量重复3次。人工染菌后的BPW增菌液经充分混匀后置36±1℃培养。
1.3.4 奶粉基质对阪崎肠杆菌的生长实验
分别以3种不同品牌奶粉做基质,称取100 g奶粉加入到900 mL的BPW中,每种奶粉重复3次,同时以不添加奶粉样品的900 mL BPW增菌液做背景基质对照。然后将制备好的阪崎肠杆菌菌悬液稀释,选取1~9 CFU/mL浓度的菌液,取1 mL添加到已制备好的BPW增菌液中,充分混匀后,置36±1℃培养。
1.3.5 不同干扰菌背景下阪崎肠杆菌的生长实验
在含有奶粉基质的900 mLBPW增菌液中,按照表2的实验设置人工添加阪崎肠杆菌、大肠杆菌、沙门氏菌、金黄色葡萄球菌及阴沟肠杆菌的菌悬液(浓度约为1~9 CFU/m L),每个试验设置进行3次重复,充分混匀后置36±1℃培养。

表2 不同干扰菌背景下阪崎肠杆菌的生长实验设置
1.3.6 阪崎肠杆菌的荧光PCR检测方法
分别取1.3.4及1.3.5两步前增菌培养后的BPW增菌液2 m L,3 000 rpm离心10 min后弃去上层的奶粉脂肪层,然后13 000 rpm离心10 min,弃去上清液,保留底部沉淀,采用细菌DNA提取试剂盒抽提基因组DNA,将提取后的样品DNA测定其浓度和质量,然后采用荧光PCR方法进行检测。
2 结果与分析
2.1 不同初始菌量条件下阪崎肠杆菌的生长情况
含有奶粉基质的BPW增菌液的4种不同的起始菌量分别约为103、102、101及1~9 CFU/1 000 m L,经过4、6、8、10、12、14、16 h增菌培养后,计数结果见图1,可以发现,初始菌量不同,阪崎肠杆菌生长的延滞期长短不同,随着初始菌量逐渐减少,阪崎肠杆菌生长的延滞期变长。初始菌量在1~9 CFU/1 000 m L数量级时,培养4 h时阪崎肠杆菌计数<1 CFU/mL,增菌培养10 h时,阪崎肠杆菌的数量才能达到103CFU/mL。样品中初始菌含量是影响阪崎肠杆菌快速增殖到一定数量的关键因素。目前我国市场上婴幼儿配方奶粉的整体卫生状况较好,即便有阪崎肠杆菌的污染,其污染量极低,因此,采用阪崎肠杆菌快速检测方法所需要的增菌培养时间至少在10 h以上。

图1 不同初始菌量下阪崎肠杆菌生长变化
2.2 奶粉基质对阪崎肠杆菌的生长影响
含有奶粉基质的BPW增菌液与未含有奶粉基质的BPW增菌液,在预设的增菌时间培养后,取增菌液采用荧光PCR法检测阪崎肠杆菌,不含奶粉基质的BPW增菌液与含有奶粉基质的BPW增菌液所获取的扩增Ct值均存在显著性差异。增菌培养8 h时,荧光PCR扩增的Ct值大于40,未检出阪崎肠杆菌;增菌培养10 h时,荧光PCR扩增的Ct值小于35,能够有效地检出阪崎肠杆菌。此外,随着增菌时间的延长,荧光PCR扩增的Ct值逐渐减小,如图2所示。值得注意的是,未添加奶粉基质的BPW增菌液与添加3种不同品牌奶粉基质的BPW增菌液的生长增殖有明显的差异,相同初始菌量在增菌时间相同的情况下,未添加奶粉基质的BPW增菌液中目标菌的生长明显多于添加奶粉基质的,如图3所示。这可能是奶粉中含有一定量的杂菌,在培养的过程中由奶粉带入的非目标菌一定程度上抑制了阪崎肠杆菌的生长,使阪崎肠杆菌的生长速度减缓,当阪崎肠杆菌增殖到一定数量后,抑制效果不明显。

图2 不同基质对阪崎肠杆菌荧光PCR检测的影响

图3 不同基质对阪崎肠杆菌增殖数量的影响
2.3 不同干扰菌条件下阪崎肠杆菌的生长情况
以奶粉为基质的BPW增菌液中添加相同数量级的目标菌和干扰菌,在经过不同时间的增菌培养后,增菌液中目标菌的增殖数量及荧光PCR检测所获取的Ct均存在显著差异,如图4所示,通过比较发现,奶粉中大肠杆菌、沙门氏菌和金黄色葡萄球菌的存在数量与阪崎肠杆菌的数量在同一数量级别时,这3种食品中常见的致病菌对阪崎肠杆菌基本没有抑制作用。但以奶粉为基质的BPW增菌液中添加相同数量级的阪崎肠杆菌和阴沟肠杆菌时,阪崎肠杆菌的生长增殖将受到一定程度的抑制,增菌液中目标菌的增殖数量明显减少,增菌培养12 h后荧光PCR检测的Ct值才小于35,采用快速检测方法能够有效检出阪崎肠杆菌的培养时间被延长。

图4不同干扰菌对阪崎肠杆菌增殖生长的影响
3 结论
目前婴幼儿乳粉中阪崎克罗诺杆菌的快速检测均需要增菌培养,按照国家标准GB4789.40的增菌培养条件,通常需要1~2 d的培养时间,考虑到PCR检测方法灵敏度较高,摸索出能够达到快速检测所需的最短增菌培养时间将可以更快获得检测结果。阪崎肠杆菌的生长模型预测和实时监测均显示阪崎肠杆菌的生长延滞期较短[22-25],培养8 h即进入稳定生长期,本研究模拟奶粉中阪崎肠杆菌污染水平较低的现状,将初始加菌量控制在1~9 CFU/1 000 mL的极低浓度,增菌培养后发现阪崎肠杆菌的生长延滞期延长,初始菌量是影响阪崎肠杆菌快速到达一定数量的关键因素。采用荧光PCR方法对人工染菌后的增菌液进行检测,最快增菌培养10 h即可检出阪崎肠杆菌。然后综合考虑不同婴幼儿奶粉基质的差异及可能含有的常见干扰菌的影响,采用快速检测方法对婴幼儿奶粉进行阪崎肠杆菌检测时,增菌培养12 h才不会出现假阴性结果。
因此,对于目前市场上销售的婴幼儿奶粉,采用传统增菌培养方法,增菌培养10~12 h后,奶粉中污染的阪崎肠杆菌数量即可达到PCR检测方法的检出限,满足PCR快速检测的需求,此培养时间比传统的培养时间节省了约30 h。本研究结果也可用于奶粉生产企业的日常监控,一定程度上可节省检测时间,还可有效减低生产成本,为社会带来一定的经济效益。
- 中国乳品工业的其它文章
- 澳大利亚奶业发展政策及启示

