大鼠体内外细胞色素P450酶活性检测方法的建立及应用
夏丽军 陈伟东 刘进

[摘要] 目的 建立快速、简便、灵敏可以同时测定大鼠体内外“鸡尾酒”探针药物和代谢产物的LC-MS/MS方法,并用于大鼠肝微粒体外代谢和大鼠体内的药代动力学研究。 方法 所有样品均加入乙腈进行沉淀处理,然后在UPLC CORTECS C18(2.1 mm×50 mm,1.6 μm)色谱柱分离,质谱方法采用多反应监测模式(MRM)。液相方法采用梯度洗脱流动相乙腈-0.1%甲酸水。 结果 6种探针药和代谢产物的体内外样品方法学验证符合生物样品检测要求。该方法成功应用于大鼠体内外“鸡尾酒”实验中。 结论 本实验建立的“鸡尾酒”方法可用于体内外快速评价药物或中草药对相应的CYP450亚型酶活性的影响,可以用于潜在的药物相互作用的预测。
[关键词] 细胞色素P450;大鼠肝微粒体;探针药;UPLC-MS/MS
[Abstract] Objective To establish a rapid, simple and sensitive LC-MS/MS method for simultaneous determination of "cocktail" probe drugs and metabolites in vivo and in vitro of rats, and to apply it to studies of in vitro metabolism of rats′ liver microsomes and in vivo pharmacokinetics of rats. Methods Both in vivo and in vitro samples were treated by acetonitrile precipitation method. Probe drugs and metabolites were detected by UPLC CORTECS C18 (2.1 mm×50 mm, 1.6 μm) chromatographic column combined with UPLC-MS/MS method of multiple reaction monitoring mode(MRM), in which acetonitrile-0.1% formic acid water was used as gradient elution method of mobile phase. Results Methodological verification of samples in vitro and in vivo of 6 probe drugs and metabolites met the requirements of biological sample detection. The method had been successfully applied to "cocktail" experiments in vivo and in vitro of rats. Conclusion The "cocktail" method established in this experiment could be used to rapidly evaluate the efficacies of drugs or Chinese herbal medicines on the activities of the corresponding CYP450 subtypes enzymes in vivo and in vitro and could be used to predict potential drug interactions.
[Key words] Cytochrome P450; Rat liver microsomes; Probe drugs; UPLC-MS/MS
细胞色素P450酶(Cytochrome P450 proteins,CYP)是体内I相代谢的主要代谢酶超家族,大约能代谢超过90%的药物和内源性物质[1-2],其中,经CYP1A2、CYP2B6、CYP2D6、CYP2C9,CYP2E1和CYP3A4代谢的药物占所有经CYP代谢药物的80%以上[3-5]。药物、食物和中草药等可通过抑制或诱导药物代谢酶来改变其他药物的代谢和药代动力学特性,从而导致药物之间相互作用。其中,对CYP酶的抑制作用会增加药物不良反应的风险或降低所需的治疗效果。研究者通常使用体外P450酶抑制试验来研究经P450代谢的药物相互作用(Drug-drug interaction,DDI)或中草药药物相互作用(Herb-drug interaction,HDI)的可能机制。目前研究者已开发了几种混合使用P450探针底物的混合物进行肝微粒体温育的鸡尾酒方法,可以高通量地检测经P450酶代谢药物相互作用的预测,但是,目前大多數文献都是单一的体内或体外“鸡尾酒”方法[6-9],本实验将体内和体外“鸡尾酒”方法相结合,采用UPLC-MS/MS检测方法,为预测药物相互作用提供较全面的数据,可以用于潜在的药物相互作用的预测。
1 材料与方法
1.1 材料来源
非那西汀(Ph,批号:ILTFG-PD)和安非他酮(Bu,批号:31677-93-7)购于Tokyo Chemical Industry公司,右美沙芬(Dex,批号:D299445)、甲苯磺丁脲(Tol,批号:64-77-7)和氯唑沙宗(Chl,批号:95-25-0)购于J&K Scientific,咪达唑仑(Mdz,批号:20180207)产自江苏恩华药业,羟基安非他酮(OH-Bu,批号:92264-81-8) 购自加拿大TLC Pharmaceutical Standards Ltd.,羟基咪达唑仑(OH-Mdz,批号:59468-85-8)、右啡烷(Dep,批号:125-73-5)、羟基甲苯磺丁脲(OH-Tol,批号:5719-85-7)、羟基氯唑沙宗(OH-Chl,批号:475295-90-0)和对乙酰氨基酚(Ac,批号:103-90-2)购于Toronto Research Chemicals公司;色谱级甲醇、乙腈购自德国Merck公司。色谱级甲酸购自阿拉丁生化试剂公司。实验用水为娃哈哈纯净水。大鼠肝微粒由本实验室制备。
1.2 仪器
ACQUITY I-Class 超高效液相串联XEVO TQD三重四级杆质谱和Masslynx 4.1软件(美国Weters公司);5430R低温高速离心机(美国Eppendorf公司);TE4101-L电子天平(北京赛多利斯仪器公司);电热恒温振荡水槽(上海森性实验仪器有限公司)。
1.3 对照品储备液配制
精密称取10 mg各探针药,然后加入10 mL甲醇,配成1 mg/mL储备液;精密称取1 mg各代谢产物,然后加入10 mL甲醇,配成0.1 mg/mL储备液并避光后于4℃保存。
1.4 色谱条件
色谱柱为ACQUITY UPLC CORTECS C18 column(2.1 mm×50 mm,1.6 μm);流动相为A相乙腈,B相0.1%甲酸-水,梯度洗脱流程为:0.0~0.6 min,10%~50%A;0.6~1.0 min,50%~80%A;1~2 min,80%~95%A;2.0~2.5 min,95%A;2.5~2.6 min,95%~10%A;2.6~3.0 min,10%A。流速为0.4 mL/min,柱温保持在40℃,样品进样量为2 μL。
1.5 质谱条件
离子源采用ESI源并采用多离子监测模式检测,同时采用正离子扫描模式和负离子扫描模式。其中毛细管电压为2000 V,脱溶剂气温度和流量分别为500℃和1000 L/Hr,锥孔气流量50 L/Hr,离子源温度为150℃。各探针药及其代谢产物的离子对相关质谱参数信息见表1。
1.6 样本处理
1.6.1 血浆样本处理 精密量取100 μL血浆样品置于1.5 mL EP管中,加入20 μL 内标地西泮(0.5 μg/mL)和200 μL乙腈沉淀蛋白,涡旋1 min后在13 000 r/s离心5 min,取上清进样。
1.6.2 孵育样品处理 精密量取200 μL孵育液置于1.5 mL EP管中,加入200 μL冰乙腈和20 μL内标地西泮(0.5 μg/mL)沉淀蛋白,涡旋1 min后在13 000 rpm离心5 min,取上清进样。
1.7 方法学验证
按照FDA[10]和EMA[11]标准,取空白基质、空白基质+对照品和检测样品进行专属性考察;各探针药及其代谢产物取合适濃度的多个点建立标准曲线;各探针药及其代谢产物各取低、中、高3个浓度质控样品(Quality control,QC),每个浓度5个样品,连续分析3 d考察精密度和准确度;取正常处理的QC,空白基质预处理的QC和甲醇稀释处理的QC考察回收率和基质效应;QC样本在室温24 h、4℃、反复冻融3次和-80℃等不同保存条件下考察稳定性。
2 结果
2.1 分析方法专属性
取空白基质、空白基质+对照品、大鼠口服探针药后0.5 h的血浆和孵育后的孵育液按“1.6样本处理”处理,见图1。可知各探针药及其代谢产物峰型良好,无内源性物质干扰。
2.2 标准曲线的绘制
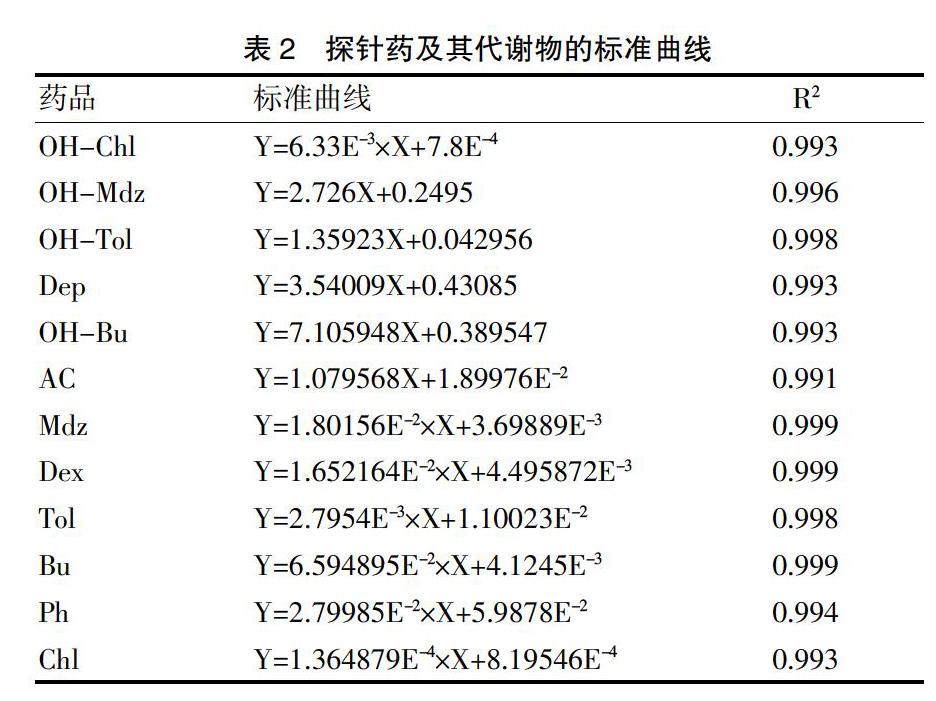
精密吸取各对照品储备液并用甲醇稀释,将Ph、Tol和Chl稀释为0.02、0.05、0.10、0.20、0.50、1.00、2.00、5.00、10.00和20.00 μg/mL;将Mdz、Dex和Bu稀释为0.01、0.02、0.05、0.10、0.20、0.50、1.00和2.00 μg/mL;将OH-Chl、OH-Mdz和OH-Tol稀释为0.5、1.0、2.0、5.0、10.0、20.0和50.0 μM;将Dep、OH-Bu和AC稀释为0.1、0.2、0.5、1.0、2.0、5.0和10.0 μM;用空白基质将上述梯度对照品稀释10倍,按“1.6样本处理”处理并进样,用Masslynx 4.1软件导出标准曲线。见表2。各标曲线性良好,R2均>0.990。
2.3 精密度和准确度
取空白基质,按照“1.7方法学验证”项方法分别加入探针药和代谢产物配成最小定量下限浓度(Lower limit of quantification,LLOQ) 和低、中、高3个浓度QC,Ph、Tol、Chl浓度为2、4、40、1600 ng/mL;Mdz、Bu、Dex浓度为1、3、30、150 ng/mL;OH-Chl、OH-Mdz、OH-Tol浓度为0.05、0.15、1.50、4.50 μM;Dep、OH-Bu、Ac浓度为0.01、0.03、0.30、0.90 μM;对同一浓度进行5个样本分析,连续检测3 d,计算日内、日间精密度和日内、日间准确度,结果表明,LLOQ的精密度和准确度均在20%以内,3个QC的精密度和准确度均在15%以内,符合样品分析要求。
2.4 提取回收率和基质效应
取空白基质,按照“1.7方法学验证”方法,制备LLOQ和3个不同浓度QC,同一浓度进行5个样品分析,得相应的峰面积平均值A1;取空白基质,按照“1.6样本处理”方法处理,取上清,加入相应浓度探针药和代谢产物对照品,配成LLOQ和3个不同浓度QC,同一浓度进行5个样品分析,得相应的峰面积平均值A2,提取回收率为A1/A2。用甲醇按照“1.7方法学验证”方法,制备LLOQ和3个不同浓度QC,同一浓度进行5个样品分析,得相应的峰面积平均值A3,基质效应为A2/A3,结果表明,各探针药及其代谢产物QC的LLOQ提取回收率和3个不同浓度QC的提取回收率均>85%,基质效应均为85%~115%,符合分析要求。
2.5 稳定性考察
取空白基质按“1.7方法学验证”方法,制备LLOQ和3个不同浓度QC,考察样品置于室温24 h和4℃放置6 h,连续冻融3次,-80℃保存2周;每个浓度进行平行5个样品分析,结果RSD和RE结果均在±15%之间,化合物在上述不同条件下均稳定,满足分析要求。
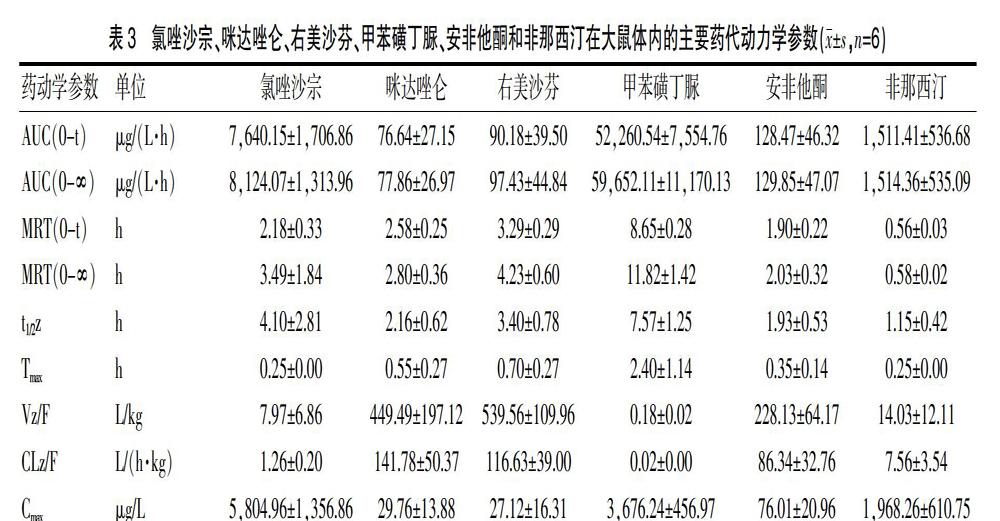
2.6 大鼠体内药动学应用
Sprague-Dawley(SD)大鼠6只,动物许可证号:wydw2019-650,体重为(220±20)g,禁食12 h后开始实验,灌胃给予6种混合探针药溶液,其中Tol的剂量为1 mg/kg,其余为10 mg/kg。给药后0.083、0.250、0.500、1、2、3、4、6、8、12和24 h分别通过大鼠尾静脉采血0.3 mL并置于肝素化EP管中。接着将样品于4000 rpm离心10 min后吸取上清至新的EP管中,并取100 μL血浆按“1.6样本处理”项方法处理后进行UPLC-MS/MS分析。各探针药的药动学参数和药时曲线见表3、图3。
2.7 体外混合探针孵育应用
在正式实验前进行以下的孵育条件的优化:包含大鼠肝微粒体积的优化(2~10 μL);体外孵育缓冲液的优化(0.1 M的磷酸钾缓冲液,0.01 M的PBS 缓冲液和0.1 M Tris-HCl 缓冲液,pH均为7.4);分别在10~100 min时间内进行孵育优化。最终确定孵育体系总体积为200 μL,其中包含大鼠肝微粒体(蛋白质浓度为0.4 mg/mL),磷酸钾缓冲溶液(100 mM,pH=7.4),6种探针底物(Ph为40 μM,Bu和Chl為20 μM,Dex为10 μM,Tol为100 μM,Mdz为5 μM)。在37℃的水浴下预孵育5 min 后加入1 mM NADPH(Nicotinamide adenine dinucleotide phosphate)启动反应,孵育30 min。探针药Ph、Bu、Tol、Dex、Chl、Mdz的反应速率分别为0.0438、0.0037、0.0284、0.0414、0.0628、0.0682 pmol/(min·μg)。
3 讨论
3.1 探针药的选择
在所有CYP亚型中,CYP3A4、CYP2C9、CYP1A2、CYP2E1、CYP2D6和CYP2B6含量较高,分别占CYP总量的40%、20%、13%、10%、2%和2%,并可以代谢大多数临床处方药[12-15]。其中CYP1A2参与多种临床使用药物的代谢,如氯氮平、他克林、替扎尼定、茶碱以及几种重要的内源性化合物[16-17]。CYP2B6代谢3%~8%的广泛使用药物,且据报道在乳腺肿瘤中也有高表达[18-19]。CYP2C9不仅有助于代谢10%~20%的常用处方药,还有脂肪酸、前列腺素类和类固醇激素的代谢[13]。在肝脏和肝外器官中表达的CYP2D6介导大约25%的市售药物代谢,如抗抑郁和抗精神病药物[20]。同时,活动减少的CYP2D6与高加索人群中的帕金森病有关[20]。CYP2E1作为天然乙醇诱导酶代谢活化各种致癌物质,其活性增加与致癌过程有关[21]。此外,超过50%的药物被CYP3A4代谢,包括抗生素、抗病毒药物、苯二氮■类药物、钙通道阻滞剂、他汀类药物和免疫抑制药物[22-23]。
“鸡尾酒”结合LC-MS/MS是现在使用最多、最广的预测药物相互作用的方法,每一种亚型酶均有多种探针药,但是,许多探针药并不是经单一酶代谢,存在特异性不强的现象,根据FDA药物相互作用的指南[24],本实验选取专属性较好的Ph(CYP1A2)、Bu(CYP2B6)、Tol(CYP2C9)、Dex(CYP2D6)、Chl(CYP2E1)和Mdz(CYP3A4)作为“鸡尾酒”的探针药,在大鼠体内、体外实验中均体现出较强的适宜性。
非那西汀的O-去乙基化是使用鸡尾酒法进行体外CYP1A2活性评估的最常用反应,也是首选探针,非那西汀低于50 μM时,对其他探针药代谢基本无影响[25],本实验中,非那西汀浓度为40 μM。安非他酮是CYP2B6的首选探针药,在多种“鸡尾酒”方法中均有应用,安非他酮低于100 μM时对CYP1A2、CYP2C8、CYP2C9、CYP2E1活性无影响,高于50 μM时,对CYP 2C19、CYP2D6、CYP3A产生影响[26],本实验根据安非他酮的Km值,确定安非他酮的浓度为20 μM。双氯酚酸和甲苯磺丁脲均可作为CYP2C9的探针药,在其他“鸡尾酒”方法出现的次数基本相似[27],本实验选取甲苯磺丁脲作为CYP2C9的探针药,浓度为100 μM。作为CYP2D6的探针药,丁呋洛尔和右美沙芬使用较广,但丁呋洛尔除主要经CYP2D6代谢外,还经CYP 1A2、CYP2C8、CYP2C9、CYP2C19代谢,右美沙芬较丁呋洛尔专属性更高,右美沙芬浓度低于25 μM时对其他探针药无影响[28],本实验中,右美沙芬浓度为10 μM。对于CYP2E1的探针药,氯唑沙宗几乎是唯一的选择,虽然苯胺是氯唑沙宗的推荐替代方法,但基本很少用于体外鸡尾酒;氯唑沙宗浓度低于50 μM时对其他亚型酶基本无影响,本实验氯唑沙宗浓度为20 μM。CYP3A4作为肝微粒中含量最多的酶,较常见的探针药有咪达唑仑、睾酮、硝苯地平,其中以咪达唑仑最为常用[29-30],本实验亦选择咪达唑仑作为CYP3A4探针药,浓度为5 μM。
3.2方法优化
本实验采用UPLC-MS/MS方法同时检测6种探针药和6种代谢产物,为了获取较好的峰型、较短的检测时间及较方便的处理方法,比较了UPLC BEH C18、UPLC CORTECS C18和UPLC HSS T3三种色谱柱,其参数分别为(2.1 mm×100 mm,1.7 μm)、(2.1 mm×50 mm,1.6 μm)和(2.1 mm×100 mm,1.7 μm);乙酸乙酯液液萃取和乙腈沉淀法前处理;甲醇-0.1%甲酸水和乙腈-0.1%甲酸水作为流动相,最终选择色谱柱UPLC CORTECS C18(2.1 mm×50 mm,1.6 μm),其可以使峰型良好。同时选择响应较高的乙腈-0.1%甲酸水作为流动相,乙腈沉淀法处理样品,完全能满足本实验探针药及其代谢产物的检测。
[17] Wang X,Yeung JH.Investigation of cytochrome P450 1A2 and 3A inhibitory properties of Danshen tincture[J].Phytomedicine,2012,19(3-4):348-354.
[18] Zheng L,Cao J,Lu D,et al.Imperatorin is a mechanism-based inactivator of CYP2B6[J].Drug Metab Dispos,2015, 43(1):82-88.
[19] Yuce-Artun N,Kose G,Suzen HS.Allele and genotype frequencies of CYP2B6 in a Turkish population[J].Mol Biol Rep,2014,41(6):3891-3896.
[20] Koh KH,Pan X,Zhang W,et al.Kruppel-like factor 9 promotes hepatic cytochrome P450 2D6 expression during pregnancy in CYP2D6-humanized mice[J].Mol Pharmacol,2014,86(6):727-735.
[21] Ye XH,Song L,Peng L,et al.Association between the CYP2E1 polymorphisms and lung cancer risk:A meta-analysis[J].Mol Genet Genomics,2015,290(2):545-558.
[22] Loue C,Tod M. Reliability and extension of quantitative prediction of CYP3A4-mediated drug interactions based on clinical data[J].Aaps J,2014,16(6):1309-1320.
[23] Wang X,Yeung JH.Effects of Salvia miltiorrhiza extract on the liver CYP3A activity in humans and rats[J].Phytother Res,2011,25(11):1653-1659.
[24] FDA.In Vitro Metabolism-and Transporter-Mediated Drug-Drug Interaction Studies Guidance for Industry.2017; Available from:https://www.fda.gov/regulatory-information/search-fda-guidance-documents/vitro-metabolism-and-transporter-mediated-drug-drug-interaction-studies-guidance-industry.
[25] Kim HJ,LeeH,Ji HK,et al.Screening of ten cytochrome P450 enzyme activities with 12 probe substrates in human liver microsomes using cocktail incubation and liquid chromatography-tandem mass spectrometry[J]. Biopharm Drug Dispos,2019,40(3-4):101-111.
[26] Huguet J,Gaudette F,Michaud V,et al.Development and validation of probe drug cocktails for the characterization of CYP450-mediated metabolism by human heart microsomes[J].Xenobiotica,2019,49(2):187-199.
[27] Valicherla GR,Mishra A,Lenkalapelly S,et al.Investigation of the inhibition of eight major human cytochrome P450 isozymes by a probe substrate cocktail in vitro with emphasis on CYP2E1[J].Xenobiotica,2019,49(12):1396-1402.
[28] Atkinson A,Kenny JR,Grime K.Automated assessment of time-dependent inhibition of human cytochrome P450 enzymes using liquid chromatography-tandem mass spectrometry analysis[J].Drug Metab Dispos,2005,33(11):1637-1647.
[29] Satoh T,Fujisawa H,Nakamura A,et al.Inhibitory effects of eight green tea catechins on cytochrome P450 1A2, 2C9,2D6,and 3A4 Activities[J].J Pharm Pharm Sci,2016, 19(2):188-197.
[30] Pouyfung P,Sarapusit S,Rongnoparut P.Effects of vernonia cinerea compounds on drug-metabolizing cytochrome P450s in human liver microsomes[J].Phytother Res,2017, 31(12):1916-1925.
(收稿日期:2020-03-25)

