miR-331-3p靶向NRP2抑制宫颈癌细胞的增殖、迁移以及侵袭
余 琴 陈昌谊 龚 瑶
1.重庆市九龙坡区人民医院(401329);2.重庆医科大学附属第一医院
宫颈癌在妇科恶性肿瘤中发病率位居第二,而死亡率居首位[1]。手术、化学疗法和放射疗法是目前常用治疗方法。微小RNA(miRNA)是短调控RNA,通过与目标基因转录本的互补位点结合翻译抑制控制基因表达[2]。研究发现,miR-331-3p在多种肿瘤发生中起抑制作用,在肝癌细胞株(HepG2、SMMC-7721、Bel-7402等)中表达下调,miR-331-3p通过下调E2F1促进肝癌细胞增殖和迁移,且随着肝癌细胞株侵袭转移程度增加表达下调[3]。本研究通过探讨miR-331-3p靶向神经纤毛蛋白-2(NRP2)对宫颈癌细胞增殖、迁移以及侵袭的影响,为临床靶向治疗宫颈癌提供理论基础。
1 材料与方法
1.1 材料
1.1.1主要实验试剂人正常宫颈上皮细胞HcerEpic、人宫颈癌HeLa细胞系(美国ATCC细胞库),10%胎牛血清(美国Clark Bioscience公司),胰蛋白酶(含EDTA)(美国Gibco公司),miR-331-3p、NRP2质粒和各引物序列(广州市锐博生物科技有限公司),50 U/ml青霉素-链霉素、RIPA裂解液、Trizol试剂和BCA试剂盒(上海碧云天生物技术有限公司),Lipofectamine 2000(美国Invitrogen公司),兔来源单克隆一抗NRP2、PCNA、MMP-2、MMP-9、GAPDH和山羊抗兔单克隆二抗(美国Abcam公司),逆转录试剂盒及SYBR GreenPCR Master Mix 试剂盒(TaKaRa公司),Transwell小室、F12培养基(美国BD公司),ECL发光液、双荧光素酶报告基因检测试剂盒(美国Promega公司)。
1.1.2主要仪器实时荧光定量PCR仪、ECL发光仪(Bio-Rad公司),低温高速离心机(Thermo公司),倒置光学显微镜和成像系统(Nikon),酶标仪(Servicebio),ABI 7900序列检测系统上的Premix Ex TaqTM(TaKaRa公司)。
1.2 建立细胞模型及分组
人宫颈癌HeLa细胞加入含有50 U/ml青霉素-链霉素和10%胎牛血清的RPMI-1640培养基中,并在37℃ 5% CO2培养箱中孵育。根据转染不同将HeLa细胞分为对照组、mimic NC组、miR-331-3p mimic组、siRNA NC组、si-NRP2组、miR-331-3p mimic+NRP2组。将100 μl质粒终浓度为100 nmol/L的Lipofectamine 2000混合液转染至各组,其中mimic组和miR-331-3p mimic组分别转染mimic NC和miR-331-3p mimic质粒;siRNA NC 组和si-NRP2组分别转染siRNA NC和si-NRP2;miR-331-3p mimic+NRP2组转染miR-331-3p mimic和NRP2过表达质粒;对照组不转染。
1.3 观察指标
1.3.1miR-331-3p靶基因利用TargetScan数据库(http://www.targetscan.org/vert_72/)预测miR-331-3p潜在靶基因。将扩增的NRP2-3'-UTR-WT和相应的NRP2-3'-UTR-Mut分别插入pGL3荧光素酶载体(Promega)中。通过Lipofectamine 2000将NRP2的野生型或突变型3'-UTR与miR-331-3p模拟物或模拟物对照共转染至HeLa细胞,使用双重萤光素酶报告基因检测试剂盒检测转染后48 h的相对萤光素酶活性。
1.3.2miR-331-3p和NRP2mRNA表达使用TRIzol试剂从HcerEpic和各组HeLa细胞中分离总RNA。使用逆转录试剂盒将提取的总RNA逆转录成cDNA。逆转录温度条件:37℃持续15 min,85℃持续5 s。qRT-PCR测定,通过SYBR进行分析。以U6或GAPDH为内参。所用引物:miR-331-3p:Forward:5'-GAGCTGAAAGCACTCCCAA-3'和Reverse:5'-CACACTCTTGATGTTCCAGGA-3';U6:Forward:5′-AGAGCCTG TGGTGTCCG-3′和Reverse:5′-CATCTTCAAAGCACTTCCCT-3′;NRP2:Forward:5'-CCCCGAACCCAACCAGAAGA-3'和Reverse:5'-GAATGCCATCCCAGATGTCCA-3';GAPDH:Forward:5'-GGCACTGAGA AGCGGGGCCG-3'和Reverse:5'-CCCTTGTTTTTTGCTTCCC TT-3'。qRT-PCR条件为95℃ 5 min,95℃ 30 s,58℃ 30 s,共35个循环,使用2-△△Cq确定基因相对表达。
1.3.3NRP2、MMP-2、MMP-9、PCNA蛋白表达将转染的细胞在含蛋白酶抑制剂的RIPA缓冲液中冰上溶解,使用BCA试剂盒测量总蛋白质浓度,蛋白质裂解物用10%SDS-PAGE凝胶分离,转移到PVDF膜上,用TBST配置的5%脱脂牛奶室温封闭2 h。将膜与一抗[NRP2(1:4000)、GAPDH(1:1000)、MMP-2(1:2000)、MMP-9(1:2000)和PCNA(1:2000)]在4℃过夜。室温下将该膜与抗兔IgG(1:5000)孵育2 h。化学发光检测系统(Beyotime)检测蛋白条带。
1.3.4细胞增殖使用CCK-8试剂盒确定细胞活力。转染后,将100 μl细胞(每孔5×103个细胞)接种到96孔板中。在0、24、48和72 h,将10 μl CCK-8溶液添加到每个孔中。孵育1 h后酶标仪测定450 nm处吸光度。
1.3.5细胞迁移将HeLa(5×105个/孔)细胞铺在6孔板中12 h,以80%~90%汇合,使用无菌移液器吸头刮擦0.5 mm。每个孔用PBS洗涤两次。使用倒置显微镜在0、24 h拍摄细胞迁移到划痕的过程。用Image-Pro Plus软件6.0分析结果。
1.3.6Transwell实验检测细胞侵袭将转染的细胞用胰蛋白酶消化,洗涤并以每孔1×105个细胞的接种密度接种在标准的24孔室(上室)中,并将FBS作为吸引剂加入到培养板(下室)中,孵育24 h后将下室固定并用结晶紫染色,48 h后使用显微镜计侵袭细胞数。
1.4 统计学方法
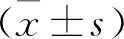
2 结果
2.1 miR-331-3p在宫颈癌HeLa细胞中表达
与人正常宫颈上皮细胞(1.00±0.04、1.00±0.05)相比,宫颈癌HeLa细胞中miR-331-3p(0.43±0.03)下降(P<0.05),而NRP2 mRNA(2.34±0.08)升高(P<0.05)。
2.2 miR-331-3p对NRP2基因的靶向调控作用
与对照组(1.00±0.05)和mimic NC组(0.98±0.07)相比,miR-331-3p mimic组miR-331-3p(4.64±0.08)升高(P<0.05);与对照组(1.00±0.05)、mimic NC组(0.99±0.06)或siRNA NC组(0.98±0.04)相比,miR-331-3p mimic组(0.54±0.05)和si-NRP2组NRP2 mRNA(0.26±0.05)均降低(均P<0.05);与对照组(1.01±0.06)、mimic NC组(1.04±0.06)或siRNA NC组(1.01±0.06)相比,miR-331-3p mimic组(0.76±0.06)和Si-NRP2组NRP2(0.37±0.03)均降低(均P<0.05)。见图1(2486页)。行双重荧光素酶报告基因检测,与mimic NC组(1.00±0.09)相比,miR-331-3p mimic组NRP2 3'-UTR-WT的报告基因的相对荧光素酶活性(0.35±0.05)降低(P<0.05),但miR-331-3p组NRP2 3'-UTR-MUT的萤光素酶活性(1.04±0.06)与mimic NC组(1.03±0.07)相比没有变化(P>0.05)。
2.3 miR-331-3p过表达或抑制NRP2表达对HeLa细胞增殖能力影响
细胞培养72 h后,与对照组(0.50±0.06)和mimic NC组(0.49±0.05)相比,过表达miR-331-3p的HeLa细胞OD值(0.34±0.04)减少,增殖能力降低(P<0.05);与对照组(0.52±0.06)和siRNA NC组(0.51±0.05)相比,抑制NRP2表达的HeLa细胞OD值(0.29±0.06)减少,增殖能力降低(P<0.05)。
2.4 miR-331-3p过表达或抑制NRP2表达对HeLa细胞迁移、侵袭能力的影响
与对照组(0.31±0.05、162±35)和mimic NC组(0.35±0.04、188±21)相比,过表达miR-331-3p后HeLa细胞划痕宽度比(0.88±0.07)增加,细胞侵袭细胞数目(67±13)减少(均P<0.05)。见图2A(2486页)。与对照组(0.30±0.04、163±23)和siRNA NC组(0.34±0.05、161±28)比较,抑制NRP2的表达HeLa划痕宽度比(0.74±0.10)增加,细胞侵袭细胞数目(26±5)减少(均P<0.05)。见图2B(2486页)。
2.5 miR-331-3p过表达或抑制NRP2表达对PCNA、MMP-2和MMP-9蛋白表达影响
Western blot检测结果显示,过表达miR-331-3p或抑制NRP2的表达均可抑制PCNA、MMP-2和MMP-9蛋白表达(均P<0.05)。与对照组(0.70±0.06、0.73±0.06、0.44±0.05)和mimic NC组(0.71±0.06、0.72±0.06、0.45±0.05)相比,miR-331-3p mimic组PCNA、MMP-2、MMP-9蛋白表达量(0.07±0.01、0.10±0.02、0.15±0.02)下降(P<0.05)。见图3A(2486页);与对照组(1.22±0.07、0.70±0.06、0.81±0.06)和siRNA NC组(1.25±0.07、0.72±0.05、0.79±0.06)相比,si-NRP2组PCNA、MMP-2、MMP-9蛋白表达量(0.18±0.02、0.06±0.02、0.39±0.03)下降(P<0.05)。见图3B(2486页)。
2.6 过表达NRP2逆转miR-331-3p的作用
与miR-331-3p mimic组(0.32±0.03、0.82±0.04、69±8)相比,过表达NRP2后,HeLa细胞OD值(0.65±0.07)增加,细胞划痕宽度比(0.15±0.03)减少、侵袭细胞数目(203±19)增加,细胞增殖、迁移和侵袭能力均提高(均P<0.05)。见图4(2486页)。
3 讨论
宫颈癌发病机制复杂目前尚未明确定论。大量证据表明,miRNA在人类宫颈癌发展中起着重要作用[4];在调节基因表达以及其他相关过程(例如侵袭和转移)中起至关重要作用[5]。而分子层面细胞癌变的基础是致癌因子的激活与抑癌基因的缺失,因此,研究宫颈癌相关的基因异常表达成为临床研究热点。
miR-331-3p已被鉴定为与肿瘤相关的miRNA,并作为独立预后因素。Epis等[6]发现miR-331-3p和Aurora激酶抑制剂II联合治疗可抑制前列腺癌的发生和进展。Chen等[7]报道,在肝细胞癌患者中,血清miR-331-3p和miR-182可作为治疗性生物标志物。Zhang等[8]证实miRNA-331-3p通过靶向elF4B基因抑制鼻咽癌细胞增殖并诱导细胞凋亡,进而阻断PI3K-AKT信号通路。miR-331-3p已被证实可调控细胞的增殖、转化、迁移和侵袭,然而在宫颈癌细胞中的作用尚不清楚。鉴于miRNA被广泛称为肿瘤调节剂,本研究为证明miR-331-3p在宫颈癌中起重要作用,通过qRT-PCR将miR-331-3p鉴定为宫颈癌中下调miRNA。此外,miR-331-3p的过表达能够抑制宫颈癌细胞的增殖、侵袭和迁移,抑制宫颈癌细胞PCNA、MMP-2、MMP-9的蛋白表达[9-10]。
有研究miR-331-3p 通过抑制不同靶基因来抑制多种人类癌症[11]。在人肾癌细胞中,miR-331-3p通过靶向HER2和NRP2抑制细胞增殖[12]。为更深一步确认miR-331-3p在宫颈癌的发生发展中调控作用,本研究通过Targetscan数据库预测miR-331-3p的直接靶基因,结果表明miR-331-3p能够与NRP2 3'-UTR直接靶向结合,表明NRP2可能是miR-331-3p的直接靶基因。进一步采用双荧光素酶报告基因检测和Western blot,结果验证了NRP2是miR-331-3p的直接作用靶基因。
NRP2是人类端粒相关聚合酶家族成员之一,近期有研究表明,在肺癌,结肠直肠癌、胰腺癌以及神经母细胞瘤中NRP2表达上调。Borkowetz等[13]研究表明NRP2是前列腺腺泡腺癌一个独立预后因素,可缩短癌症患者的生存期。Li等[14]研究证明NRP2促进甲状腺乳头状癌细胞增殖、迁移和侵袭,并通过调节AKT和ERK磷酸化信号通路促进上皮间充质转化。Moriarty等[15]发现NRP2促进了黑色素瘤的进展和生长。本研究发现,抑制NRP2的表达均可抑制细胞生长速度,减少侵袭细胞数目,增加划痕宽度比;过表达miR-331-3p后NRP2表达下调,HeLa细胞增殖、迁移和侵袭能力受到阻碍,且抑制NRP2的表达可抑制宫颈癌细胞PCNA、MMP-2、MMP-9蛋白表达。因此,提示miR-331-3p通过靶向NRP2基因抑制宫颈癌细胞增殖、迁移和侵袭。在过表达miR-331-3p的基础上过表达NRP2能够逆转miR-331-3p对宫颈癌HeLa细胞增殖、迁移和侵袭的抑制作用。
综上所述,miR-331-3p通过靶向NRP2抑制宫颈癌HeLa细胞的增殖、迁移和侵袭。进一步将研究miR-331-3p抑制宫颈癌细胞增殖、迁移及侵袭的作用机制,为临床寻找宫颈癌治疗靶点提供新方向。

