平菇培养料发酵后对霉菌抑制机制研究
崔 筱,刘 芹,丁亚通,康源春,胡素娟,宋凯博,张玉亭,孔维丽
(1.河南省农业科学院 植物营养与资源环境研究所,河南 郑州 450002; 2.周口市农业科学院,河南 周口 466000)
平菇在全球广泛栽培,主产国在中国、日本、印度、德国、韩国、法国等,目前是我国栽培量最大、栽培范围最广的食用菌[1-2]。平菇栽培主要有生料、熟料、发酵料等几种方式,几种方式各有利弊[3]。生料栽培污染率高,菌丝吃料慢,在当前生产中很少使用[4];熟料栽培培养料要经过100 ℃以上蒸煮灭菌和无菌接种过程,可减少污染率,提高菌袋成活率;发酵料栽培要求将培养料堆制8~10 d,料温上升至70 ℃以上时,每间隔24~36 h翻堆一次,维持5~6 d,发酵结束后采用开放式接种,菌袋成功率在98%以上[5],与生料、熟料栽培方式相比,发酵料栽培具有工艺简单、污染率极低、菌丝生长快、生产效率高等一系列优点,成为目前我国北方地区应用最为广泛的栽培方式。但是,将培养料经简单发酵并采用开放式接种方法抗杂菌污染机制,及培养料在堆制过程中产生的生理生化反应目前还不清楚。
前期研究表明,使用堆肥或者有机肥提取物可控制植物病原菌生长[6-9],其抑菌机制主要包括:病原菌菌丝生长和孢子萌发受到抑制;病原真菌菌丝发生皱缩;细胞质泄漏;细胞膜通透性、丙二醇(MDA)、活性氧含量和抗氧化酶等与代谢及呼吸作用相关的酶活性发生一系列变化。平菇培养料在发酵过程中微生物种群的种类及演变与堆肥初期较为相似,然而,平菇培养料发酵后对霉菌菌丝及孢子萌发是否有影响,其抑制机制尚未见相关报道。鉴于此,通过玉米芯配制,经10 d发酵,提取不同时期发酵料的浸提液,培养深绿木霉(Trichodermaatroviride)、灰绿青霉(Penicilliumglaucum)菌丝及孢子,随后观察、检测发酵料浸提液对菌丝长势、菌丝生物量、孢子萌发率、细胞形态、琥珀酸脱氢酶(SDH)活性、三磷酸腺苷酶(ATP)活性、碱性磷酸酶(AKP)含量变化的影响,以期揭示抑菌机制,为平菇生产工艺的改进和提高提供理论参考,为进一步研究鉴定发酵过程中产生的抑菌物质及分离培养微生物奠定基础。
1 材料和方法
1.1 材料
1.1.1 参试菌株及培养基 深绿木霉(T.atroviride)、灰绿青霉(P.glaucum)为从感染的菌袋上分离并测序鉴定的菌株。培养料配方:玉米芯84%、麸皮10%、尿素1%、石灰5%,料水比1∶2.4[5]。PDA培养基:马铃薯200 g、葡萄糖20 g、琼脂20 g,蒸馏水定容至1 L,121 ℃灭菌30 min。PDB培养基:马铃薯200 g、葡萄糖20 g,蒸馏水定容至1 L,121 ℃灭菌30 min。发酵料浸提液培养基:发酵料浸提液1 L、琼脂粉17 g,混合搅拌均匀后加热溶解,分装入250 mL锥形瓶中,115 ℃灭菌30 min,液体培养基为不加琼脂粉。
1.1.2 主要试剂 琼脂粉、SDH试剂盒、AKP试剂盒、ATP试剂盒,均购自北京索莱宝科技有限公司。
1.2 方法
1.2.1 发酵料浸提液样品的制备 按照文献[10]的发酵方法,共堆制3组培养料,每组培养料干料质量为250 kg,共发酵10 d。以建堆第1天的培养料为对照(T1),每2 d翻堆一次,每翻堆一次取一次样品,至发酵结束共翻堆4次,5次取样分别标记为T1、T2、T3、T4、T5。按照料堆形状分别从左中右、上中下9个位点取样1 kg,然后均匀混合为1份样品。称取不同时期玉米芯发酵料250 g,加蒸馏水定容至500 mL,静置浸泡4 h后用4层纱布过滤,得到终质量浓度为500 g/L的浸提液。
1.2.2 发酵料浸提液对霉菌菌丝生长的影响 利用T1、T2、T3、T4、T5 5个时期发酵料浸提液,按照90%体积分数添加到PDA培养基内制成固体培养基,用直径5 mm的打孔器打取深绿木霉、灰绿青霉菌块分别接种于90 mm培养皿内,于28 ℃培养箱中培养3 d,每个处理重复3次,采用十字划线法记录菌丝生长长度,计算抑菌率。
抑菌率=(对照组菌落半径-处理组菌落半径)/对照菌落半径×100%[10]。
1.2.3 发酵料浸提液对霉菌菌丝生长的影响 将1.2.1中终质量浓度为500 g/L的发酵料浸提液,按照10%、20%、40%、80%、100%的体积分数比例分别添加到PDA培养基内制成固体培养基,分别接种深绿木霉、灰绿青霉菌种块,每个处理重复3次,以不添加浸提液的PDA培养基作为对照,于28 ℃培养箱中培养3 d,3 d后观察记录菌丝生长情况,采用十字划线法测量菌丝生长长度,并计算抑菌率,方法同1.2.2。
1.2.4 发酵料浸提液对霉菌孢子萌发的影响 将浓度为106cuf/mL的深绿木霉、灰绿青霉孢子悬浮液,接种于含有不同体积分数发酵料浸提液(80%、100%)的250 mL三角瓶内,每瓶装100 mL浸提液,以清水为对照,每个处理重复3次,于28 ℃,150 r/min摇床培养26 h,26 h后于40倍光学显微镜下观察孢子萌发情况,计算孢子萌发率。
孢子萌发率=萌发孢子数/观测孢子总数×100%。
孢子萌发抑制率=(对照组孢子萌发率-处理组孢子萌发率)/对照组孢子萌发率×100%。
1.2.5 发酵料浸提液对霉菌菌丝生物量的影响 将100 mL不同体积分数的发酵料浸提液(10%、20%、40%、80%、100%)加入到250 mL三角瓶内,每瓶分别接种5块直径为5 mm的深绿木霉、灰绿青霉菌块,28 ℃、150 r/min振荡培养48 h,滤纸过滤后,收集菌丝体,60 ℃烘干后称量,以不加浸提液的PDB培养基为对照,每个处理重复3次。
1.2.6 发酵料浸提液对霉菌细胞结构的影响 将直径5 mm的深绿木霉、灰绿青霉菌块接种到80%体积分数浸提液的PDA固体培养基上,插片培养,以不含浸提液的PDA培养基为对照,每组重复3次,28 ℃培养48 h后,取菌丝体制作样本,用透射电镜、扫描电镜观察2种霉菌菌丝体细胞形态。
1.2.7 发酵料浸提液对霉菌细胞内AKP含量的影响 将深绿木霉、灰绿青霉的菌丝体用直径5 mm打孔器打孔,接种于100 mL含有80%、100%体积分数发酵料浸提液的PDB培养基内,以不加浸提液的PDB培养基为对照,每瓶接种5块菌块,28 ℃、150 r/min振荡培养48 h,每间隔12 h取样1.5 mL,于4 ℃、12 000 r/min离心10 min,弃沉淀后取上清液,用AKP试剂盒检测AKP含量。
1.2.8 发酵料浸提液对霉菌SDH活性的影响 将深绿木霉、灰绿青霉2种霉菌的菌丝体用直径5 mm的打孔器打孔,分别接种于100 mL含有80%体积分数、100%体积分数浸提液的PDB培养基内,以不加浸提液的PDB培养基为对照,每瓶接种5块AKP,28 ℃,150 r/min振荡培养48 h,每隔12 h取样1.5 mL,于4 ℃、12 000 r/min离心10 min后,弃上清收集菌丝体,快速组织细胞研磨仪研磨菌丝体,利用SDH试剂盒测定SDH活性。
1.2.9 发酵料浸提液对霉菌ATP活性的影响 按照1.2.8中的方法,将深绿木霉、灰绿青霉2种霉菌的菌丝体用直径5 mm的打孔器打孔,分别接种于100 mL含有80%、100%体积分数浸提液的PDB培养基内,以不加浸提液的PDB培养基为对照,每瓶接种5块AKP,28 ℃、150 r/min振荡培养48 h,每隔12 h取样1.5 mL,4 ℃、12 000 r/min离心10 min,弃上清,收集菌丝体,用快速组织细胞研磨仪研磨菌丝体后,超微量ATP试剂盒测定ATP活性。
1.3 数据处理
用SPSS 19.0软件进行数据差异性分析,结果以平均值±标准误表示。
2 结果与分析
2.1 发酵料浸提液对霉菌生长的影响
2.1.1 发酵料浸提液对2种霉菌菌丝体生长的影响 在发酵T1~T5周期内,随着发酵时间的延长,发酵料浸提液对深绿木霉、灰绿青霉2种霉菌菌丝的抑菌率逐渐升高,T4时期抑菌率达到最高,分别为100%、97.9%,较T1、T2、T3、T5时期分别高39.9、30.5、18.3、8.0个百分点,41.6、25.4、19.7、3.0个百分点。发酵结束后,随着培养料浸提液体积分数的增加抑菌作用逐渐增强,体积分数为100%时,对深绿木霉、灰绿青霉2种霉菌菌丝的抑菌率分别为81.1%、75.9%,但80%、100%体积分数对2种菌丝抑菌率没有差异(图1a、b)。

图1 不同体积分数(a)和不同发酵时期(b)发酵料浸提液对深绿木霉、灰绿青霉菌丝的抑制效果Fig.1 Inhibition effect of different concentrations(a) and different fermentation stages(b) of fermentation extract on T.atroviride and P.glaucum mycelium
2.1.2 发酵料浸提液对2种霉菌孢子萌发的影响 从表1可以看出,无菌水处理后,灰绿青霉、深绿木霉孢子的萌发率分别为87.6%、91.7%。与对照相比,体积分数为80%的无菌发酵料浸提液处理时,2种霉菌孢子萌发率分别为26.2%、15.2%,抑制率分别为61.4%、75.3%;当用100%体积分数无菌发酵料浸提液处理时,2种霉菌孢子的萌发率分别为12.3%、3.6%,抑制率分别为76.5%、88.1%。发酵料浸提液对2种霉菌孢子萌发有显著的抑菌作用,随浸提液浓度增加,抑制作用增强,100%体积分数较80%体积分数抑制率分别高12.8、15.1个百分点(表1)。

表1 发酵料浸提液对深绿木霉、灰绿青霉孢子萌发的影响Tab.1 Effect of fermentation extract on spore germination of T.atroviride and P.glaucum %
2.1.3 发酵料浸提液对2种霉菌菌丝生物量的影响 不同体积分数发酵料浸提液对深绿木霉、灰绿青霉2种霉菌菌丝体的生物量积累有显著抑制作用,不同处理间差异显著,随浸提液浓度的增加,菌丝生物量逐渐减少(表2)。当发酵料浸提液体积分数为100%时,深绿木霉、灰绿青霉菌丝生物量最少,分别为2.2、2.3 mg/mL,较对照分别减少4.3、4.2 mg/mL,减少率分别为66.2%、64.6%(表2),较80%时分别减少1.7、1.2 mg/mL,减少率为43.6%、34.3%。
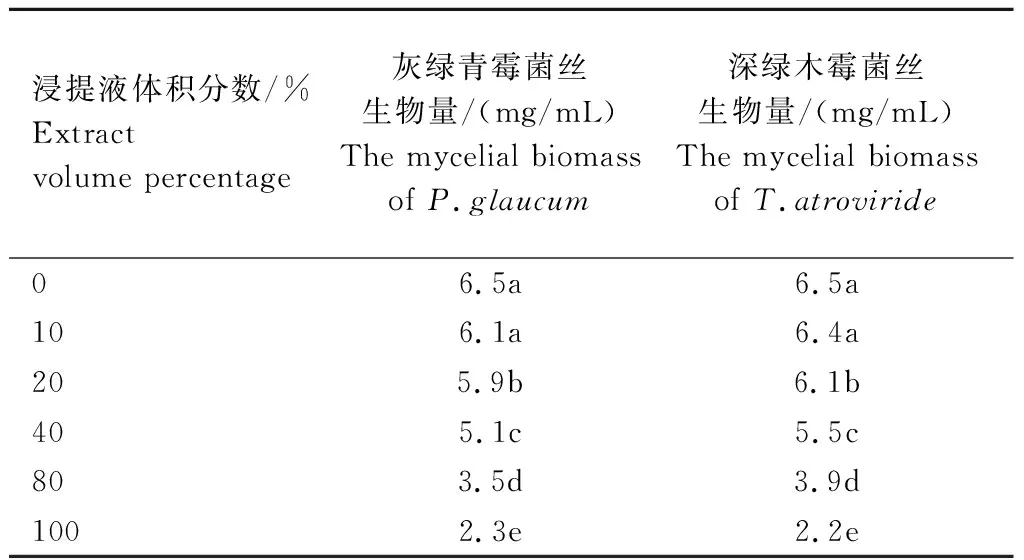
表2 不同体积分数发酵料浸提液对深绿木霉、灰绿青霉菌丝生物量的影响Tab.2 Effects of fermentation extracts at different concentration on the mycelial biomass of
2.2 发酵料浸提液对霉菌细胞的影响
2.2.1 发酵料浸提液对2种霉菌细胞结构的影响 扫描电镜结果表明,加有80%体积分数发酵料浸提液的培养基培养后,菌丝细胞壁皱褶萎缩。未经处理的深绿木霉菌丝细胞壁、细胞膜完整光滑,线粒体、液泡、核糖体完整,细胞质均匀,内容物丰富,孢子饱满,菌丝直径粗细均匀;发酵料浸提液处理后的木霉菌丝细胞壁、细胞膜破裂,线粒体、液泡膜破裂,细胞内容物外流,正常生长受阻(图2a、b)。对照组灰绿青霉菌丝细胞边缘光滑,液泡、细胞质、核糖体、线粒体完整,细胞内容物丰富均匀;发酵液处理后的青霉菌丝细胞壁边缘粗糙,隔膜断裂,液泡、线粒体膜破裂,核糖体分布不均匀;内容物减少(图3a、b)。

CW:细胞壁;V:液泡;CY:细胞质;M:线粒体;H:菌丝CW:Cell wall;V:Vacuole;CY:Cytoplasm;M:Mitochondria;H:Hypha图2 80%体积分数发酵料浸提液处理前后深绿木霉菌丝(a)及菌丝细胞结构(b)的变化Fig.2 Morphological(a) and ultrastructural(b) changes of T.atroviride mycelium treated with 80% concentration of extract liquid
2.2.2 发酵料浸提液对2种霉菌细胞内AKP含量的影响 AKP是存在于细胞壁与细胞膜之间的一种酶,正常情况下,该酶不能透过细胞壁或细胞膜渗透到细胞外,当细胞壁或细胞膜遭受到一定程度的破坏后,细胞透性增加,AKP会大量渗透到细胞外,结果表明,不同体积分数发酵料浸提液培养后,深绿木霉、灰绿青霉2种霉菌菌悬液中AKP含量明显高于对照,100%体积分数发酵料浸提液处理的2种霉菌菌丝体AKP含量高于80%体积分数处理的霉菌菌丝,对照组AKP含量变化趋势不显著;不同体积分数发酵料浸提液培养木霉菌丝,培养液中AKP含量持续上升,48 h时,80%、100%体积分数培养液中AKP含量分别较对照增加255.6%、333.3%;青霉菌丝培养液中AKP含量在24 h后迅速增加,80%、100%体积分数浸液培养48 h时AKP含量较24 h分别增加320.0%、371.4%,较对照分别增加320.0%和560.0%(图4a、b)。
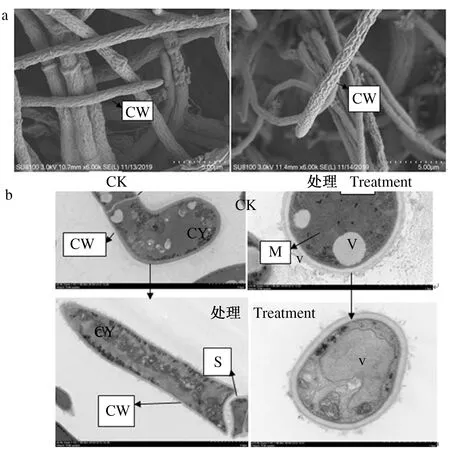
CW:细胞壁;V:液泡;CY:细胞质;S:隔膜;M:线粒体CW:Cell wall;V:Vacuole;CY:Cytoplasm;S:Septum;M:Mitochondria图3 80%体积分数发酵料浸提液处理前后灰绿青霉菌丝(a)及菌丝细胞结构(b)的变化Fig.3 Morphological (a) and ultrastructural (b) changes of P.glaucum mycelium treated with 80% concentration of extract liquid
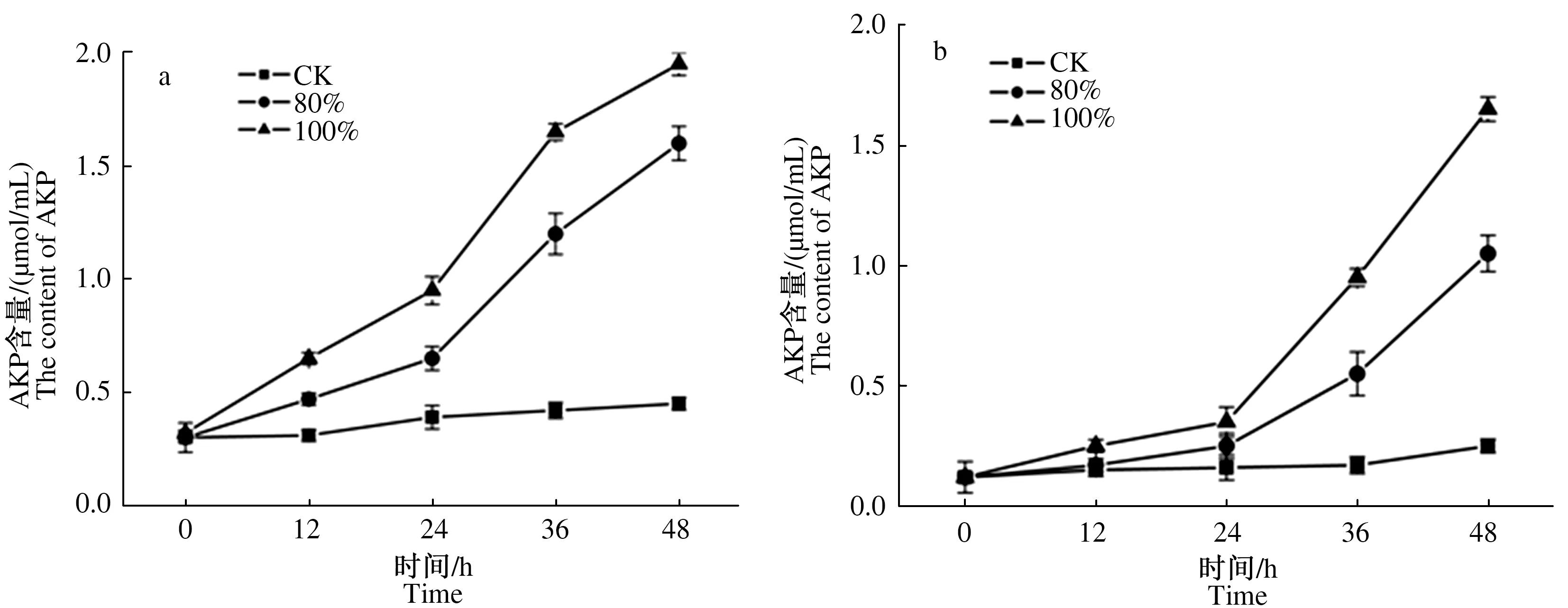
图4 发酵料浸提液处理不同时间对深绿木霉(a)、灰绿青霉(b)菌丝AKP含量的影响Fig.4 Effects of fermentation broth treatment at different time on AKP enzyme content of T.atroviride(a) and P.glaucum(b) hyphae
2.3 发酵料浸提液对霉菌代谢的影响
2.3.1 发酵料浸提液对2种霉菌SDH活性的影响 SDH是结合于线粒体内膜上,连接氧化磷酸化与电子传递的枢纽之一,可以为真核细胞线粒体需氧和产能的呼吸链提供电子,是线粒体的一种标志性酶。由图5a、b可知,不同体积分数发酵料浸提液处理后深绿木霉、灰绿青霉SDH活性低于对照,随着培养时间的延长,对照组SDH活性升高,不同体积分数发酵料浸提液处理后2种霉菌菌丝体SDH活性降低,80%体积分数处理SDH活性高于100%体积分数处理,80%、100%体积分数发酵料浸提液处理木霉菌丝后,SDH活性呈下降趋势,48 h降至最低,分别为12.4、8.1 U/mg,较初始活性分别下降26.6%、49.1%;80%、100%体积分数发酵料浸提液处理青霉菌丝后,SDH活性先升高后下降,24 h至最高,分别为24.1、22.3 U/mg,随后开始下降,48 h降至最低,分别为15.9、10.3 U/mg,较24 h分别下降34.0%、53.8%。
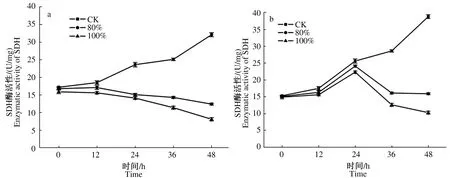
图5 发酵料浸提液处理不同时间对深绿木霉(a)、灰绿青霉(b)菌丝SDH活性的影响 Fig.5 Effect of fermentation broth treatment at different time on SDH enzyme activity of T.atroviride(a) and P.glaucum(b) hyphae
2.3.2 发酵料浸提液对2种霉菌ATP活性的影响 ATP活性与菌丝的生长能量代谢关系密切。由图6a、b可知,48 h培养过程中,深绿木霉菌丝ATP活性呈先上升后下降趋势,36 h达到最高,为5.2 U/mg,80%、100%体积分数的发酵料浸提液处理后的木霉菌丝ATP活性先下降后略有回升,且低于初始ATP活性,48 h升至3.3、1.9 U/mg,较对照降低15.4%、51.3%;灰绿青霉菌丝ATP活性呈先上升后下降趋势,2组处理的ATP活性均低于对照组,80%体积分数的发酵料浸提液处理后青霉菌丝ATP活性高于100%体积分数处理,随发酵料浸提液浓度增加,酶活性下降,对照组ATP活性在36 h升至最高,为4.3 U/mg,80%、100%体积分数的发酵料浸提液处理后24 h升至最高,分别为2.3、1.9 U/mg,较对照组分别减少46.5%、55.8%,随后酶活性下降,48 h降至最低。

图6 发酵料浸提液处理不同时间对深绿木霉(a)、灰绿青霉(b)菌丝ATP活性的影响Fig.6 Effect of fermentation broth treatment at different time on ATP enzyme activity of T.atroviride (a) and P.glaucum(b) hyphae
3 结论与讨论
木霉菌、青霉菌等是危害平菇菌丝体的主要杂菌,大量的青霉、木霉孢子飘散在平菇、蘑菇栽培场地上空,以寻找合适的环境生长繁殖[11],研究表明,这些杂菌被认为是蘑菇大量减产的主要原因[12]。目前,在食用菌生产过程中绿色木霉等杂菌的防治主要采用化学杀菌剂,由于平菇等真菌与病原真菌的亲缘关系较近,化学药剂防治杂菌防治效果并不十分理想且容易造成环境污染[13],因此,食用菌的病害防治比其他农作物的病虫害防治困难。有报道认为,培养料经堆制发酵后能降低杂菌污染,提高食用菌产量。吴小平等[14]用木屑发酵料栽培毛木耳,能大幅度降低霉菌污染,但并没有揭示其抑菌机制。本研究以玉米芯为原料发酵后制备浸提液,系统研究其对霉菌的抑菌机制,结果表明,发酵后培养料浸提液通过破坏其细胞壁、细胞膜,导致细胞内溶物外流,降低与代谢、呼吸相关酶活性,从而抑制杂菌的生长繁殖。发酵料浸提液随体积分数增加抑菌率也增加,体积分数为100%时,对深绿木霉、灰绿青霉菌丝的抑菌率分别为81.1%、75.9%,孢子萌发抑制率分别为88.1%、76.6%,菌丝生物量分别较对照减少4.3、4.2 mg/mL;经扫描电镜、透射电镜观察,灰绿青霉菌丝细胞壁边缘粗糙,隔膜断裂,深绿木霉菌丝细胞壁、细胞膜破裂,液泡、线粒体膜破裂,核糖体分布不均匀,细胞内容物减少,导致AKP外流,发酵料浸提液内AKP含量分别高于对照330.0%、560.0%;与呼吸相关的SDH活性分别下降49.1%、53.8%;与代谢相关的ATP活性分别较对照低51.3%、55.8%,从而阻止杂菌的生长,为后期平菇栽培提供优良环境。
大量研究表明,化学试剂(多菌灵、甲基硫菌灵、苯菌灵等)、植物源农药(鱼藤酮、苦参碱等)、壳聚糖类、生防菌等对霉菌病原菌的抑菌机制主要是破坏病原菌的细胞膜、细胞壁,从而影响与病原菌呼吸、代谢相关的酶活性,最终抑制病原菌产生孢子及孢子萌发。本研究中,高温灭菌后的发酵料浸提液既抑制深绿木霉、灰绿青霉孢子萌发,又抑制菌丝生长。推断发酵过程中微生物的代谢产生了某种抑菌活性物质破坏了深绿木霉、灰绿青霉2种霉菌细胞的完整性,无菌发酵料浸提液浓度越大,抑制效果越明显,说明抑制活性与其产生的抑菌活性物质的量呈正相关,与刘芹等[15]研究的随长根菇多糖浓度增加对青霉的抑制作用增强一致。
细胞膜的完整性是维持菌体正常生长代谢的一个主要影响因素。核酸、蛋白质等大分子物质贯穿于整个细胞膜和细胞质中,是维持生命活动最重要的物质。本研究发现,发酵料浸提液破坏了深绿木霉、灰绿青霉2种霉菌细胞膜的完整性,导致AKP外流,从而影响菌丝体生长,与王艳玲等[16]研究的Pseudomonassp. YL11抑制扩展青霉结果一致。SDH在真核生物中是线粒体的一种标志酶,ATP是生物膜上与能量代谢相关的酶。发酵料浸提液处理后,深绿木霉、灰绿青霉2种霉菌的SDH活性、ATP活性降低,与Pseudomonassp.YL11处理中SDH、ATP活性降低、抑制扩展青霉结果总体趋势一致。但是深绿木霉、灰绿青霉菌丝SDH、ATP活性变化与扩展青霉在对照组培养液内酶活性变化趋势有差异,推测与不同的霉菌种属有关。发酵料浸提液通过影响能量代谢及生物合成从而抑制了菌体的生长,与黄现青等[17]报道的枯草芽孢杆菌fmbJ代谢产物会降低点青霉SDH活性结果一致。
LOFFREDO等[18]发现,橄榄油厂废水污泥与木屑堆肥中含有的腐植酸和富里酸能抑制核盘菌(Sclerotiniasclerotiorum)菌丝的生长,是否抑制霉菌需要进一步验证,以水稻稻秆和油棕果实废弃物为原料的堆肥高温灭菌液含有大分子质量、热稳定且非蛋白质类的化学物质或微生物次级代谢产物,对草莓黄萎病菌具有显著的抑制作用。推断玉米芯发酵后浸提液中存在一些大分子、热稳定且非蛋白质类的化学物质或微生物次级代谢产物,腐植酸和富里酸是否抑制青霉、木霉的生长、是否含有长根菇多糖成分需要进一步分析检测。本研究将会继续筛选分析发酵料浸提液有效抑菌物质成分,开发相应的抑菌制剂,探索发酵抑菌最佳条件,制定平菇培养料发酵料技术规程,提高发酵效率,从而提高产量。

