血清中钾离子测定能力验证研究
于婷,马丽颖,张娟丽,曲守方,孙楠,孙晶,李丽莉,项新华
1 中国食品药品检定研究院,北京市,100050
2 河南省医疗器械检验所,郑州市,450003
0 引言
钾是人体内维持细胞生理活动的主要阳离子,起到调节体液渗透压及酸碱平衡,参与细胞的新陈代谢,保持神经、肌肉的应激性以及对心肌细胞的抑制性等作用。血清中钾离子的测定在临床诊断上具有重要的意义,是临床常规及急诊检验项目之一[1-3]。钾离子的检测方法主要有离子选择电极法[4]以及紫外可见分光光度法等,后者包括大环发色团法和酶法[5]。目前已有60多个钾离子检测试剂盒获得了国家药品监督管理局的批准,广泛应用于临床。
由于血清中钾离子的测定有参考测量程序,所以尽管各试剂盒检测钾离子的方法原理及检测仪器的不尽相同,同一样本的检测结果存在一定差异,但这种差异应在允许范围内,也即各个系统对同一份标本的检测结果应具有可比性。在这种情况下,医疗器械检验检测机构、临床检验机构或相关实验室在进行样本中钾离子的测定时,如何确保检测结果的准确性,有两方面的能力需要确认,一方面是实验室自身的检测能力,另一方面是识别不同厂家钾离子检测试剂盒水平的能力。
基于此,中国食品药品检定研究院首次在全国范围内组织实施了血清中钾离子测定能力验证(NIFDC-PT-174)。本次能力验证发放5份样本,其中3份样本作为真正的能力验证样本,随机定义其编号为2、3和5。另外2份为干扰样本(编号为1和4),均从临床收集外观清澈、透明,无明显黄疸、溶血、脂血的血清,混合后分装得到。5份样本中,真正能力验证样本采用参考方法定值,并经过均匀性和稳定性分析;干扰样本,不进行定值、均匀性和稳定性分析。
1 方法
1.1 样本的制备
收集外观清澈、透明,无明显黄疸、溶血、脂血的血清,且梅毒螺旋体抗体、人类免疫缺陷病毒抗体、乙型肝炎病毒表面抗原和丙型肝炎病毒抗体均为阴性。将符合要求的血清样本按照浓度合并成3个不同水平的大样,分别混匀后,进行多重滤膜过滤。将过滤好的血清样本按照0.5 mL分装,再进行熔封,于-70oC保存,最终制备完成3份真正能力验证样本。
1.2 均匀性、稳定性检验和定值
1.2.1 均匀性分析
按照CNAS-GL03《能力验证样品均匀性和稳定性评价指南》[6]进行。在分装的前中后各抽取了10支,进行均匀性评价。采用精密度良好的日立7180全自动生化分析仪对样本进行检测,各重复测定3次。采用单因素方差法进行分析,当F值小于临界值Fα(f1,f2),表明样本间无显著性差异,均匀。
1.2.2 稳定性分析
在第1、2、3、5、7、12、20、30 d 8个时间点上,从3份真正能力验证样本中各随机取出9支样本,分别置于20~25oC、2~8oC、-20oC条件各3支。采用日立7180全自动生化分析仪对样本进行检测,各重复测定3次。使用SPSS对检测结果作一元线性回归分析,并计算出斜率的标准差(sk)。在置信水平p=0.95,自由度为n-2的条件下,查t-分布界值表,得出对应的t(0.95,n-2)值,求出t(0.95,n-2).sk的值,比较|k|值与t(0.95,n-2).sk的值,如果|k|<t(0.95,n-2).sk,斜率不显著,表明样本稳定,反之则不稳定。
1.2.3 定值
选择3家实验室采用参考方法(离子色谱法或原子吸收法)进行联合定值。按照以下标准判定数据是否有效:①样本测定结果应在(均值±2 SD)范围内,且室内变异CV%不高于1.0%;②质控物质测定结果应在(靶值±1.0%)范围内,且室内变异CV%不高于1.0%。其中①中的均值和SD分别是指全部实验室所有结果的均值和标准偏差。不满足要求的数据为无效数据,直接剔除,取各实验室有效数据的均值,合并计算总均值,作为该样本的最终靶值。不确定度评估以GUM为基础,根据GB/T 15000.3-2008《标准样品工作原则(3)标准样品定值的一般原则和统计方法》[7]进行。不确定度来源主要来自定值、均匀性以及稳定性三部分。
1.3 检测方法
各实验室可选择钾离子测定参考方法或者钾离子检测试剂盒进行检测,按《作业指导书》的要求检测并提交5份样本的结果。
1.4 结果判定原则
①YY/T 1202-2013钾测定试剂盒(酶法)4.5项 准确度4.5.1:提供对参考物质或用参考方法定值的血清测定,实测值与标示值的偏差在±15.0%内;②测定值的精密度应不大于3.0%。各参加实验室的检测结果必须同时满足:第2、3、5号样本应满足上述2个判定原则且2份干扰样本满足第2个判定原则,方可判定本次能力验证结果满意,否则为不满意。
2 结果与分析
2.1 均匀性检验结果
根据单因素方差法,对3份真正能力验证的数据进行分析,结果详见表1。F值分别为1.630 1、1.498 6和1.020 8,均小于F0.05,说明样本均匀性良好。
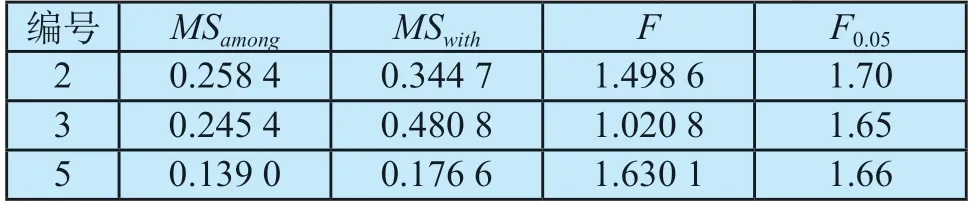
表1 真正能力验证样本均匀性结果Tab.1 Homogeneity results of real ability test samples
2.2 稳定性检验结果
由表2可知,3份真正能力验证样本在20~25oC、2~8oC、-20oC条件下,|k|值均小于t(0.95,n-2).sk值,表明样本在30 d内稳定性良好。
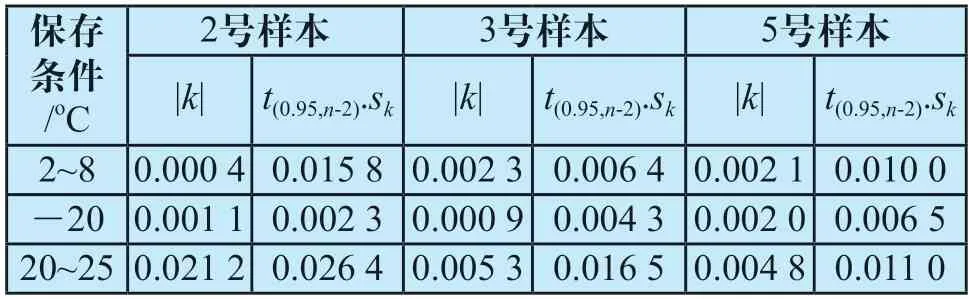
表2 真正能力验证样本稳定性结果Tab.2 Stability results of real ability verification samples
2.3 定值结果
3家实验室参与了联合定值,表3为定值结果。按照上述1.2.3中有效数据的判定原则,剔除无效数据后,合并计算全部有效数据,3份样本的测定结果精密度均不高于2.0%,表明定值结果理想。经联合定值,2号、3号、5号样本血清钾离子的指定值分别为5.739 mmol/L、6.158 mmol/L和5.042 mmol/L。
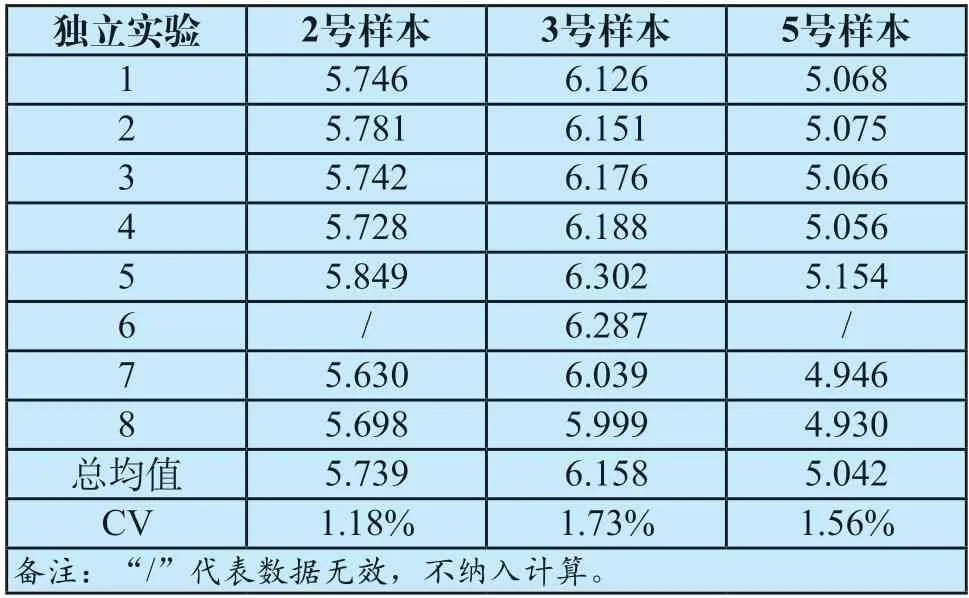
表3 定值结果汇总(mmol/L)Tab.3 Summary of measurement results (mmol/L)
2.4 参加实验室情况
共有11家实验室报名参加本能力验证,来自全国的9个省、自治区、直辖市,主要包括各省、自治区、直辖市的医疗器械检验所、食品药品检验机构及企业实验室。其中:省、直辖市食品药品检验检测机构4家(占参加实验室的36.4%);省、自治区医疗器械检验检测机构6家(占参加实验室的54.5%);企业实验室1家(占参加实验室的9.1%)。
2.5 能力验证结果
本次能力验证中,全部实验室均按要求提交了有效结果报告。根据判定原则,血清钾离子的实测值与标示值的偏差应在±15.0%内,因此2号、3号和5号样本测定结果应分别在4.878 mmol/L~6.600 mmol/L、5.234 mmol/L~7.082 mmol/L、4.286 mmol/L~5.798 mmol/L范围内,且5份样本的血清钾离子测定结果精密度均小于3.0%,才认为满意。对上报材料进行确认和分析后,结果汇总详见表4。
全部实验室均完成了检测,所有实验室的2、3和5号样本血清钾离子测定结果均在范围内,除代码为947的实验室测定的4号样本精密度为5.4%,不满足要求外,其余实验室测定的样本结果精密度均不高于3.0%,满足要求。因此,本次能力验证中,获得结果满意的实验室为10家,满意率为90.9%。
2.6 结果分析
总的来说,本次血清中钾离子测定能力验证的结果基本令人满意。全部样本测定结果与给定值的偏差均在±15.0%内,10家单位5份样本的检测结果精密度均小于3%,有的甚至为0。对出现的1家不满意结果分析,发现4号样本的5次检测结果中,前4次结果分别为6.10 mmol/L、6.20 mmol/L、6.00 mmol/L和6.10 mmol/L,而第5次结果为5.40 mmol/L,导致CV超过3%。
3 讨论
本次能力验证选择血清钾离子,主要基于以下几方面的考虑:第一,属于实验室常规项目,门槛较低,多数医疗器械检测机构、临床实验室或者相关企业实验室均可参加,涉及面较广;第二,样本基质为人血清,与生化类项目能力验证经常采用的商品化冻干粉末相比,其基质效应更小;第三,本次能力验证样本,不以所有参加者报告结果的中位值作为指定值,而是采用参考测量程序,通过多家实验室联合定值结果作为指定值,充分保证了定值的客观公正性,并可防止实验室间串通数据;第四,检测仪器属于常规实验室必备仪器,而不是特殊仪器,实际可操作性强;第五,不划定血清钾离子检测试剂盒的范围,将参加实验室选择合适试剂的能力一并纳入到了本次能力验证的考察范围。因此通过本次能力验证活动,可了解各检验实验室血清钾离子的检测能力,发现、分析并核查存在的问题,增加客户以及相关方对实验室的信任,并且可为血清钾离子检测试剂盒的评价、监管、执法等提供有力的技术支持。
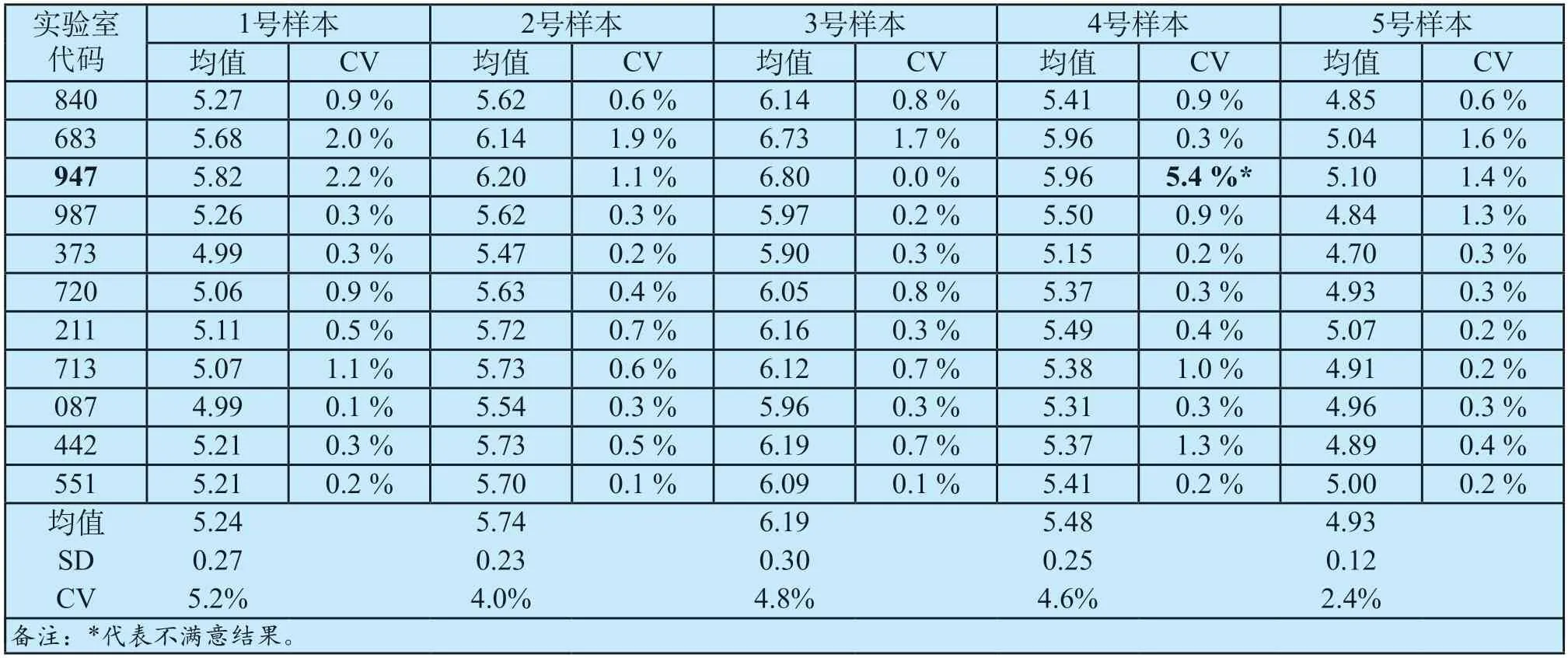
表4 血清钾离子测定能力验证结果汇总(mmol/L)Tab.4 Summary of results of serum potassium ion determination ability (mmol/L)
通过对结果的分析以及原始记录的查询,认为本次能力验证基本达到了评价参加单位这两方面能力的目的。仅1家出现了不满意结果,从提交材料中可以看到数据出现跳孔现象,试验人员并没有关注到这个问题,直接上报。表明该试验人员的敏感性不足,本应第一时间发现这个问题并及时查找原因,进行分析:是试剂检测条件不稳定,还是仪器携带污染等原因所致?是随机误差还是系统误差,同时应采用备用样本进行复测,从而避免不满意结果的出现。一方面,从结果方面来说,90.9%结果满意,仅1家出现精密度不满足要求,全部参加单位3份能力验证样本的检测结果均满意,表明参加单位血清钾离子检测能力总体较好,但是另一方面,通过原始记录并不能看到参加实验室对于试剂盒选择的分析过程,极大可能是实验室并没有这方面的意识,忽略了或跳过这方面的评价,随机选择并信任大品牌试剂盒,而非通过实验来确认所选试剂盒的准确性,存在一定风险。
医疗器械检验检测机构、临床检验机构或相关实验室在进行样本中钾离子的测定时,如何确保检测结果的准确性,需要确认两方面的能力,一方面是实验室自身的检测能力,包括人员、仪器、操作、对检测试剂的理解等,如实验前应确认检测用仪器性能:是否为试剂适用仪器,是否定期进行计量或者校准,是否校准和质控通过,并应确认试验过程中用到的纯化水、洗液、缓冲液等辅助试剂的性能是否满足要求;实验人员操作是否经过仪器操作培训、检测原理知识等培训,并具备相关的工作经历等,能力是否得到确认等;另一方面是确认不同厂家钾离子检测试剂盒水平的能力,如何选择适宜的检测试剂,是否确认了试剂溯源信息,使用前是否通过国际或国家标准品或有证参考物质进行准确度的验证,以确保准确性满足要求等。只有这两方面都做好了,才能达到真正提升检测能力的目的。综上所述,通过参加能力验证,各实验室可以识别与同行机构之间的差异,补充其内部质量控制技术,判断实验室是否具有从事校准、检测活动的能力以及监控这种能力的持续状况。

