菲律宾蛤仔稚贝对浮游微藻的滤食选择及对水体水色的影响
魏祎铭,周燚坚,王攀攀,程文志,李天骄,史天一,游 宇,毛 勇
(1.厦门大学 海洋与地球学院/近海海洋环境科学国家重点实验室,福建 厦门 361102;2.福建省水产技术推广总站, 福州 350002)
菲律宾蛤仔(Ruditapes philippinarum)是我国重要经济养殖贝类,肉质鲜美,生长速度快,分布范围广。2018 年我国海水养殖贝类产量高达14 440 kt,约占海水养殖总产量的71%,其中菲律宾蛤仔是海水养殖贝类的重要品种[1]。福建省是我国菲律宾蛤仔苗种主要的生产和供应基地,苗种年产量占全国的90%以上。近年来,鱼、虾、贝类、藻类等混养的立体生态养殖模式发展迅速,该模式中鱼虾养殖产生的营养盐能够被藻类吸收消耗和利用,促进藻类的自然增殖,同时,微藻作为贝类的优质饵料可被进一步利用,不仅节约了成本,增加了贝类产量和养殖效益,还有助于净化水体环境[2−4],具有良好的经济与生态效益。菲律宾蛤仔育苗过程中常常利用这些天然藻类培育稚贝,但是稚贝滤食器官发育不完善,对浮游微藻的滤食选择性较高[5−6]。研究者通过稳定同位素分析等方法,对野生菲律宾蛤仔的食物来源进行了分析,认为底栖微藻是菲律宾蛤仔的重要食物来源之一[7−8],同时也证明了菲律宾蛤仔具有较高的滤食选择性[9],但对于菲律宾蛤仔稚贝的滤食选择缺少进一步研究。研究菲律宾蛤仔稚贝对浮游微藻群落的滤食选择,对选择优质的天然微藻、提高稚贝成活率、促进稚贝生长具有重要意义,同时,稚贝的滤食具有较强的生物沉降作用,能够有效改善养殖水质。在实际生产条件下,笔者调查了菲律宾蛤仔稚贝对浮游微藻的滤食选择及其对水体水色的影响,并通过差减法研究其滤食偏好,以期找到可作为优良稚贝饵料的微藻种类,促进立体生态养殖模式的绿色发展。
1 材料与方法
1.1 实验设施与材料本实验于2019 年8 月在福建省东山县赤山茂鑫水产有限公司进行,利用1 个5 000 m2的鱼虾混养池塘培育室外微藻,利用室内育苗池(长4.55 m、宽3.55 m、高1.2 m)培育菲律宾蛤仔稚贝。每天6:00 和18:00 向稚贝培育池添加(1.13 ± 0.23)× 104L 天然微藻。菲律宾蛤仔稚贝的壳长为(398 ± 12)μm,养殖密度为1.8×103个·L−1,盐度19,光照正常,温度(29 ± 2)℃,水位1.1 m。
1.2 浮游微藻采集及定性定量分析本实验在早上6:00 加入(1.13 ± 0.23)× 104L 天然微藻,分别在0、3、6、10 h 进行取样,每个时间点设置3 组重复。具体方法:利用浮游植物采集网收集贝苗培育池的水样0.5 L,加入5 mL 鲁哥试剂固定,经分液漏斗静置沉淀48 h 后浓缩至50 mL 换入贮存瓶并编号。充分混匀后取0.1 mL 于浮游植物计数框在显微镜下观察并进行定性定量分析。浮游微藻生物量计算参照文献[10]及相关标准[11]。浮游植物优势度依据公式(1)计算。当Y≥ 0.02 时,该种即为优势种。数据统计在Excel 中进行。

式中:ni为第i种的总个体数;fi为该种在各样品中出现的频率;N为全部样品中的总个体数。
1.3 水质指标测定为比较稚贝滤食0 h 和10 h 的水质变化,在6:00 和16:00 采用五点采样法收集水样,并测定透明度、悬浮物及叶绿素a 含量,每组设置3 个重复,连续测定7 d。水体透明度利用Secchi 盘测定;悬浮物含量通过取0.5 L 水样,经GF/C 微孔滤膜滤出悬浮物,烘干后称量;叶绿素a 含量采用丙酮提取分光光度法测定,取0.5 L 水样,经0.45 μm 孔径滤膜滤出藻类后进行。
2 结果与分析
2.1 浮游微藻种类组成及优势种从鱼虾混养池塘共鉴定到50 种浮游微藻(表1),隶属5 门33 属,其中硅藻门(Bacillariophyta)占48%,包含15 属24 种;其次是绿藻门(Chlorophyta)占32%,包含10 属16 种;蓝藻门(Cyanophyta)占12%,包含4 属6 种;此外,裸藻门(Euglenophyta)占4%,共2 属2 种,金藻门(Chrysophyta)占4%,共2 属2 种。0 h 稚贝培育池中微藻优势种主要包括绿藻门小球藻属(Chlorella)的蛋白核小球藻(C.pyrenoidosa)、小球藻(C.vulgaris)、椭圆小球藻(C.ellipsoidea);韦斯藻属(Westella)不定种;蓝藻门平裂藻属(Merismopedia)细小平裂藻(M.minima)、微小平裂藻(M.tenuissima);色球藻属(Chroococcus)的微小色球藻(C.minutus)和硅藻门小环藻属(Cyclotella)的梅尼小环藻(C.meneghiniana)(表2)。

表1 稚贝培育池中浮游植物种类Tab.1 Phytoplankton species in the shellfish pond
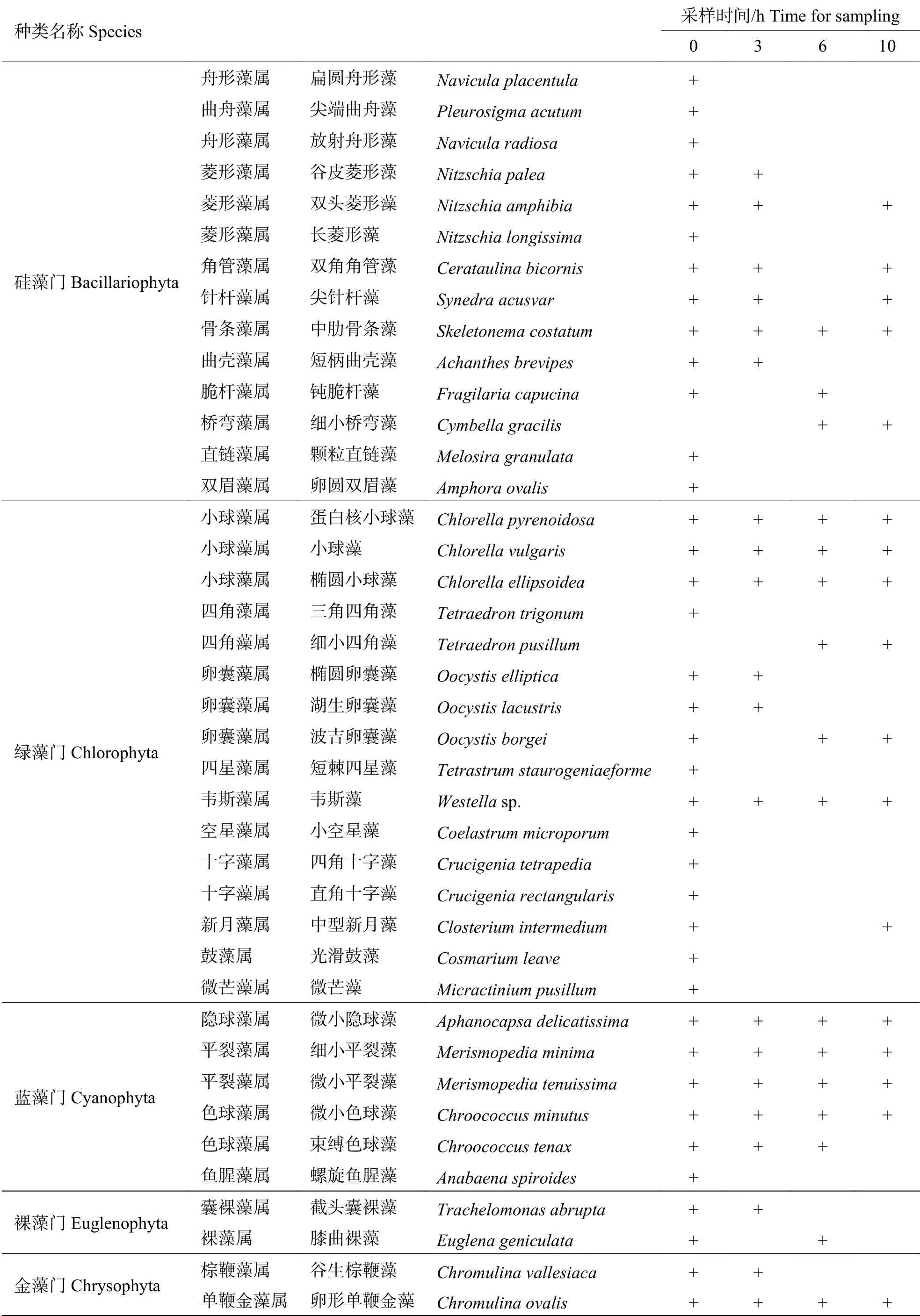
续表1 Tab. 1 continued

表2 0 h 稚贝培育池浮游植物优势种及优势度Tab.2 Dominant species and dominance of phytoplankton in the shellfish pond at 0 h
2.2 浮游微藻群落的丰度及生物量的变化稚贝培育池中的浮游微藻的丰度具有明显的时间依赖性(图1A)。投喂初始各门类浮游微藻总平均丰度为16.08×107个·L−1,投喂后3 h,平均丰度快速降至4.72×107个·L−1,减少了70.67%;投喂后6 h,平均丰度降至2.65×107个·L−1;投喂后10 h,平均丰度又下降34.59%,降至1.73×107个·L−1。根据图1A 和图1C 可知,各门类微藻平均丰度均有明显降低,其中绿藻门平均丰度降低最多,至投喂后10 h 降低至6.98×107个·L−1,幅度达89.72%,且其在藻类总生物丰度中的占比由48.70%降低至44.75%;其次是硅藻门平均丰度降至3.48×107个·L−1,幅度为88.56%,占比由24.18%变化至24.76%;蓝藻门平均丰度降至3.17×107个·L−1,幅度为87.96%,其占比由22.29%升高至26.33%。
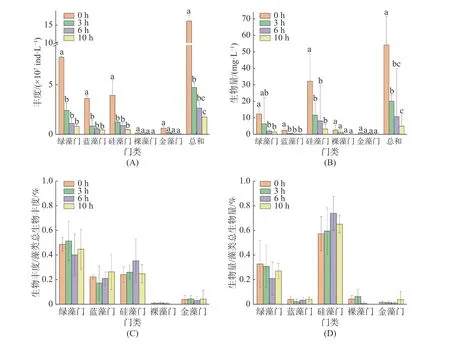
图1 稚贝养殖池中浮游微藻丰度、生物量的变化(A)丰度;(B)生物量;(C)丰度占比;(D)生物量占比变化;A、B 的总和分别为各门类浮游微藻生物丰度、生物量相加之和。Fig.1 Changes of phytoplankton in the shellfish pond(A) Cell density; (B) Biomass; (C) Proportion of cell density; (D) Proportion of biomass; The total means the sum of the abundance or biomass of phytoplankton of each class in Fig.1-A and Fig.1-B.
稚贝培育池中硅藻门和绿藻门的生物量始终占据较大比例(图1B、图1D)。投喂后0 h 养殖池中各门类浮游微藻总平均生物量达到65.650 mg·L−1,投喂后3 h 平均生物量迅速降20.016 mg·L−1,投喂后6、10 h 平均生物量分别降低至10.742、4.888 mg·L−1。其中硅藻门平均生物量下降幅度最大,由初始时的36.623 mg·L−1,到投喂后10 h 后降至3.209 mg·L−1,共减少了33.415 mg·L−1,占微藻平均生物量总减少量的54.99%,但在藻类总生物量中的占比由57.28%升高至65.01%;其次为绿藻门,10 h 平均生物量共减少了21.648 mg·L−1,在藻类总生物量中的占比由32.77%降低至27.08%。蓝藻门、裸藻门、金藻门的平均生物量减少量较低。
2.3 浮游微藻生物量动态在投喂后0 ~10 h,稚贝培育池中绝大多数的浮游微藻单个物种的生物量均有所减少,个别种类生物量增加(表3),其中生物量变化较大的微藻种类主要包括硅藻门的梅尼小环藻(Cyclotella meneghiniana);绿藻门的小球藻(Chlorella vulgaris)、湖生卵囊藻(Oocystis lacustris)、椭圆卵囊藻(Oocystis elliptica);蓝藻门的微小色球藻(Chroococcus minutus);裸藻门的截头囊裸藻(Trachelomonas abrupta)等。梅尼小环藻的生物量从初始的25.831 mg·L−1降至在投喂后10 h 后的1.545 mg·L−1,共减少了24.286 mg·L−1,占硅藻门总减少量的72.68%,其次为绿藻门的湖生卵囊藻及小球藻。
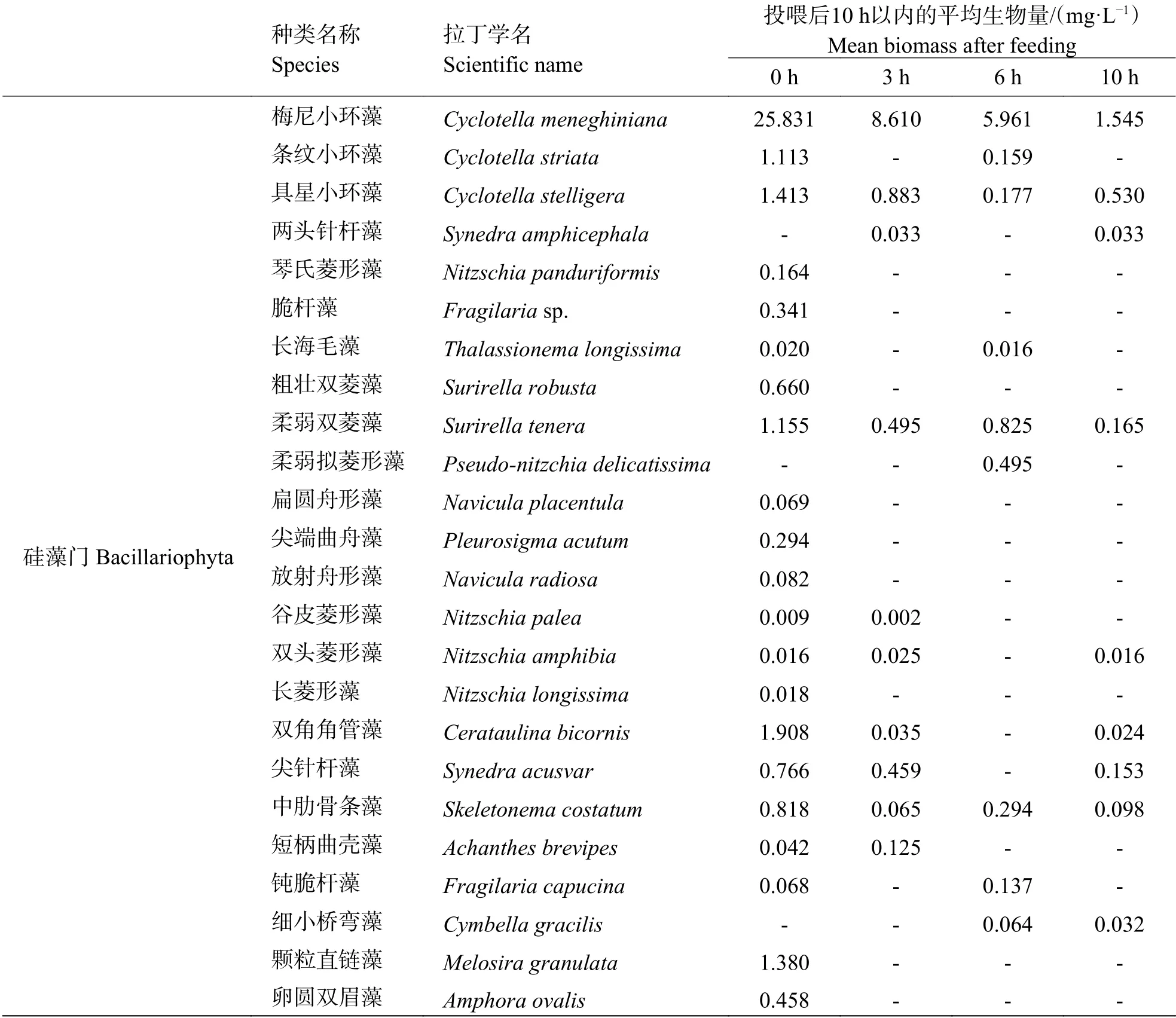
表3 调查期间稚贝培育池中浮游微藻平均生物量Tab.3 Mean biomass of phytoplankton in the shellfish pond during survey

续表3 Tab. 3 continued
2.4 水体水色特征变化对水体透明度、悬浮物以及叶绿素a 的调查结果表明,稚贝培育池的水色由初始的黄绿色变化至透明无色,水体透明度平均增加96.7%,悬浮物含量平均下降85.6%,叶绿素a 含量平均下降72.9%。
3 讨 论
贝类对于浮游微藻的摄食压力远远大于浮游动物[12],因此短时间内贝类摄食是影响浮游微藻群落的首要原因。本实验结果表明,菲律宾蛤仔稚贝对硅藻门的滤食偏好大于绿藻门、蓝藻门等其他藻类。硅藻门的平均生物量在10 h 内降低了33.415 mg·L−1,占微藻总减少量的54.99%。滤食性贝类的摄食率与饵料浓度、规格大小等密切相关[13−14]。王芳等[15]指出由于滤食器官的发育不完善,滤食性贝类在稚贝阶段表现出摄食率随藻类规格增大而上升,对蓝藻、绿藻等小规格藻类的滤取效率低。本研究的室外微藻培育池中硅藻生物丰度占藻类总丰度的24.18%,且细胞体积大于其他种类,因此,稚贝对于硅藻的滤食选择性较高。在自然条件下,底栖硅藻是菲律宾蛤仔的重要食物来源;在室内养殖条件下,投喂硅藻或硅藻混合其他藻类都能有效促进稚贝生长[16−17]。对菲律宾蛤仔稚贝食性研究的主要目的是开发出优质的、便于投产的稚贝饵料,包括大型藻类碎屑、单细胞绿藻以及人工饵料等[18−20]。本研究通过微藻分类鉴定发现梅尼小环藻作为混合藻水中的优势种,投喂后10 h 平均生物量下降了94.02%,占微藻总减少量的39.97%,该结果为寻找优质的贝类饵料提供了极为重要的思路。梅尼小环藻营养丰富,已被用作桡足类及其他幼体的生物饵料[21−22],能够提高幼体变态率等。江双林等[23]研究表明天然混合藻水投喂相较单一或几种人工藻种混合投喂,营养更均衡。因此,调查菲律宾蛤仔稚贝养殖过程中浮游微藻的群落变化,有助于进一步确定适宜稚贝生长的浮游微藻,促进稚贝生长发育,也将对筛寻富含菲律宾蛤仔优良适口饵料的鱼虾混养池塘、降低育苗饵料成本、实现规模化批量育苗具有重要的意义。利用快速繁殖的藻类充分消耗养殖尾水中的营养盐,不仅能够为稚贝提供种类丰富、生物量高的天然饵料,同时还能有效降低养殖尾水排放后的污染[24−26]。浮游微藻是影响养殖水体水色的重要因素之一[27−28],由于在微藻培育池以绿藻、硅藻、蓝藻为主,因此水色呈黄绿色或茶褐色[29]。经稚贝滤食后,微藻及有机碎屑等大量减少,对比滤食前叶绿素a 含量下降72.9%。同时由于贝类滤食带来明显的生物沉降作用,使得水体悬浮物含量也大幅降低,对比滤食前下降85.6%。经稚贝滤食后,水体颜色接近透明,水体透明度平均增加96.7%。表明菲律宾蛤仔稚贝的滤食效应可能改变水体水色。
本研究探究了菲律宾蛤仔稚贝对浮游微藻的滤食选择效应以及生物沉降作用,发现稚贝对梅尼小环藻具有较强的滤食偏好,有望作为一种稚贝优质饵料以提高贝苗生长速度。同时本研究发现菲律宾蛤仔稚贝滤食影响水质的水色、悬浮物和叶绿素a 含量,使得水质得到一定程度的改善。本研究结果对了解确定稚贝的合适生物饵料种类以及稚贝滤食对水质的改善效果具有积极的现实意义。

