气管切开法铜绿假单胞菌肺部感染动物模型的建立及评价*
李夏霖,黎俊康,韦丽霜,李金垄,王 可,闫 萍
(广西医科大学第一附属医院,南宁 530021)
铜绿假单胞菌(PA)属于一种广泛存在的机会致病菌,常引起各种急、慢性感染,其中以肺部感染多见,常见于慢性阻塞性肺病(COPD)、支气管扩张、囊性纤维化(CF)等结构性肺病的患者[1]。PA可以形成生物膜,进而保护细菌免受宿主免疫和抗菌药物的清除[2]。PA 肺部感染发病机制复杂、治疗棘手,为研究该病,许多PA肺部感染动物模型已经被建立[3]。本实验在国内、外学者经验的基础上,使用改良低熔点琼脂糖包裹PA,以气管切开方式注入大鼠肺部,建立大鼠PA肺部感染模型,并根据细菌学、病理学特点和炎症因子含量来对模型进行评价分析,从而为PA 肺部感染的研究提供理想的动物模型。
1 材料与方法
1.1 菌株 PA标准菌株PAO1,由丹麦哥本哈根大学医院临床微生物科惠赠。
1.2 实验动物 6~8 周龄健康清洁级雄性SD 大鼠36只,体重190~210 g,由广西医科大学实验动物中心提供,动物使用许可证号:SYXK桂2020-0004;动物生产许可证号:SCXK桂2020-0003。所有大鼠置于SPF 级无菌动物房内,分笼饲养,自由饮水、摄食。本研究动物实验已通过广西医科大学实验动物中心伦理审查委员会审批。
1.3 主要试剂与仪器 磷酸缓冲盐溶液(PBS)、LB营养琼脂、LB肉汤(北京索莱宝科技有限公司);1%琼脂糖(美国BIO BASIC公司);3%戊巴比妥钠、肿瘤坏死因子(TNF)-α、白细胞介素(IL)-17A 酶联免疫吸附试验(ELISA)试剂盒(武汉华美公司)。超低温冰箱(Thermo 995);生物安全柜(苏净安泰);生化培养箱(恒宇SPX-300-11);磁力搅拌器(德国IKA)。
1.4 实验分组与处理 将36只大鼠随机分为实验组和对照组,每组18只。实验组通过气管切口注入PA琼脂糖包裹体悬液,建立PA肺部感染模型,对照组注入等量无菌琼脂糖包裹体悬液。
1.5 琼脂糖包裹体的制备[4]将PAO1 菌株从-80 ℃超低温冰箱中复苏至LB营养琼脂平板,置于37 ℃培养箱中生长24 h,取单个菌落接种于10 mL的LB 营养肉汤,放入恒温(37 ℃)摇床中培养18 h。实验组的离心管中加入2 mL菌液(对照组为无菌等量LB 营养肉汤)及无菌1 mL、50 ℃的琼脂糖,迅速搅拌均匀后转移至无菌5 mL、50 ℃的石蜡油中,通过磁力搅拌器于室温下1 500 r/min搅拌6 min,置于碎冰上冷却10 min。将所制得琼脂糖包裹体转移至
1.5 mL 离心管,4 ℃下9 000 r/min 离心20 min,弃上清液,用PBS 冲洗3 次后振荡混匀于PBS。将琼脂糖包裹体悬液按梯度稀释,接种到LB 营养琼脂平板,于37 ℃培养箱中生长24 h,行菌落计数。将琼脂糖包裹体悬液稀释成1×108CFU/mL浓度后,置于4 ℃冰箱中保存待用。
1.6 肺部感染模型建立 3%戊巴比妥钠按30 mg/kg剂量麻醉大鼠,仰卧固定于手术台上,垫高头端,颈部备皮,用碘伏消毒3次,于颈前正中线上切一小口,逐层钝性分离组织暴露气管,用弯镊挑起气管,在软骨环之间开一小口,将12 G弯头灌胃针通过切口伸入,用1 mL注射器连接灌注0.15 mL PA琼脂糖包裹体悬液,然后注入少量空气确保灌胃针中残留的悬液完全进入肺中,缝合气管和皮肤切口后消毒。动物分笼饲养,每日观察大鼠的进食情况与活动精神状态。
1.7 标本采取与处理 分别于接种后的第1、第3、第5 天,每组随机选取6 只大鼠麻醉后无菌条件下行腹主动脉采血并处死,将血液标本常温静置2 h后,2 500 r/min,离心10 min,取上层血清,置于-80 ℃冰箱中保存备用。开胸观察肺脏大体病变并评分,无菌分离肺组织,放入无菌含2 mL PBS 的离心管或10%福尔马林中。
1.8 肺细菌学检查 取PBS离心管中的肺组织,于4 ℃下制成肺组织匀浆,梯度稀释后从中取0.1 mL用涂布棒均匀地涂在琼脂平板上,37 ℃下培养24 h,计算肺组织中的细菌菌落总数(CFU)。即CFU/mL=平板上菌落数×稀释倍数×20。
1.9 肺大体病理观察 打开大鼠胸腔后观察肺大体病理改变,根据肺大体病理改变以及炎症严重程度分为4 级[5]:(1)Ⅰ级:正常;(2)Ⅱ级:充血、肿胀、肺不张;(3)Ⅲ级:胸膜黏连、实变或肺不张;(4)Ⅳ级:脓肿、出血、大面积实变或肺不张。
1.10 肺组织病理观察 将所取肺组织常规包埋切片及苏木精-伊红(HE)染色,光学显微镜下观察。根据炎症严重程度,将肺组织病理改变分为4 级[6]:(1)Ⅰ级:正常肺;(2)Ⅱ级:轻度炎症;(3)Ⅲ级:中到重度炎症伴有正常肺组织;(4)Ⅳ级:重度炎症到坏死或整个肺为重度炎症。另外,根据镜下观察病灶内浸润的炎症细胞,多形核白细胞(PMN)≥90%、单核细胞(MN)≤10%为急性炎症,MN≥90%、PMN≤10%或伴淋巴细胞、红细胞和肉芽肿出现为慢性炎症。
1.11 肺组织和血清中TNF-α、IL-17A含量检测
将肺匀浆离心后取上清液,与血清标本采用ELISA法检测TNF-α和IL-17A水平,检测过程严格按照试剂盒说明书进行操作。
1.12 统计学方法 采用SPSS 17.0 统计软件进行数据处理,呈偏态分布的计量资料以中位数(四分位数间距)表示,等级资料比较采用秩和检验,正态分布的计量资料以均数±标准差()表示,组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 动物一般状况 实验组在接种PA琼脂糖包裹体后的第1 天,出现精神萎靡、食量减少、体重减轻以及眼、口、鼻分泌物增加等现象;第3 天实验组大鼠精神状态差,伴有明显喘鸣音;第5天实验组大鼠仍有喘鸣,毛发杂乱无光泽。对照组接种无菌琼脂糖包裹体后第1天,大鼠除体重下降外,无其他明显症状;第3、第5天大鼠体重恢复,状况良好。
2.2 肺组织细菌学结果 实验组接种后第1、第3、第5天均培养出较高浓度PA,分别为1.34×108CFU/mL(9.01×107~2.32×108)CFU/mL、2.90×107CFU/mL(4.50×106~7.15×107)CFU/mL、1.48×106CFU/mL(5.88×105~4.85×106)CFU/mL,对照组均未培养出PA。
2.3 肺组织大体病理改变 实验组肺多为Ⅳ级病变。实验组接种后第1 天可见肺大体严重充血、水肿、出血;第3 天肺局部实质变和结节形成等表现;第5天肺大面积实变,有脓肿形成,或伴肺外胸壁黏连等;对照组接种后第1 天肺有轻度充血,第3、第5天为肺正常组织外观,见图1、表1。
2.4 肺组织病理改变 实验组肺多为Ⅲ~Ⅳ级病变,接种后第1 天肺组织中大量PMN 浸润,呈急性炎症反应,并出现肺泡出血、肺血管扩张和气管腔及肺泡腔内大量脓性分泌物等,第3天可见PMN减少,MN 逐渐增多,肺泡壁较前增厚,气管腔和肺泡腔脓性分泌物减少;第5天可见大量MN浸润,以单核巨噬细胞为主,并伴有淋巴细胞增生,呈慢性炎症反应,并有纤维组织增生、肺泡间隔增粗等。对照组接种后第1天,肺局部可见少许炎症细胞浸润,第3、第5天恢复为正常肺组织,见图2、表2。
2.5 两组TNF-α、IL-17A含量比较 接种后第1、第3、第5天,实验组血清和肺组织中TNF-α、IL-17A含量均高于对照组(P<0.05),且第5天血清和肺组织TNF-α、IL-17A 含量均高于接种后第1 天(P<0.01),见图3。

图1 两组肺组织大体病理改变

表1 两组肺组织大体病理评级比较 n
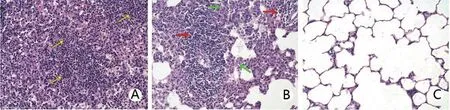
图2 两组肺组织病理改变(HE染色,×250)

表2 两组肺组织病理评级比较 n

图3 两组血清和肺组织TNF-α和IL-17A含量比较
3 讨论
PA 引起患者感染时,常处于生物膜状态[7]。为模拟PA 的生物膜状态,Cash 等[8]使用琼脂包裹PA,但琼脂熔点高,较易凝固,包裹PA的效果差,故本实验改良该方法,使用1%浓度的低熔点琼脂糖包裹PA感染大鼠,建立PA肺部感染动物模型。
按照Pearson 等[9]肺部感染模型标准,当肺组织匀浆培养均有PA 生长,含菌量>1×103CFU/mL,且肺组织病理可见肺组织水肿、实变、纤维渗出、大量炎症细胞浸润和肺泡出血等则可认为该肺部感染模型建立成功。本实验中的实验组大鼠各个时间点肺组织匀浆菌落计数结果均远高于1×103CFU/mL;在病理学检查结果方面本实验模型也符合上述模型标准。并且,肺部病理学结果显示大鼠在接种PA琼脂糖包裹体后的第1天,肺组织可见大量PMN浸润,呈急性炎症反应,第3、第5天,肺组织PMN逐渐减少,而单核巨噬细胞、淋巴细胞等慢性炎症细胞逐渐增多,并伴有肺泡间隔增厚和纤维组织增生等慢性炎症表现。大鼠的肺部感染呈现了从急性炎症表现逐渐转变为慢性炎症的过程。因此,本实验采用气管切开法建立的大鼠PA 肺部感染模型可用于PA急慢性感染的研究。
PA 引起的肺部感染与多种细胞因子有关[10]。TNF-a 主要由活化的单核-巨噬细胞分泌,对中性粒细胞和巨噬细胞等炎症细胞具有较强的趋化作用[11]。而IL-17A主要由Th17细胞分泌,通过诱导细胞因子、趋化因子和抗菌肽的表达来清除微生物感染。Bayes 等[12]研究表明,IL-17A 在PA 感染中能诱导TNF-α的产生并与之有协同作用,增强宿主的抗菌免疫应答,但这种促炎作用的长期维持会导致慢性炎症。本研究中,实验组大鼠接种PA琼脂糖包裹体后第1、第3、第5 天,大鼠肺、血清TNF-α、IL-17A含量逐渐上升,由此推测,PA 促进中性粒细胞和单核—巨噬细胞的募集和激活,分泌大量TNF-a、IL-17A,从而导致肺组织的急、慢性炎症。这与本实验病理观察结果(接种后第1 天肺组织大量PMN 浸润,第3、第5 天肺组织PMN 逐渐减少,单核巨噬细胞、淋巴细胞逐渐增多)相一致。
目前,PA肺部感染动物模型没有统一标准。动物接种PA常用的方式有经皮气管穿刺、喷雾[13-14]、滴鼻[15-16]和插管[17-18]等。经皮气管穿刺对实验人员技术及设备要求较高,操作复杂;喷雾、滴鼻则不能准确掌握动物感染菌量,且易造成实验人员污染,成功率和安全性低;经口插管易误插食管,无法准确判断PA是否接种至肺部。本实验建立的PA肺部感染动物模型具有以下特点:第一,使用可塑性更好、包裹效果更均匀的低熔点琼脂糖包裹PA,不但有效地避免宿主的免疫反应清除,还能够形成持续的感染,更类似于临床PA肺部感染状况;第二,接种部位固定于左肺下叶深部,大鼠不易发生接种物倒流而窒息死亡,PA 琼脂糖包裹体也不易被清除,从而保证接种量的稳定,因此更易造成肺部感染,形成肺的局部感染病灶,有利于实验结果观察。
综上所述,本实验使用低熔点琼脂糖包裹PA,通过气管切开法将PA 琼脂糖包裹体注入到大鼠肺部,可成功建立操作安全、死亡率低、重复性好的大鼠PA肺部感染模型。这对深入研究PA肺部感染的发病机制、宿主免疫反应、PA耐药机制和寻找、研发新药具有重要意义。

