香蜂草苷对脂多糖联合D-氨基半乳糖诱导C57BL/6J小鼠急性肝损伤的保护作用及机制研究*
庞丽君 ,冯钟文,陈思韵,黄瑀莘,龙 妍,黄权芳,林 兴,韦锦斌△
(1.广西医科大学,南宁 530021;2.广西中医药大学第一附属医院,南宁 530023)
急性肝损伤在临床上十分常见,可诱发急性肝损伤的危险因素有多种,如病毒、疾病及用药不当等[1-2],具有预后不良及高死亡率等特性,严重危害人类生命健康。因此,迫切需要开发急性肝损伤的特效药。脂多糖(LPS)联合D-氨基半乳糖(D-Gal)腹腔注射是一种常用于研究药物治疗急性肝损伤潜在机制的经典研究模型。LPS 具有很强的毒性,可以激活免疫系统并最终导致败血症经常引起多器官衰竭,特别是肝损伤。此外,D-Gal作为LPS的增敏剂,可通过抑制多种RNA 的合成,增强肝脏内LPS的肝毒性[3]。
香蜂草苷是一种黄酮类化合物,具有较强的抗炎和抗氧化的作用[4]。本课题组前期研究发现,香蜂草苷对四氯化碳(CCl4)所致的急性肝损伤具有良好的保护作用[5]。然而,目前关于香蜂草苷对LPS和D-Gal 引起的急性肝损伤的影响尚无相关报道。因此,本实验通过LPS/D-Gal诱导小鼠急性肝损伤,研究香蜂草苷对小鼠急性肝损伤的保护作用及其作用机制,为急性肝损伤和其他急性炎症性疾病的治疗提供新的靶标和潜在的候选药物。
1 材料与方法
1.1 实验动物 8 周龄SPF 级雄性C57BL/6J 小鼠90只,体重(20±2)g,购于湖南天勤生物技术有限公司(动物使用许可证号:SYXK 湘2014-0011),控制温度(25±2)℃,相对湿度60%~70%,光照强度300 Lx,每日光照时间12 h。本研究中涉及小鼠的所有实验均符合广西医科大学动物伦理委员会批准。
1.2 试剂与主要仪器 香蜂草苷,纯度≥98%,批号:P13S9L70276,购于上海源叶生物科技有限公司;联苯双酯滴丸,批号:170610,购于北京协和药厂;LPS(批号:813Q038,Solarbio);D-Gal(批号:KT052019,BOMEI);NF-κB p65、IKKα/β和p-IKKα/β 兔源单克隆抗体(美国CST 公司);白细胞介素1β(IL-1β)、白细胞介素6(IL-6)和肿瘤坏死因子-α(TNF-α)试剂盒(武汉伊莱瑞特生物科技股份有限公司);超氧化物歧化酶(SOD)和丙二醛(MDA)试剂盒(南京建成生物研究所);组织裂解液(碧云天生物技术有限公司)。7100型全自动血生化分析仪(日本Hitachi公司);Nanodrop3000微量核酸蛋白分析仪(美国Thermo Fisher 公司);CKX-41 倒置显微镜(日本Nikon 公司);Western blotting 电泳仪、转膜仪(美国Bio-Red公司);Odyssey双色红外荧光扫描成像系统(美国LICOR公司)。
1.3 动物分组及造模 将90 只C57BL/6 小鼠随机分为6组(n=15):正常对照组、香蜂草苷对照组(0.8 mg/kg 香蜂草苷)、模型组、阳性对照组(175 mg/kg联苯双酯)及香蜂草苷低、高剂量组(0.4 mg/kg、0.8 mg/kg 香蜂草苷)。正常对照组和模型组小鼠灌胃给予等体积生理盐水,其余各组灌胃给予相应药物,共14 d。预处理结束时,除正常对照组和香蜂草苷对照组外,其余各组小鼠均腹腔注射D-Gal(800 mg/kg)和LPS(50 μg/kg)建立急性肝损伤模型[6];4 h后,根据实验要求进行进一步的操作。
1.4 样本采集和处理 各组小鼠腹腔注射对应药物4 h 后,用乙醚麻醉并采用摘眼球取血法取新鲜血液于1.5 mL 离心管中,随后颈椎脱臼处死小鼠,迅速取出小鼠肝脏,血液静置30 min 后离心20 min。采用4 ℃生理盐水清洗肝脏表面后,用滤纸吸干表面液体并将其切成若干块,分装置于-80 ℃冰箱冷藏保存。
1.5 病理组织学检查[7]用4%多聚甲醛固定肝组织,石蜡包埋,切片,厚度为5 μm,行苏木精-伊红(HE)染色,显微镜下观察肝脏病理改变。
1.6 生化指标测定 采用全自动生化分析仪检测各组小鼠血清丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)活性。
1.7 血清炎症因子水平测定 采用酶联免疫吸附试验(ELISA)法测定L-1β、IL-6 和TNF-α 含量。酶标仪检测450 nm 波长处各孔光密度(OD)值,并根据说明书计算小鼠血清IL-1β、IL-6和TNF-α含量。
1.8 氧化应激指标检测 称取适量小鼠肝脏,按重量∶体积=1∶9的比例加入相应体积的生理盐水,在冰浴条件下对其进行匀浆,随后组织匀浆于4 ℃下离心10 min,保留上清液。用BCA试剂盒对各组样本的蛋白浓度进行定量,严格按照试剂盒说明书检测小鼠肝脏SOD活性和MDA含量。
1.9 Western blotting 法检测肝组 织p-IKKα/β、IKKα/β 及NF-κBp65 蛋白表达 取适量肝脏组织,剪碎,放入玻璃匀浆器中,加入RIPA缓冲溶剂,在冰上研磨。静置10 min 后,4 ℃下离心20 min,取上清。BCA 试剂盒进行蛋白浓度测定。7.5%~12.5%SDS 聚丙烯酰胺凝胶电泳90 min,采用湿转法将分离的蛋白转移至聚偏二氟乙烯(PVDF)膜,1 h后将PVDF膜取出,用TBST溶液摇床洗涤3次,10 min/次;封闭15 min,TBST 洗涤3 次,10 min/次;将PVDF 膜与相应的一抗(均为1∶1 000)置于4 ℃冰箱孵育过夜,TBST洗涤3次,10 min/次;荧光二抗(1∶10 000)于室温条件(25 ℃)下避光摇床孵育1 h,TBST 洗涤3 次,10 min/次。Odyssey 双色红外成像系统进行扫膜,Image J2软件分析蛋白条带灰度值。
1.10 统计学方法 采用SPSS 21.0 统计软件分析数据,计量资料以均数±标准差()表示,多组间比较采用单因素方差分析,组间两两比较采用LSDt检验,以P<0.05为差异有统计学意义。
2 结果
2.1 香蜂草苷对急性肝损伤小鼠肝病理组织学变化的影响 HE 染色结果显示,正常对照组小鼠肝组织结构清晰可见,肝小叶以及肝细胞完整;模型组小鼠肝组织出现明显的病理改变,包括水肿或充血,肝细胞坏死,肝组织结构破坏,炎症细胞浸润,中央静脉不规则扩张;与模型组相比,香蜂草苷低、高剂量组肝组织病理形态学改变较模型组均有明显改善,且香蜂草苷高剂量组改善更明显,见图1。

图1 HE染色观察小鼠肝脏组织学变化(×400)
2.2 香蜂草苷对急性肝损伤小鼠血清ALT、AST活性的影响 与正常对照组相比,模型组血清AST和ALT 活性明显升高(P<0.05);与模型组比较,香蜂草苷低、高剂量组血清ALT、AST活性均降低,且香蜂草苷高剂量组低于香蜂草苷低剂量组(P<0.05),见表1。
2.3 香蜂草苷对急性肝损伤小鼠血清IL-1β、IL-6、TNF-α 水平的影响 与正常对照组比较,模型组血清IL-1β、IL-6及TNF-α水平显著升高(P<0.05);香蜂草苷低、高剂量组血清IL-1β、IL-6 及TNF-α 水平均低于模型组,且香蜂草苷高剂量组TNF-α含量低于香蜂草苷低剂量组(P<0.05),见表2。
表1 香蜂草苷预处理后小鼠血清ALT和AST活性变化 n=15,

表1 香蜂草苷预处理后小鼠血清ALT和AST活性变化 n=15,
与正常对照组比较,*P<0.05;与模型组比较,#P<0.05;与香蜂草苷高剂量组比较,△P<0.05。
表2 香蜂草苷对急性肝损伤小鼠血清炎症因子IL-1β、IL-6和TNF-α水平变化 n=15,
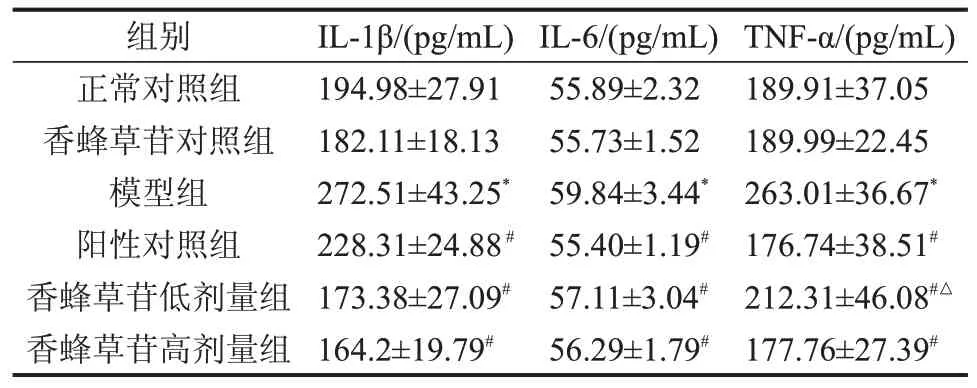
表2 香蜂草苷对急性肝损伤小鼠血清炎症因子IL-1β、IL-6和TNF-α水平变化 n=15,
与正常对照组比较,*P<0.05;与模型组比较,#P<0.05;与香蜂草苷高剂量比较,△P<0.05。
2.4 香蜂草苷对急性肝损伤小鼠血清中SOD 活性和MDA 含量变化的影响 与正常对照组比较,模型组血清SOD 活性显著降低,而MDA 含量显著升高(P<0.05);与模型组比较,香蜂草苷低、高剂量组血清MDA含量显著降低,SOD活性显著升高,且香蜂草苷高剂量组改善更明显(P<0.05),见表3。
表3 香蜂草苷对急性肝损伤小鼠肝脏SOD活性和MDA含量的影响 n=15,
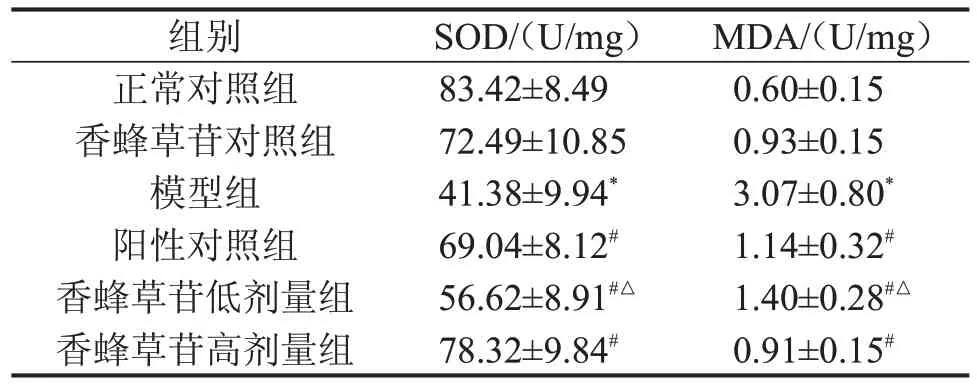
表3 香蜂草苷对急性肝损伤小鼠肝脏SOD活性和MDA含量的影响 n=15,
与正常对照组比较,*P<0.05;与模型组比较,#P<0.05;与香蜂草苷高剂量组比较,△P<0.05。
2.5 香蜂草苷对急性肝损伤小鼠肝组织p-IKKα/β及NF-κB p65 蛋白表达的影响 与正常对照组比较,模型组NF-κB p65、p-IKKα/β蛋白表达量明显升高(P<0.05);经香蜂草苷预处理后,香蜂草苷低、高剂量组NF-κB p65、p-IKKα/β蛋白表达均显著下调,且香蜂草苷高剂量组NF-κB p65蛋白表达量低于香蜂草苷低剂量组(P<0.05),见图2、表4。

图2 香蜂草苷对小鼠肝脏中P-IKKα/β、IKKα/β及NF-κB蛋白表达的影响
表4 香蜂草苷对小鼠肝脏p-IKKα/β 及NF-κB p65 蛋白表达的影响 n=15,

表4 香蜂草苷对小鼠肝脏p-IKKα/β 及NF-κB p65 蛋白表达的影响 n=15,
与正常对照组比较,*P<0.05;与模型组比较,#P<0.05;与香蜂草苷高剂量组比较,△P<0.05。
3 讨论
LPS 作为一种强大的炎症因子,可激活免疫细胞,使其分泌促炎因子,导致炎症性肝损伤[8-9]。此外,D-Gal是一种特异性的LPS致敏剂,导致三磷酸尿苷(UTP)大量耗损,同时抑制RNA 的合成[10-11]。正常情况下,AST 和ALT 主要存在于肝细胞中,当肝脏受到一些有害因素的刺激时,许多肝细胞被破坏后,继而将AST 和ALT 释放到血液中,导致血清中AST和ALT水平显著升高[12]。因此,血清ALT和AST水平可作为肝细胞损伤的标志,用来评估肝损伤的严重程度。本研究发现,模型组ALT和AST活性显著升高(P<0.05),且HE 染色结果显示肝组织出现严重的病理改变:肝组织结构被破坏,炎症细胞浸润,肝细胞坏死,提示急性肝损伤模型复制成功;与模型组比较,香蜂草苷低、高剂量组ALT 和AST 活性显著降低,高剂量组效果最优(P<0.05);病理组织检查结果显示,经香蜂草苷预处理后,肝细胞结构损坏、充血、坏死等现象均得到明显改善,且高剂量组的治疗效果明显优于低剂量组。以上结果提示香蜂草苷对LPS/D-Gal诱导的急性肝损伤有一定的保护作用,且高剂量香蜂草苷效果更好。
研究表明,急性肝损伤的发病机制复杂多变,但氧化应激始终扮演着十分重要的角色。在LPS/D-Gal 诱导的急性肝损伤中,机体氧化系统和抗氧化系统的失衡导致肝细胞氧化损伤[13]。SOD 作为一种抗氧化酶,促进氧化-抗氧化剂的平衡。SOD可催化超氧化物歧化产生过氧化氢,防止氧中毒。另一方面,MDA 在肝脏脂质过氧化起到十分重要的作用。这两种物质在体内的异常变化可能会使氧化应激加剧,从而导致细胞受损甚至死亡[14]。本研究中,模型组小鼠SOD活性显著降低,MDA含量显著升高(P<0.05)。而香蜂草苷预处理可提高SOD 的活性,同时降低MDA 含量(P<0.05)。这些结果表明,香蜂草苷可增加肝细胞的抗氧化能力,减少氧化损伤,最终保护LPS/D-Gal诱导的肝损伤。
研究表明,炎症反应是导致LPS/Gal 引起肝损伤的主要因素。而IL-1β、IL-6和TNF-α在与炎症反应中扮演着重要的角色。决定了急性肝损伤的发生及病程的发展[15]。实验结果表明,模型组小鼠血清中IL-1β、IL-6 和TNF-α 的水平显著升高(P<0.05),经香蜂草苷预处理后,IL-1β、IL-6和TNF-α的异常升高现象得到明显改善(P<0.05),且高剂量组改善程度较低剂量组更优。以上结果提示香蜂草苷可能通过抑制小鼠肝脏炎症反应,从而起到治疗LPS/D-Gal所引起的急性肝损伤的作用。NF-κB是一种重要的核转录因子,活化后的NF-κB可促进多种炎症介质的转录及分泌,继而参与生理和病理过程的调节[16]。本研究表明,模型组NF-κB p65、p-IKKα/β 蛋白表达水平显著升高(P<0.05),经香蜂草苷预处理后,NF-κB p65、p-IKKα/β表达水平明显降低(P<0.05),且香蜂草苷高剂量效果更优。提示香蜂草苷减轻炎症因子的过度释放,可能与抑制NF-κB信号通路有关。
综上,香蜂草苷能减轻LPS/D-Gal 诱导的急性肝损伤,其机制可能与抑制炎症反应、氧化应激以及NF-κB信号通路的激活有关,本研究为香蜂草苷作为一种治疗急性肝损伤的新药提供了实验依据。

