基于高通量测序研究龟鳖养殖水体细菌多样性
高娜 梁阳阳 李静
摘要 为研究龟鳖养殖水体中微生物资源特征并获取其菌种资源,采用Illumina-MiSeq高通量测序技术对外塘和温室养殖水体及生化流程处理后的尾水进行细菌多样性分析。结果显示,3组样品在门水平上优势菌为变形菌门和拟杆菌门,平均占比分别为55.89% 和14.37%。在属水平上,细菌主要为不动杆菌属,尚未分类的小梨形菌科和红杆菌科。3组水样中均有大量序列不能被歸入已知的属,推测其中可能有尚未发现的潜在新种。温室和外塘2种不同养殖模式下,水体理化因子及细菌群落结构组成均存在很大差异。传统微生物分离方法筛选了52株细菌,归属于14种不同的细菌属,其中大部分可作为水产益生菌使用。该研究结果为龟鳖养殖水体的微生态人工调控提供了理论依据。
关键词 龟鳖养殖;高通量测序;细菌多样性;传统微生物分离
Abstract In order to understand the characteristics of microbial resources in the breeding waterbody of turtle and obtain their bacterial resources, Illumina-MiSeq high-throughput sequencing technology was used to analyze the bacterial diversity in the outer ponds and greenhouse culture waterbody, the tail water after biochemical process treatment. The results showed that the dominant bacteria in three groups of samples were Proteobacteria and Bacteroidetes at phylum level with the average proportion of 55.89% and 14.37% respectively. At the genus level, the main bacteria were Acinetobacter, norank-f_-Pirellulaceae and unclassified-f-Rhodobacteraceae. There were a large number of sequences in the three groups of samples that could not be classified into known genera, so it was speculated that there might be potential new species those had not been found. Under the two different breeding modes of greenhouse and outer ponds, the physical and chemical factors of water body and the composition of bacterial community structure were very different. 52 strains of bacteria were screened out by traditional microbial isolation methods, belonging to 14 different bacterial genera, most of which could be used as aquatic probiotics.The research results provided the theoretical basis for the artificial micro-ecological regulation of the turtles breeding waterbody.
Key words Turtle breeding;High-throughput sequencing;Bacteria diversity;Traditional microbial isolation
我国是世界上龟鳖养殖规模最大的国家,由于消费者对龟鳖外观及品质要求的提高,目前龟鳖的养殖模式以“温室+外塘”的二段法为主[1]。温室养殖期间,由于养殖密度高、饲料利用率低,残余饲料和龟鳖粪便在高温环境下容易分解,因此导致温室龟鳖养殖废水含有高浓度的氮磷等污染物[2]。龟鳖养殖对水质要求较高,为保证养殖环境和鳖体健康成长,养殖场大多采用频繁换水的方法来改善其养殖环境。高浓度氮磷废水的无序排放,不仅带来严重的环境污染,而且造成了水资源的严重浪费[3]。宋颖[4]调查了典型水产养殖模式的污染源,结果发现温室龟鳖养殖行为本身产生的污染最大,对环境的污染最为严重。
水体中的细菌是养殖生态系统中重要的组成部分,其群落结构组成与水质状况有着密切的联系。它们在营养元素循环,有机物分解和污染物净化等方面也起着非常重要的作用[5-6]。近年来,随着分子生物学的发展,尤其是高通量测序技术的研发及应用,关于不同养殖模式水体中微生物多样性的研究也日益增多[7-9],但目前国内关于“温室+外塘”二段式龟鳖养殖水体中微生物多样性的研究报道较少。环境中的微生物群落结构极其复杂,多样性很高,传统的微生物分离方法对微生物生长有一定的选择性,不能很好地显示微生物的多样性,但可以获得可培养的土著微生物,为水质调控提供供试菌株[10]。针对龟鳖养殖过程中用水量大、水污染程度高等问题,笔者以安徽蓝田特种龟鳖有限公司的养殖温室,外塘以及处理后尾水沉淀池塘为研究对象,利用16S rDNA高通量测序技术和传统微生物分离鉴定方法探讨各水体中的微生物组成差异及多样性水平,旨在为构建龟鳖健康养殖系统提供理论依据以及为养殖废水治理提供良好的菌种资源。
1 材料与方法
1.1 样品采集与处理
采样地点位于安徽省芜湖市无为市陡沟镇安徽蓝田特种龟鳖有限公司,采样时间为2019年7月上旬。采集的样品均为各塘口的表层水样,WS1、WS2和WS3样品采集于温室,WT1、WT2和WT3样品采集于外塘,FS1、FS2和FS3样品采集于养殖及屠宰废水生化处理后的沉淀池。各样点采集的水样取200 mL经0.22 μm无菌混合纤维素酯膜(Millipore)抽滤,将富集了微生物菌体的滤膜送生工生物工程(上海)股份有限公司完成基因组提取、PCR扩增、文库构建、上机测序及数据常规分析等工作。
1.2 水质指标检测
化学需氧量(COD)、总氮(TN)、总磷(TP)以及氨氮(NH4+-N)浓度利用哈希多参数水质分析仪配合哈希预制试剂检测,硝态氮(NO3--N)浓度采用紫外分光光度法,亚硝态氮(NO2--N)浓度采用α-萘胺比色法。每个指标测定3个平行,结果取平均值。
1.3 梯度稀释法分离各样品中的微生物
1.3.1
菌液制备及培养方法。各塘口采集的重复水样混合均匀作为一个样品,3个塘口的样品分别命名为WT、WS、FS。梯度稀释各样品获得涂布液100、10-1、10-2、10-3、10-4、10-5,涂布至R2A(胰蛋白胨0.5 g/L、酵母提取液0.5 g/L、淀粉0.5 g/L、酶水解酪蛋白0.5 g/L、葡萄糖0.5 g/L、丙酮酸钠0.3 g/L、磷酸氢二钾0.3 g/L、硫酸镁0.024 g/L)固体培养基中,每个处理组设置3个平行,于28 ℃恒温培养箱中倒置培养,48 h后根据平板上菌落的形态随机挑取具有代表性的单菌落进行纯化筛选。
1.3.2
筛选细菌的鉴定。利用16S rDNA测序比对进行分子鉴定,16S rDNA通用引物27F为5′-AGAGTTTGATCCTGGCTCAG-3′,1492R为5′-ACGGCTACCTTGTTACGACTT-3′。PCR反应体系(20 μL)如下:模板单克隆,2×PCR Master Mix 10 μL,20 μmol/L引物各1 μL,灭菌ddH2O 8 μL。PCR程序如下:95 ℃预变性,3 min;95 ℃变性30 s;55 ℃退火30 s;72 ℃ 延伸90 s,30个循环;72 ℃延伸5 min;4 ℃下保存。
PCR产物利用1%琼脂糖电泳检测,将片段大小1 500 bp左右的PCR产物送生工生物工程(上海)股份有限公司测序,测序结果通过BLAST比对获得最相似菌株。
2 结果与分析
2.1 水体理化性质
样品的水体理化性质如表1所示,按照污水综合排放一级A标准(GB 8978—1996)及地表水环境质量标准(GB 3838—2002)中Ⅴ类水质要求,3组样品中的总氮、总磷以及化学需氧量的浓度均超过标准规定的浓度。亚硝态氮对养殖动物有毒害作用,是养殖池首要控制的指标,因此其浓度较低。氨氮是總氮的主要赋存形式,平均占55%,其余为硝态氮、亚硝态氮和有机氮。因此,在氨氮浓度较高的环境下硝态氮浓度处于较低水平。
2.2 样品测序质量及OTUs分析
3组样品得到的原始序列平均为64 889条,用于构建OTU分类信息单元且获得注释信息的平均序列数为61 084,有效数据量达到94.14%。在相似度大于97%的水平上检测到OTU数为1 619。如图1所示,当随机抽取的测序数量大于30 000条时,曲线趋向平坦,表明测序数据量合理,更深的数据量不会产生太多的OTU。对所有样品的有效Tags进行聚类,以97%的相似性将序列聚类成一个OTU。3组样品中细菌的平均OTUs数量分别为外塘1 385、温室1 312和处理后尾水2 159。维恩图可以比较直观的表现3组样品的OTU数目组成相似性及重叠情况,3组样品共有的OTU数目为286,不同样品中特有OTU表现为外塘312个,温室86个,处理后尾水362个(图2)。
2.3 样品多样性分析
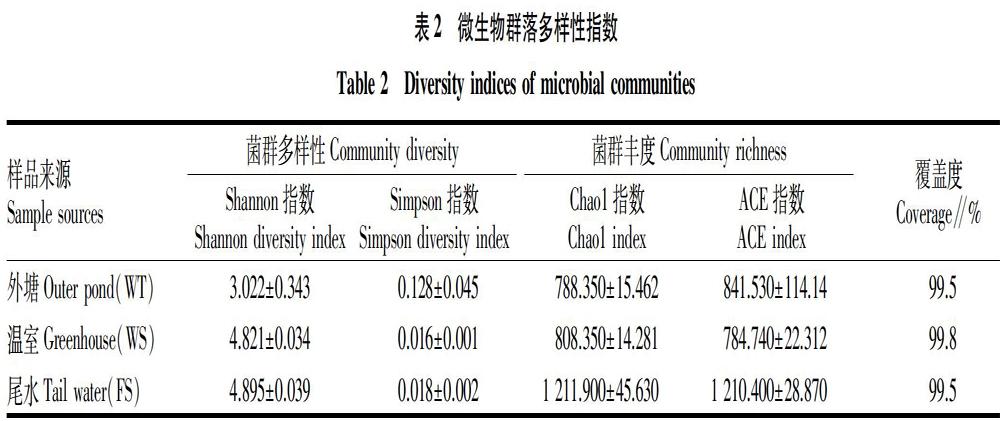
α多样性是指局域生境或样品内的微生物群落多样性,各个样品的ACE指数、Shannon指数、Chao1指数、Simpson指数和覆盖度(Coverage)取平均值,如表2所示。所有取样点的样品覆盖度均高于99%,表明测序结果覆盖度较好且具有很高的可信度,能够代表样本的真实情况。3组样品的群落多样性从大到小依次为处理后尾水、温室、外塘,Chao1指数和ACE指数都反映出处理后尾水中的群落丰富度最高,即细菌种类数量最多。
2.4 不同塘口细菌群落组成分析
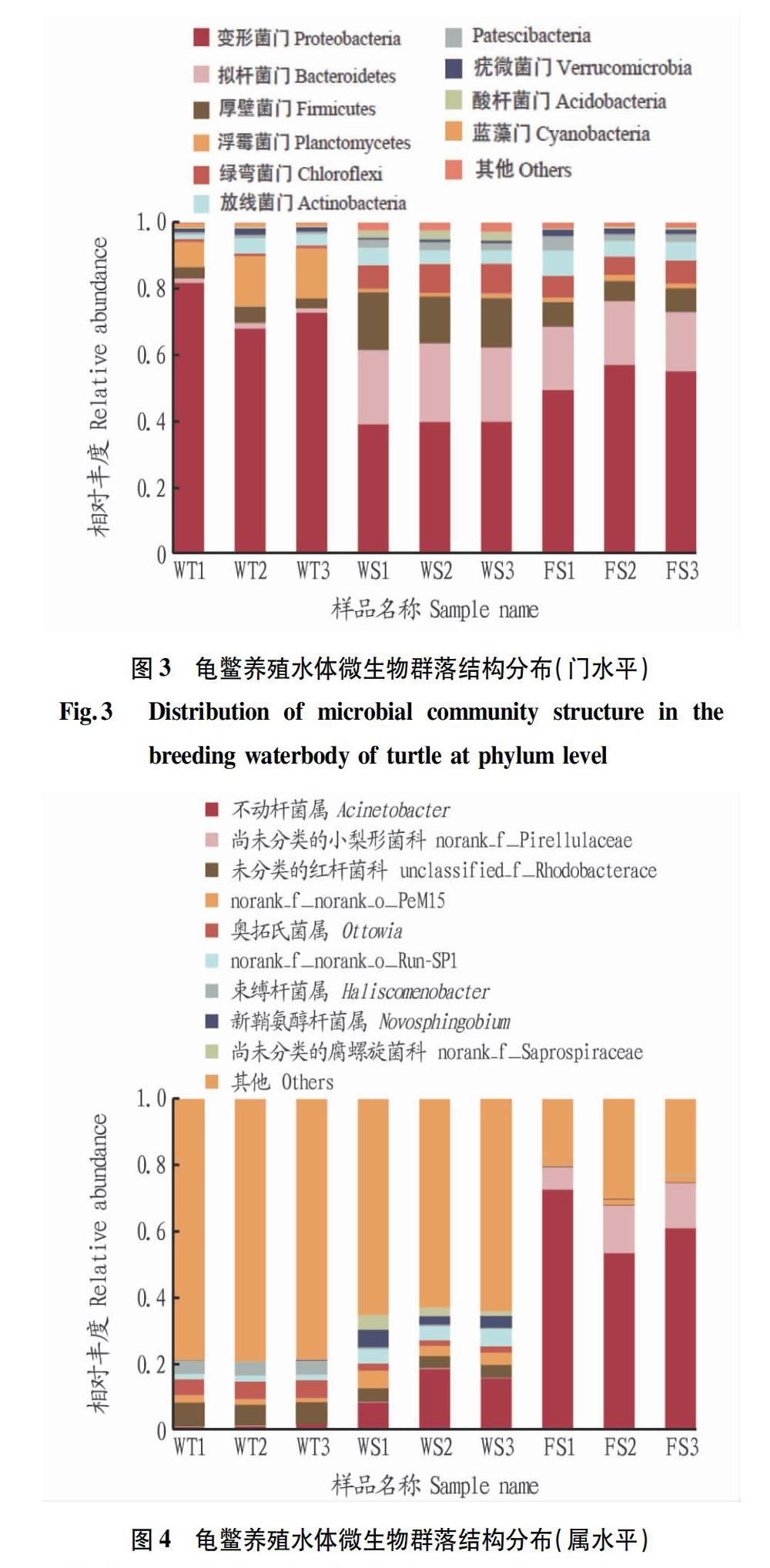
3组水样中共检测到细菌门36个,其中丰度较高的前10个门的种类分别为变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、浮霉菌门(Planctomycetes)、绿弯菌门(Chloroflexi)、放线菌门(Actinobacteria)、Patescibacteria菌门、疣微菌门(Verrucomicrobia)、酸杆菌门(Acidobacteria)、蓝藻门(Cyanobacteria),如图3所示。其中,优势类群为变形菌门和拟杆菌门,平均占比分别为55.89%和14.37%。变形菌门大部分属于异养型细菌,是COD降解和脱氮过程的主要贡献者,变形菌门包含的最主要的纲为β-变形菌纲,研究表明其与反硝化作用密切相关[11]。拟杆菌门的细菌与DNA、脂类和蛋白质等有机物质的转换密切相关,这些有机物质的吸收和利用是各种水体环境中碳循环的重要组成部分[12]。
以属为分类单元分析3组(9个)水样的细菌群落结果如图4所示,9个水样中细菌覆盖了598个属,大量的序列不能归入已知属(数据库分别以科的名称加-norank,-unclassified来表示),所有样本中丰度占比均小于0.04的物种归为其他(others)。相对丰度排名前10位的有不动杆菌属(Acinetobacter)、尚未分类的小梨形菌科(norank-f_-Pirellulaceae)、未分类的红杆菌科(unclassified-f-Rhodobacteraceae)、奥托氏菌属(Ottowia)、束缚杆菌属(Haliscomenobacter)、新鞘氨醇杆菌属(Novosphingobium)、尚未分类的腐螺旋菌科(norank-f-Saprospiraceae)等。3组样品的细菌结构组成存在明显的差异,不动杆菌属在外塘中占60%以上,为该塘口的绝对优势微生物。温室和处理后尾水中细菌多样性水平高,但每种细菌占比很低,红杆菌科未分类属在温室中占优势,所占比例为6.72%,处理后尾水中的优势微生物为不动杆菌属,所占比例为14.02%。3组水样中均有大量序列不能被归入已知的属,这些属在外塘、温室中占比分别为14.14%和20.05%,在处理后尾水中占21.79%,以小梨形菌科和红杆菌科的种类最多,推测这些序列可能是未被鉴定的新属。研究表明,细菌群落结构中一些不能鉴别或未能纯培养的细菌,可能在污染物去除过程中发挥重要作用[13]。
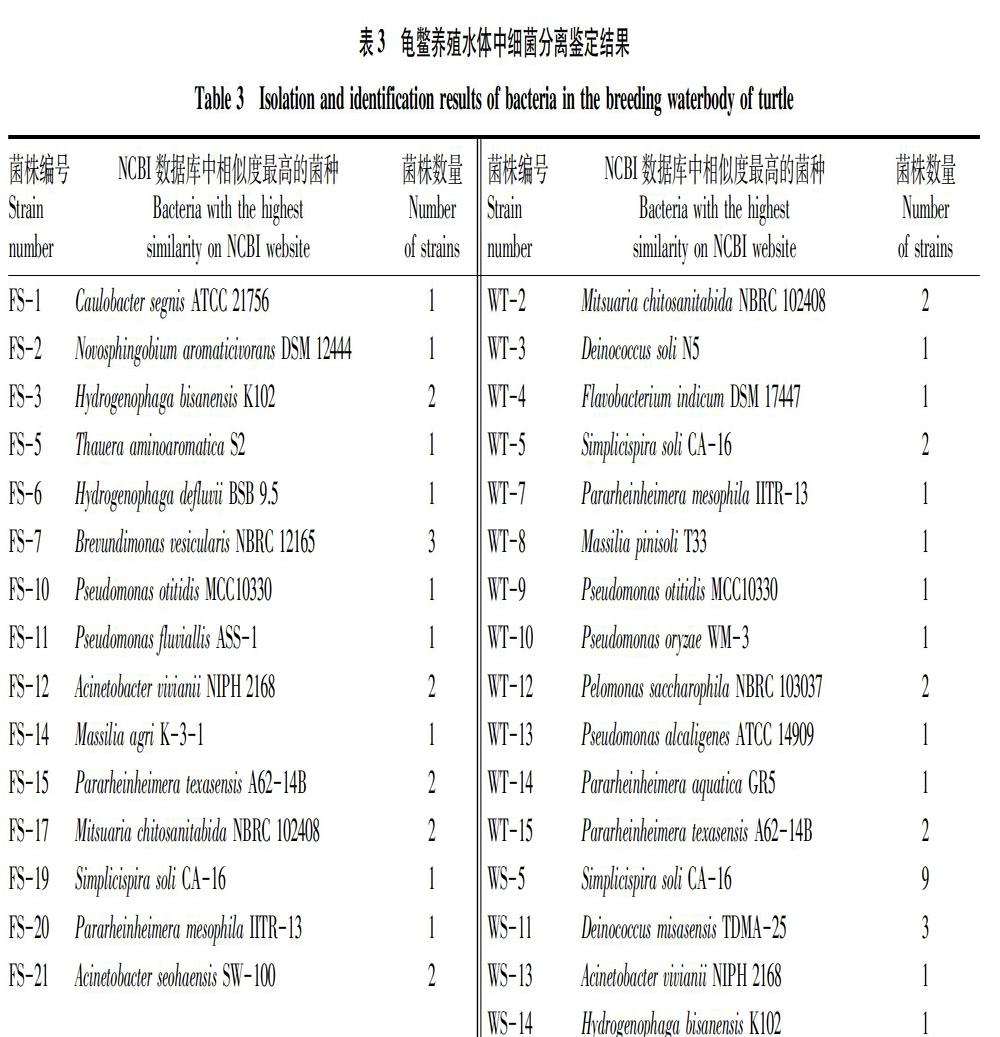
2.5 传统分离筛选方法鉴定龟鳖养殖水体微生物
利用传统微生物分离筛选方法从龟鳖养殖水体中共分离到细菌52株,对分离菌株进行测序比对,52株细菌包括柄杆菌属(Caulobacter)、新鞘氨醇杆菌属(Novosphingobium)、噬氢菌属(Hydrogenophaga)、陶厄氏菌属(Thauera)、短波单胞菌属(Brevundimonas)、假单胞菌属(Pseudomonas)、不动杆菌属(Acinetobacter)、马赛菌属(Massilia)、简易螺旋菌属(Simplicispira)、副莱茵海默氏菌属(Pararheinheimera)、松江菌属(Mitsuaria)、黄杆菌属(Flavobacterium)、异常球菌属(Deinococcus)、嗜糖假单胞菌属(Pelomonas)。其中,简易螺旋菌属分离到的最多,每个样品中均有发现,其属于丛毛单胞菌科,可以进行反硝化作用消除水体中的氮素[14]。传统微生物分离鉴定方法得到的细菌种属比16S rDNA高通量测序观察到的OTUs数量相对较少。不同样本中分离到的细菌种类存在差异性,其中处理后尾水的细菌种类最为丰富,这与高通量测序的结果相一致。温室水样中分离到的细菌种类数最少,可能是由于较高浓度的氮磷及有机污染物使部分细菌得到富集而限制了其他种类细菌的生长,或者是因为该塘口中大多数细菌不能进行纯培养。菌株分离情况见表3。
3 讨论
该研究采用高通量测序技术分析了龟鳖养殖水体中的细菌群落结构,在门和属的微生物分类水平,共筛选到36个细菌门598个细菌属,包含了大量相对丰度小于0.01的菌群。外塘养殖水体中的优势菌群为不动杆菌属,所占比例高达62%。据报道,不动杆菌属细菌在自然界中广泛存在,并且对亚硝酸盐有很好的降解作用,同时该属细菌也多为条件致病菌,大量存在会增加龟鳖染病的风险[15]。因此,龟鳖在外塘养殖期间需要密切关注水体中病原菌的变化情况,以降低龟鳖染病的风险。外塘水体中蓝藻门的检出水平也较温室养殖池塘高,其中蓝藻类是产生水华的主要原因,也是水体富营养化的征兆[16-17]。温室养殖水体中检测量不足1%的属占30.23%,细菌多样性和丰富度水平都高于外塘。但是,采用稀释涂布平板方法从温室养殖水体中只鉴定出4种不同属的细菌,推测可能是由于其中大多数细菌不能进行纯培养或者高浓度的营养盐使部分细菌得到富集而限制了一些细菌的生长。利用传统微生物分离培养方法从生化处理后尾水中分离到11种不同属的细菌,高通量测序结果也显示该水体中的细菌种类较温室和外塘养殖水体多。
综上所述,分析微生物菌群多样性和相对丰度的变化对于维持和调控养殖生态系统、预防和控制养殖水生动物疾病具有重要的意义。同时,根据16S rDNA测序结果,设计有针对性的筛选培养基,可以从养殖水体中筛选更多有益种类的土著微生物,为水质调控提供优良的供试菌株。
参考文献
[1]蒋路平,朱建龙,张涛,等.温室甲鱼养殖对水体污染的影响[J].现代农业科技,2016(22):173-174.
[2]QIN G,LIU C C K,RICHMAN N H,et al.Aquaculture wastewater treatment and reuse by wind-driven reverse osmosis membrane technology:A pilot study on Coconut Island,Hawaii[J].Aquacultural engineering,2004,32(3/4):365-378.
[3]羅金飞,蒋路平,朱建龙,等.嘉兴市规模化甲鱼两段式养殖场常规水质的调查[J].浙江农业科学,2015,56(8):1337-1341.
[4]宋颖.水产养殖污染源强及多介质土壤层技术废水处理效果与机理研究[D].杭州:浙江大学,2016.
[5]柴晓娟,骆大伟,吴春笃,等.水体中微生物分布及与环境因素的相关性研究[J].人民长江,2008,39(3):45-47,110.
[6]任丽娟,何聃,邢鹏,等.湖泊水体细菌多样性及其生态功能研究进展[J].生物多样性,2013,21(4):422-433.
[7]RAPIN A,PATTARONI C,MARSLAND B J,et al.Microbiota analysis using an Illumina MiSeq platform to sequence 16S rRNA genes[J].Current protocols in mouse biology,2017,7(2):100-129.
[8]CAPORASO J G,LAUBER C L,WALTERS W A,et al.Ultra-high-throughput microbial community analysis on the Illumina HiSeq and MiSeq platforms[J].The ISME Journal,2012,6(8):1621-1624.
[9]孙欣,高莹,杨云锋.环境微生物的宏基因组学研究新进展[J].生物多样性,2013,21(4):393-401.
[10]张鸽,梁开朝,辛玉华,等.基于高通量测序和传统分离研究雪茄外包皮表面细菌多样性及演替[J].应用与环境生物学报,2018,24(4):783-788.
[11]THOMSEN TR,KONG Y,NIELSEN P H.Ecophysiology of abundant denitrifying bacteria in activated sludge[J].FEMS Microbiology Ecology,2007,60(3):370-382.
[12]COTTRELL M T,KIRCHMAN D L.Natural assemblages of marine proteobacteria and members of the Cytophaga-Flavobacter cluster consuming low and high-molecular weight dissolved organic matter[J].Applied and environmental microbiology,2000,66(4):1692-1697.
[13]MA Q,QU Y Y,SHEN W L,et al.Bacterial community compositions of coking wastewater treatment plants in steel industry revealed by Illumina high-throughput sequencing[J].Bioresource technology,2015,179:436-443.
[14]SIDDIQI M Z,SOK W,CHOI G,et al.Simplicispira hankyongi sp.nov.,a novel denitrifying bacterium isolated from sludge[J].Antonie van leeuwenhoek,2020,113(3):331-338
[15]AL ATROUNI A,JOLY-GUILLOU M L,HAMZE M,et al.Reservoirs of non-baumannii Acinetobacter species[J].Frontiers in microbiology,2016,7:1-12.
[16]胡鸿钧.水华蓝藻生物学[M].北京:科学出版社,2011:3-4.
[17]余博识,吴忠兴,朱梦灵,等.水果湖湾蓝藻水华的形成及其对东湖影响的评价[J].水生生物学报,2008,32(2):286-289.

