茶皂素体外抗红色毛癣菌研究
程福建 吴仲 林玲
摘要 为了研究茶皂素是否能抑制红色毛癣菌真菌生长以及抑制程度,采用牛津杯法,通过抑菌圈大小判断茶皂素是否存在抑制红色毛癣菌作用,结果表明红色毛癣菌对茶皂素敏感程度为高度敏感,后通过立体显微镜进一步验证茶皂素能破坏菌丝结构,导致菌丝断裂、自溶,茶皂素存在抑制红色毛癣菌作用。然后采用体外抑菌方法研究茶皂素抑制红色毛癣菌机制,茶皂素最小抑菌浓度(MIC)为50 mg/mL。茶皂素溶液浓度与菌丝径向生长抑制率成正比,100、50和25 mg/mL茶皂素溶液浓度径向生长抑制率分别为96.10%、76.90%和57.60%。茶皂素溶液浓度与孢子萌发率成反比,茶皂素溶液浓度为25、50和100 mg/mL时,孢子萌发率分别为47.82%、31.43%、11.70%。
关键词 茶皂素;体外抑菌;红色毛癣菌
Abstract In order to study whether tea saponin can inhibit the growth of T. rubrum fungi and the degree of inhibition, the oxford cup was used to judge whether tea saponin can inhibit T. rubrum or not. The results showed that T. rubrum was highly sensitive to tea saponin, and then it was further verified by stereo microscope that tea saponin could destroy hypha structure, resulting in hypha breakage and autolysis. Then, the mechanism of tea saponin inhibiting T. rubrum was studied by in vitro antibacterial method, and the minimum inhibitory concentration(MIC)of tea saponin was 50 mg/mL. The concentration of tea saponin solution was directly proportional to the radial growth inhibition rate of mycelium. The radial growth inhibition rate of 100, 50 and 25 mg/mL tea saponin solution concentration was 96.10%, 76.90% and 57.60%, respectively.The concentration of tea saponin solution was inversely proportional to the spore germination rate. When the concentration of tea saponin solution was 25, 50, and 100 mg/mL, the spore germination rate was 47.82%, 31.43%, and 11.70%, respectively.
Key words Tea saponin;Bacteriostasis in vitro;T. rubrum
皂苷,又名皂素,是一类结构复杂的糖苷类化合物,有糖链与三萜类、甾类或甾体生物碱通过碳氧键相连而构成。茶皂素是一类齐墩果烷型五环三萜类皂苷的混合物,它不仅是一种性能优良的纯天然非离子表面活性剂,而且具有较强的起泡、乳化、分散和润湿性能[1],抗癌、抗炎、抗菌作用[2-3],已广泛应用于食品、医药、农业方面。相关研究表明,茶皂素对大肠杆菌和金黄色葡萄球菌有良好的抑菌作用,其最低抑菌浓度(MIC)分别为1.0和0.5 mg/mL[4];茶叶皂苷对皮肤致病真菌表现出良好的抑制活性,其对小孢子霉属病菌的MIC值为10 μg/mL。皮肤癣菌(Trichophyton rubrum)感染所导致的浅部真菌病是人类最常见的皮肤疾病之一,其中,红色毛癣菌是皮肤癣菌总菌株中最为主要的病原菌,它同时也是目前国际上重点研究极力防治的一种皮肤癣菌[5]。茶皂素抗红色毛癣菌的研究鲜见报道。
该试验通過牛津杯抑菌圈方法初步确定茶皂素抑菌作用,采用体外抑菌试验结合立体显微镜观察来研究茶皂素抑制红色毛癣菌机理,以期为天然抗菌剂以及茶皂素治疗皮肤癣菌药用价值的开发提供参考。
1 材料与方法
1.1 试验材料与试剂
茶皂素(纯度95%以上),购自陕西贝农科技有限公司;红色毛癣菌(T.rubrum),购自上海瑞楚科技有限公司;沙氏琼脂培养基(SDA),购自杭州微生物试剂有限公司;沙氏葡萄糖液体培养基(SDB),购自南通凯恒生物科技发展有限公司;0.9%氯化钠溶液,购自福州海王福药制药有限公司。
1.2 试验仪器及设备
电子分析天平,瑞士Sartorius公司(北京);灭菌器 G180TW,北京美国致微ZWALWAY;数显恒温水浴锅HH-4,常州国华电器有限公司;隔水式恒温培养箱GNP-9160,上海精宏实验设备有限公司;洁净工作台SW-CJ-1FD,苏州安泰空气技术有限公司;徕卡立体显微镜LEICA M80。
1.3 试验方法
1.3.1 培养基配制。
1.3.1.1
沙氏琼脂培养基(SDA)配制。蛋白胨10 g/L、葡萄糖40 g/L、琼脂15 g/L、氯霉素0.1 g/L,取沙氏琼脂培养基 65 g 溶于1 000 mL蒸馏水中,加热煮沸充分溶解,分装1 000 mL锥形瓶中,放灭菌锅115 ℃高温高压灭菌15 min,备用。
1.3.1.2
沙氏葡萄糖液体培养基(SDB)配制。动物组织胃蛋白酶水解物和胰酪胨等量混合物10 g/L,葡萄糖20 g/L,pH 5.6±0.2(25 ℃),取沙氏葡萄糖液体培养基30 g,置于1 L蒸馏水中,加热搅拌至完全溶解,分装1 000 mL锥形瓶中,121 ℃ 高压灭菌15 min,放置冷却,备用。
1.3.2 菌液配制。
1.3.2.1
T.rubrum活化。用接种环挑取甘油斜面保存的T.rubrum,划线接种于SDA平板培养基和试管斜面上,于28 ℃隔水式恒温培养箱培养5 d,备用。
1.3.2.2
T.rubrum菌悬液配制。向活化后T.rubrum斜面加入灭菌后的0.9%氯化钠溶液3 mL,用接种环刮取T.rubrum,于120 r/min离心机离心1 min,调整菌悬液浓度为5×107~8×107 CFU/mL,备用。
1.3.3 抑菌指标判定。
试验采用牛津杯法,根据抑菌圈大小判定T.rubrum对茶皂素敏感强度(表1)。称取2 g茶皂素溶于10 mL灭菌纯水中,加热充分溶解,作为母液,取配制好的菌悬液100 μL均匀涂布SDA平板培养基上,静置风干后,等距在平板培养基上放置4个灭菌牛津杯,对角分别是2个空白纯水对照、2个同浓度茶皂素试验对照,培养5 d,用游标卡尺测量抑菌圈大小,初步判定抑菌效果。并通过立体成像显微镜观察抑菌圈内及最外圈T.rubrum形态。
1.3.4 抑制红色毛癣菌MIC测定。
准确称取2 g(接近最大溶解浓度)茶皂素,溶于10 mL纯水中,加热充分溶解,配制成200 mg/mL的母液。
根据改良CLSI M38-A2方案,在洁净工作台中吸取500 μL SDB培养基依次加入48孔板的第1、2、3行试验组的2~8列中,第4、5、6行空白对照组的1~8 列中,将茶皂素母液吸取500 μL加入第1、2、3行的第1列孔中,再吸取500 μL茶皂素母液加入第1、2、3行的第2列孔中,混合均匀后,吸取500 μL到第1、2、3行第3孔,依次进行2倍梯度稀释,最后得到茶皂素药液浓度为200.00~3.12 mg/mL,吸取50 μL配制好的T.rubrum菌悬液加入48孔板,混合均匀后,置于28 ℃ 隔水式恒温培养箱培养5 d后观察能100%抑制T.rubrum生长的浓度为MIC。
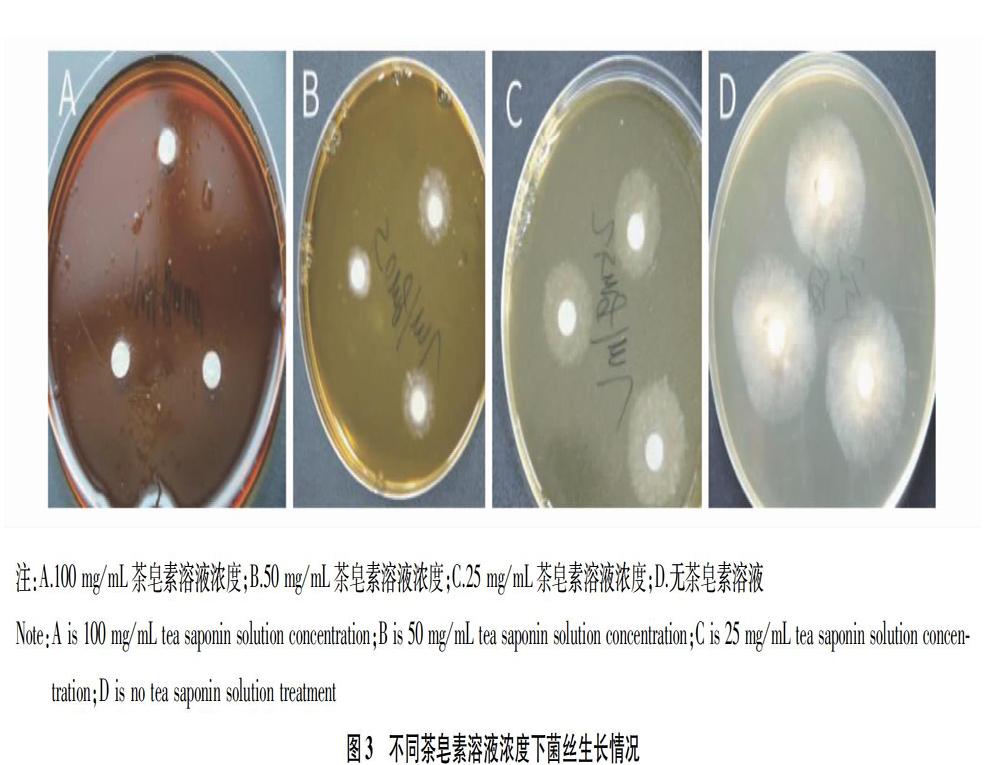
1.3.5 对红色毛癣菌径向生长的影响。
将灭菌后SDA固体培养基定量量取10 mL 于试管中,冷却到50 ℃左右加入5 mL不同浓度的茶皂素溶液混匀,倒入无菌培养皿中,使含茶皂素溶液固体培养基终浓度为100、50、25 mg/mL,空白组不加茶皂素溶液处理,冷却凝固后,在不同浓度茶皂素平板的中心重叠放置直径6 mm的空白滤纸多层,最上一层为浸染稀释的T.rubrum滤纸片,每个平板等距放置3个作为平行试验,置于28 ℃隔水式恒温培养箱中孵育3 d,每天按时观察菌丝径向生长情况,用十字交叉法测量菌丝生长直径。
菌丝径向生长直径(cm)=菌落直径-0.6 cm(空白滤纸直径)(1)
菌丝径向生长抑制率=(空白组菌落直径-试验组菌落直径)/空白组菌落直径×100%(2)
1.3.6 对红色毛癣菌孢子萌发的影响。
1.3.6.1 平板制作。
将灭菌后SDA固体培养基定量量取10 mL 于试管中,冷却到50 ℃左右加入5 mL不同浓度的茶皂素溶液混匀,倒入无菌培养皿中,使含茶皂素溶液平板终浓度为100、50、25 mg/mL,空白组不加茶皂素溶液处理,冷却凝固后,用移液枪在不同浓度茶皂素平板的中心滴加100 μL稀释的孢子菌悬液,置于隔水式恒温培养箱中28 ℃培养72 h后取出。
1.3.6.2 观察孢子萌发情况。
用打孔器取等量的菌块平稳放置在培养皿上,以芽管长度超过孢子直径长度的50%作为萌发的孢子[6],每块菌块选2个显微镜视野计数孢子总数和萌发孢子数,即每个茶皂素溶液浓度下的6个观察数据平均后作为试验数据。
根据下列公式计算出孢子的萌发率:孢子萌发率=孢子萌发数/孢子总数×100%(3)
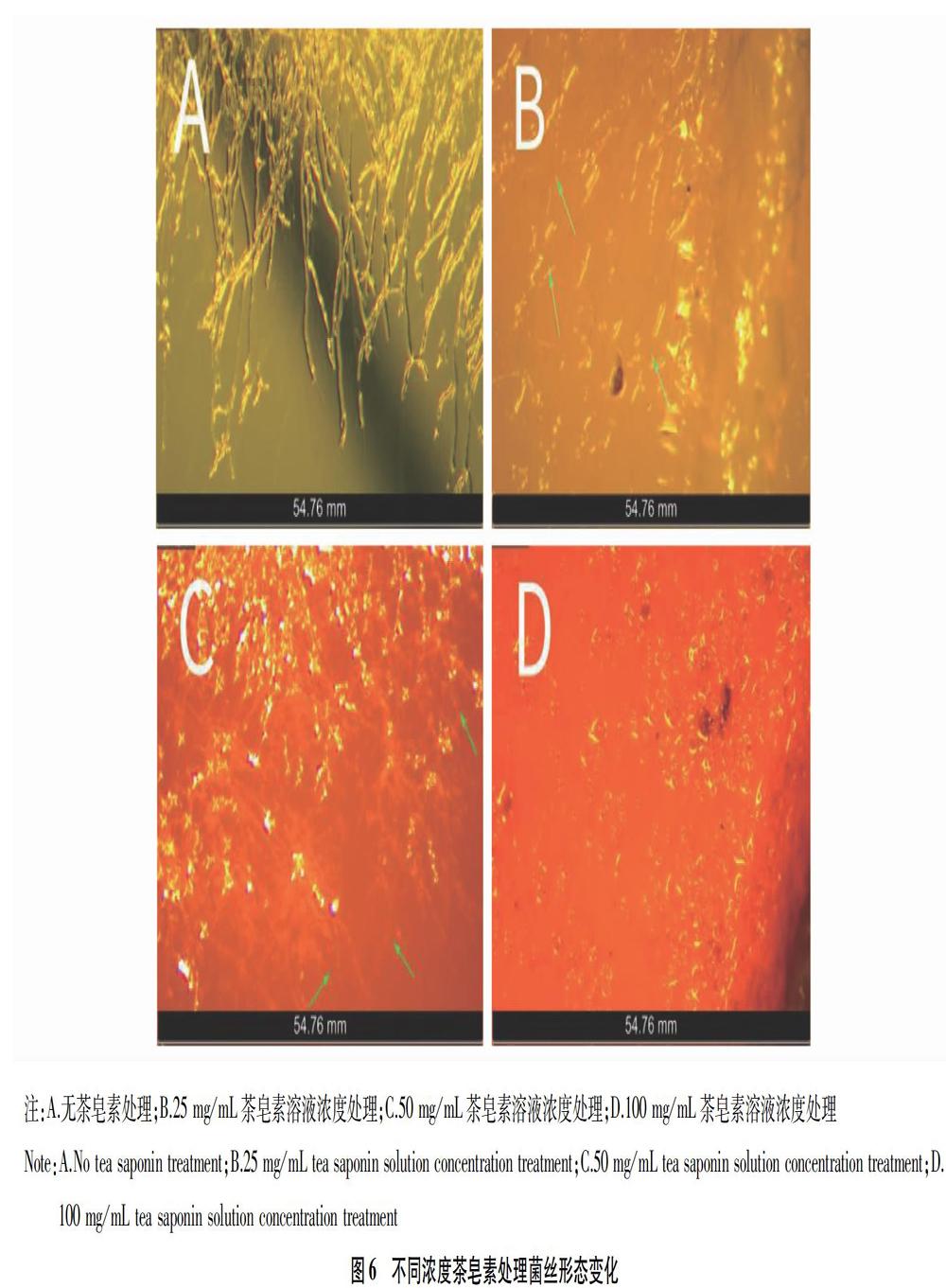
1.3.7 对红色毛癣菌菌丝形态的影响。
称取4 g茶皂素溶于20 mL纯水中作为母液,采用琼脂稀释法,将灭菌后SDA固体培养基定量量取10 mL于试管中,冷却到50 ℃左右加入10 mL不同濃度的茶皂素溶液混匀,倒入无菌培养皿中,使含茶皂素溶液平板终浓度为100、50、25 mg/mL,空白组不加茶皂素溶液处理,冷却凝固后,在不同浓度茶皂素平板上放置3个浸染T.rubrum的滤纸片作为3个平行试验,设置2组,即6个平行试验,置于隔水式恒温培养箱中28 ℃培养5 d后取出,置于立体成像显微镜观察菌丝形态。
2 结果与分析
2.1 抑菌指标判定结果
牛津杯抑菌指标判定结果如图1所示,牛津杯内的溶液会缓慢向杯外扩散,有抑菌作用即能形成抑菌圈,圈内菌种无法生长。培养5 d可以明显看出空白对照长满菌丝,试验组有明显的抑菌圈效果,圈内无菌丝生长,培养基为固体,且菌丝并未向抑菌圈内延伸,排除渗透压引起菌丝死亡。对抑菌圈测量结果(表2)显示,抑菌圈大于15 mm,说明T.rubrum对200 mg/mL茶皂素属于高敏,初步判定茶皂素对T.rubrum有抑制作用。
为区分不是因为茶皂素溶液颜色影响抑菌效果判断,进一步确定茶皂素存在抑制T.rubrum效果,该试验通过立体显微镜观察平板培养基上正常的菌丝生长形态和茶皂素溶液抑菌圈边缘菌丝形态来验证茶皂素抑菌效果。结果显示(图2),无茶皂素处理下菌丝肥壮、有光泽、分割明显,经茶皂素处理后,其抑菌圈边缘菌丝形态出现断裂、无光泽,分割模糊且能看到有内含物质流出痕迹,说明茶皂素能破坏菌丝细胞结构,影响其正常生长,进一步验证茶皂素具有抑制T.rubrum生长的效果。
2.2 茶皂素对红色毛癣菌的最小抑菌浓度
使用48孔板在28 ℃恒温培养箱培养5 d,每板不同茶皂素溶液浓度做3个重复,两板共6个重复,由多人在自然光线用肉眼观察判断,判断结果显示,48孔板中,第1、2、3行1~8孔分别为200.00、100.00、50.00、25.00、12.50、6.25、3.12、0 mg/mL不同茶皂素溶液浓度,从第4孔开始出现不同程度浑浊,6次重复结果一致,故试验组第3孔即是茶皂素最小抑菌浓度,即最小抑菌浓度为50 mg/mL;第4、5、6行均为空白对照,培养第2天便全部出现大量絮状浑浊,T.rubrum生长良好。
2.3 茶皂素对红色毛癣菌径向生长的影响
2.3.1 红色毛癣菌径向生长情况。
为了直观观察茶皂素对菌丝径向生长的影响,该试验采用滤纸片法,将浸染过菌悬液的滤纸片分别接种到不同浓度茶皂素溶液SDA固体平板培养基上,在同等环境培养基上各放置3个滤纸片为平行试验,结果如图3所示。100 mg/mL茶皂素溶液浓度几乎完全抑制T.rubrum径向生长,径向生长直径仅为1 mm,且为散状、点状,断续出现;50 mg/mL茶皂素溶液浓度,T.rubrum径向生长直径为6 mm左右;25 mg/mL茶皂素溶液浓度,T.rubrum径向生长直径为11 mm;无茶皂素处理,T.rubrum自然径向生长直径为26 mm。可见茶皂素抑制T.rubrum作用与茶皂素溶液浓度成正比。
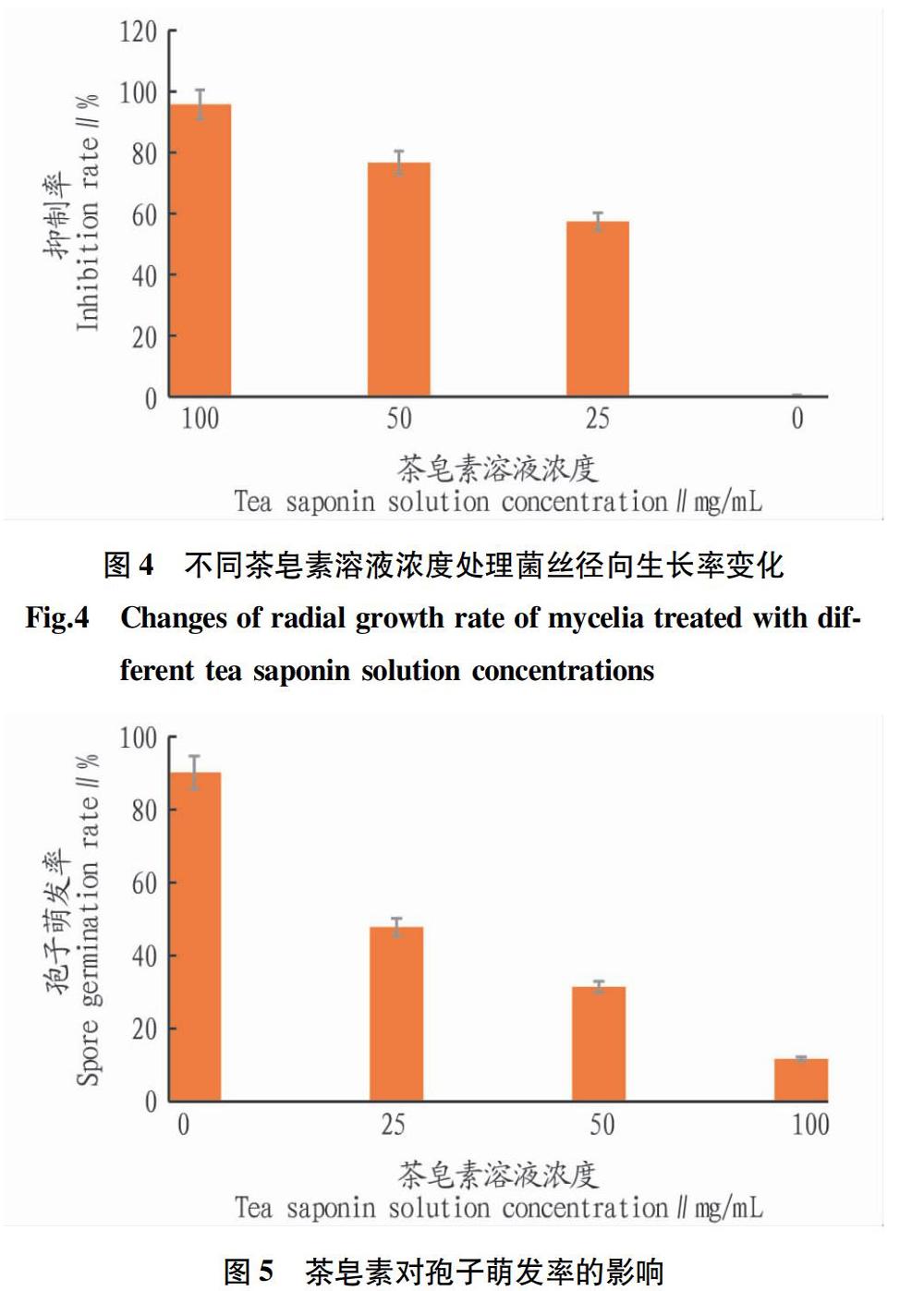
2.3.2 茶皂素对红色毛癣菌径向生长抑制率的影响。
通过游标卡尺测量和菌丝径向生长抑制率公式(2)计算,由图4可知,茶皂素溶液浓度与菌丝的生长状态有显著负相关,100、50、25 mg/mL茶皂素溶液浓度对T.rubrum径向生长抑制率分别为96.10%、76.90%、57.60%。茶皂素溶液浓度与T.rubrum抑制率成正比,对菌丝的正常生长有显著的抑制作用。
2.4 茶皂素对孢子萌发的影响
为了观察孢子萌发情况,该试验将稀释后的孢子菌悬液接种在不同浓度茶皂素溶液与SDA培养基混合平板上,在显微镜下观察孢子萌发情况,并利用公式(3)计算孢子萌发率。结果显示(图5),茶皂素对T.rubrum孢子萌发存在抑制作用,随着茶皂素溶液浓度升高,对T.rubrum孢子萌发抑制越强,孢子萌发率越低,茶皂素溶液浓度为25和50 mg/mL时,孢子萌发率分别为47.82%和31.43%;茶皂素溶液浓度为100 mg/mL时,孢子萌发率仅为11.70%。
2.5 茶皂素对红色毛癣菌菌丝形态的影响
为针对性地探究茶皂素对T.rubrum菌丝形态的影响,该试验分别在0.5MIC浓度(25 mg/mL)茶皂素、MIC浓度(50 mg/mL)茶皂素、2MIC浓度(100 mg/mL)茶皂素、无茶皂素处理平板培养基上试验。由图6可知,无茶皂素处理,菌丝生长饱满肥壮,分叉明显;0.5MIC浓度茶皂素处理,菌丝开始出现断裂,分隔模糊;MIC浓度茶皂素处理,菌丝大量断裂,内含物质泄漏明显,部分菌丝粉碎,分割十分模糊;2MIC浓度茶皂素处理,菌丝几乎无法生成,仅剩部分点状内含物质,说明茶皂素能破坏菌丝结构,影响其生长甚至导致其死亡。
3 讨论与结论
致病性真菌对于现有抗真菌药物的耐药性逐渐增强,临床上广泛使用抗生素、抗癌药物及免疫抑制劑加上化疗、器官移植、外科手术等治疗方法可能会造成病人相关免疫系统功能的损伤,是真菌易发感染的主要原因,因此,真菌病已经成为影响人们健康的重大医学问题之一。天然抗菌剂拥有着丰富的化合物结构资源,已经成为医学寻找安全性好、抗菌谱广、疗效高的抗真菌药物的一个非常重要的研究方向,对红色毛癣菌相关研究表明,鞣花酸的抗真菌作用较显著,其对T.rubrum最敏感,最低抑菌浓度(MIC)为64 μg/mL[5];用芳樟醇处理后,红色毛癣菌细胞壁降解模糊,表面粗糙且厚度不均匀,细胞内膜皱缩破损,轮廓不清,部分细胞器损坏表现为膜碎片以及细胞质内容物泄露[6];从茶树中提取的精油成分[7],可以通过改变膜的性质和破坏膜的相关功能,破坏白念珠菌的渗透性和膜流动性,同时还可导致菌丝壁变薄和变形,促使细胞壁破裂,最后使菌丝顶端变平或者变为芽状结构[8];地锦草提取物256 μg/mL时,可显著降低红色毛癣菌中角鲨烯环氧化酶的活性(P<0.01),其抗真菌机制可能与抑制角鲨烯环氧化酶的活性、影响麦角甾醇的生物合成有关[9],说明部分天然提取抑菌剂具有较好的抗皮肤癣菌效果。除了研究开发单一天然抑菌剂外,联合抗真菌合成药物将有助于提高治疗效果,减弱抗生素副作用,是研究开发天然抑菌剂的价值之一。王彭[10]对80例由红色毛癣菌引起的足癣、股癣、体癣、手癣患者进行观察,通过试验表明,达克宁与水杨酸联合治疗红色毛癣菌病5周后,其痊愈率为82%;王丹等[11]研究丹参酮联合抗真菌药物对红色毛癣菌的体外药敏表明,丹参酮与伊曲康唑、卡泊芬净联合具有协同作用并可抑制红色毛癣菌活性。
该试验通过茶皂素抗红色毛癣菌(T.rubrum)体外抑菌研究,发现T.rubrum对茶皂素高敏,在200 mg/mL的茶皂素溶液浓度下,采用牛津杯培养法形成的抑菌圈并非是十分规则的圆形,说明并不是真菌细胞内外的渗透压引起的真菌死亡,可能是茶皂素某些生化活性物质能抑制其菌丝生长,且能抑制其孢子萌发,破坏其菌丝结构,使菌丝断裂破碎,影响其正常生长,该试验研究目标希望进一步细化明确天然抑菌剂茶皂素组成活性成分抑菌结构,为天然抑菌剂的高效利用做贡献。由于尚未看到茶皂素抑制红色毛癣菌的报道,试验下一步将进行基因组的测序,明晰茶皂素如何影响并破坏红色毛癣菌结构变化,提供更有力的证据表明茶皂素抑制红色毛癣菌生长作用。该研究可为天然抗菌剂开发提供理论参考,同时为茶皂素综合利用开发提供指导。
参考文献
[1]FENG J,CHEN Y,LIU X,et al.Efficient improvement of surface activity of tea saponin through Gemini-like modification by straightforward esterification[J].Food chemistry,2015,171:272-279.
[2]CHEOK C Y,SALMAN H A K,SULAIMAN R.Extraction and quantification of saponins:A review[J].Food research international,2014,59:16-40.
[3]谷子,文汉.用分光光度法测定油茶皂素的含量[J].安徽农业科学,2006,34(14):3262-3264.
[4]ZHAO Y,SU R Q,ZHANG W T,et al.Antibacterial activity of tea saponin from Camellia oleifera shell by novel extraction method[J/OL].Industrial crops & products,2020,153[2020-07-21].https∥doi.org/10.1016/j.indcrop.2020.112604.
[5]阿米娜·阿不拉.鞣花酸体外抗红色毛癣菌作用及机制研究[D].乌鲁 木齐:新疆医科大学,2017.
[6]唐曉莲.芳樟醇抗红色毛癣菌机理及生物活性研究[D].重庆:重庆理工大学,2018.
[8]HAMMER K A,CARSON C F,RILEY T V.Antifungal effects of Melaleuca alternifolia(tea tree)oil and its components on Candida albicans,Candida glabrata and Saccharomyces cerevisiae[J].Journal of antimicrobial chemotherapy,2004,53(6):1081-1085.
[9]安惠霞,李治建,古力娜·达吾提,等.地锦草提取物对红色毛癣菌酶活性的影响[J].时珍国医国药,2010,21(4):787-788.
[10]王彭.达克宁与水杨酸治疗红色毛癣菌病疗效观察[J].检验医学与临床,2005,2(5):234-235.
[11]王丹,吴景良,齐海花,等.丹参酮联合抗真菌药物对红色毛癣菌的体外药敏实验研究[J].中国药师,2019,22(4):747-750.

