先天性心脏病突变体小鼠模型的建立
尹梓豪,孙一兵,向寿莲,张 健,丁小凤,李立民
(湖南师范大学 a.生命科学学院;b.工程设计学院,中国 长沙 410081)
先天性心脏病 (congenital heart disease, CHD) 是小儿最常见的心脏病, 多出现因胚胎发育早期心脏及大血管的形成障碍引起的局部结构异常,或出生后心脏应自动关闭的通道未能闭合。先天性心脏病通常根据左右两侧及大血管之间的分流情况分为左向右分流型(潜伏青紫型,主要类型有室间隔缺损VSD、房间隔缺损ASD和动脉导管未闭PDA)、右向左分流型(青紫型,主要类型为法洛四联症TOF和完全性大动脉转位TGA)、无分流型(无青紫型,主要类型为肺动脉狭窄PS)三大类[1],是具有严重危害的先天畸形,且可有两种以上畸形并存。先天性心脏病的相关影响因素比较复杂,目前尚未完全明确其确切的病因,但大多数研究认为先天性心脏病是由遗传[2]与环境因素[3]共同作用而引起的,其中遗传因素包括基因异常和染色体异常等[4,5]。在母亲妊娠的早期尤为关键,其中孕期营养不足、妊娠早期服用药物或者妊娠早期病毒感染等[6]因素都可能会造成小儿先天性心脏病。
AP-2家族包括AP-2α,AP-2β,AP-2γ,AP-2d和AP-2e,是一类分子量为52 000的转录因子,有其独特的蛋白质结构,其N端是富含脯氨酸和谷氨酸的转录激活域,中间是DNA结合结构域,C端的helix span helix结构可以形成二聚体[7,8]。AP-2基因家族在脊椎动物的胚胎发育过程中起重要的调控作用[9],有研究表明Tfap2a在发育的小鼠胚胎中显著表达[10],缺乏转录因子Tfap2a的小鼠胚胎可以存活下来,但Tfap2a基因缺失的小鼠可能存在神经管、肢体间充质细胞、颅面部发育障碍,严重时使小鼠在围产期由于无脑畸形、心脏形态异常且发育迟缓、脏器缺陷、体壁缺乏等严重畸形而死亡[11,12],体现了AP-2α在胚胎发育中的重要作用。笔者在利用基因打靶构建的AP-2α-lacZ转基因小鼠FX18[13]的基础上,继续繁殖该小鼠,偶然发现了该转基因小鼠的一种突变体,此小鼠突变体心脏发育异常,为研究提供了一种先天性心脏病小鼠模型。
1 材料与方法
1.1 材料
FX18小鼠由实验室构建,琼脂糖购于Invitrogen公司。DNA上样缓冲液,DNA Marker购于Thermo公司;二甲苯,多聚甲醛,20×PBS,溴化乙锭,Tween-20,EDTA,SDS,NaCl,NaOH及蛋白酶K等均购于上海生工公司;其它常规试剂均为国产分析纯。心电图仪单导程全自动ECG-11A型购自广东东江电子仪器厂,频响范围为0~90 Hz,纸速为50 mm·s-1,自制针状电极。恒温烘箱购自上海精宏实验设备有限公司。病理切片机RM2016购自上海俫卡仪器有限公司。
1.2 方法
1.2.1 小鼠的饲养与繁殖 将已构建的FX18小鼠置于SPF级动物房饲养,鼠房内温度控制在18~26 ℃,光照控制为12/12,饲养笼盒、饮水瓶、垫料、各种实验用具和衣服采用高压蒸汽灭菌器消毒,小鼠饲料采取紫外消毒,进入动物房内的实验物品通过紫外消毒经传递窗单向传入。将雄性小鼠和雌性小鼠以1∶2的比例进行交配繁殖。所有实验经过湖南师范大学动物伦理委员会许可。
1.2.2 转基因小鼠的鉴定 将通过基因打靶和显微注射已经建立的FX18转基因小鼠,生长至3周,剪取约0.5 cm小鼠尾巴,提取基因组DNA,提取后的基因组DNA使用正向引物LacZ-F1 (5’-TACAACGTCGTGACTGGGAA-3’)和反向引物LacZ-R1 (5’-CCAGATAACTGCCGTCACTC-3’) 进行PCR扩增, PCR条件为预变性94 ℃,1 min 20 s,再经 94 ℃ 45 s,60 ℃ 45 s,72 ℃ 2 min,32个循环;然后72 ℃延伸10 min。最后得到PCR产物片段大小为562 bp。
1.2.3 小鼠胚胎与心脏的包埋、切片和HE染色 包埋切片:分别取一窝E13.5小鼠整个胚胎和4周龄小鼠的整个心脏,置于预先配好的固定液(4%多聚甲醛)中于4 ℃下固定24 h。将组织块放入烧杯中,流水冲洗24 h,不要让组织块沉积在烧杯底部。按50 %乙醇1 h,70%乙醇2 h,80%乙醇2 h,95%乙醇2 h,95%乙醇2 h,无水乙醇2 h,无水乙醇2 h对组织块进行梯度脱水。将组织块转入无水乙醇与二甲苯等体积混合的溶液中处理30 min,再将组织块浸泡在二甲苯中30 min,使组织块透明。融化石蜡,置于60 ℃烘箱。配置二甲苯与石蜡等体积混合液,处理组织块30 min,将处理后的组织块放入融化后的石蜡进行包埋。使用切片机对包埋后的组织块进行切片。
HE染色:依次将切片放入二甲苯15 min两次,无水乙醇5 min两次,85%酒精5 min,75%酒精5 min,蒸馏水洗,放入苏木精水溶液中染色5 min后,依次入1%盐酸乙醇30 s,流水冲洗30 s,蒸馏水冲洗5 s。置于0.5%酒精伊红染色液染色1~3 min,蒸馏水洗30 s,75%酒精5 min,85%酒精5 min,无水乙醇5 min两次,再经二甲苯15 min两次使切片透明。将已透明的切片滴上加拿大树胶(国药集团化学试剂有限公司),盖上盖玻片封片固定。
1.2.4 小鼠心电图的检测 使用4%的水合氯醛按0.2 mL/10 g体质量的剂量麻醉3~4周龄小鼠,电极连线分为红色(R)右上肢、黄色(L)左上肢、黑色(RF)右下肢、绿色(LF)左下肢,将针电极分别刺入其四肢皮下,记录标准导联和单极加压肢体导联的心电图。
1.2.5 数据统计与分析 采用 Graph Pad Prism7软件,计量资料用x±s表示。两组间比较采用t检验。P<0.05为有差异统计学意义。
2 结果
2.1 FX18突变体小鼠体质量和心脏质量明显减少,且在4周龄左右死亡

图1 FX18转基因小鼠的构建和突变体小鼠的发现(a) FX18小鼠的构建策略;(b) 亲本小鼠(空心箭头)与突变体小鼠(实心箭头)体型图;(c) 正常小鼠与突变体小鼠的体质量比较;(d) 正常小鼠与突变体小鼠心脏质量的比较 Fig. 1 Construction of FX18 transgenic mice and discovery of mutant mice(a) Construction strategy of FX18 mice; (b) Figures of Wild-type and mutant mice, parent mice (hollow arrow) and mutant mice (solid arrow); (c) Weight comparison of Wild-type and mutant mice; (d) Cardiac weight comparison of Wild-type and mutant mice
为了研究AP-2α在发育过程中特定的调控作用,笔者通过基因打靶和显微注射获得了FX18转基因小鼠,并提取3周龄小鼠尾巴基因组,使用PCR鉴定,获得了562 bp的LacZ条带,证明该转基因小鼠构建成功(图1a)[13]。在FX18小鼠繁殖过程中发现了FX18小鼠的突变体,与正常小鼠相比,FX18突变体小鼠明显发育迟缓,非常瘦小,体型较同胎的正常或杂合子小鼠偏小40%~60%,并在4周龄左右时死亡,而正常小鼠和FX18杂合子小鼠外形和大小无差别(图1b)。突变体小鼠的体质量和心脏质量均为同胎出生的正常或杂合子FX18小鼠40%~60%(图1c,d),这说明突变体小鼠的发育受到了严重的影响,而心脏质量的异常提示FX18突变体小鼠可能与心脏结构异常及功能障碍有关。
2.2 FX18突变体小鼠E13.5胚胎发育异常
为了研究FX18突变体小鼠和杂合子小鼠的发育缺陷,将雌性FX18杂合子小鼠与雄性FX18杂合子小鼠按 2∶1的比例合笼,下午 5 点交配,第二天上午9点左右检查精栓,若发现阴栓则定为E0.5天,然后于E13.5天颈椎脱臼法处死孕鼠,剖腹暴露子宫,在体视显微镜下解剖,获取E13.5天的全部胚胎。观察胚胎形态,发现2号胚胎较其它胚胎体型小,胚胎整体偏白色,结构模糊不清,发育滞后(图2a),该胚胎的尾椎不完全,并没有出现明显的手指分化,发育比正常胚胎延迟2天左右,心脏形态发育不明显。3号和4号胚胎则表现为颅骨裂的严重神经管缺陷,头部异常形态,躯干大小缩小,心脏形态异常。提取胚胎组织基因组DNA,证明2号胚胎的基因型为-/-,3号和4号胚胎的基因型为+/-,其余正常胚胎均为+/+。这些结果提示FX18突变体小鼠在胚胎时期出现了发育落后、尾椎发育不全、手指分化不明显且体积偏小、心脏形态异常的现象。

图2 FX18突变型小鼠胚胎的观察和鉴定(a)正常小鼠、杂合子小鼠与2号突变体小鼠胚胎的对比;(b) 正常小鼠与FX18突变体小鼠的基因型鉴定Fig. 2 Observation and identification of FX18 mutant mice embryos(a) Comparison of Wild-type and No. 2 mutant mouse embryos; (b) Genotypic identification of Wild-type mice and FX18 mutant mice
2.3 突变体小鼠室性早搏且伴有左心室肥厚
对3~4周龄的正常小鼠和突变体小鼠分别进行心电图检测,如图3所示,正常小鼠的心电图为窦性心律,P波波形aVR导联为倒置,其余为直立。QRS波除aVR主波向下,其余导联呈Qrs,qR,qRs,Rs和rS等,无明显ST段。P波、QRS波的时间、振幅等均与文献[14]中报道的类似。与之对比,突变体小鼠(FX18-/-)的心电图中,aVR导联的P波与QRS主波出现了正置,且QRS波群提前发生,宽大畸形,为完全性代偿间歇,属于较典型的室性早搏,同时QRS波群电压较正常小鼠有显著增高。观察小鼠的心脏纵切片发现,突变体小鼠的左心室肥厚,为正常小鼠厚度的3~4倍;横切片显示突变体小鼠的左心室室腔变小,约为正常小鼠容积的1/4,提示突变体小鼠发生了先天性心脏疾病。
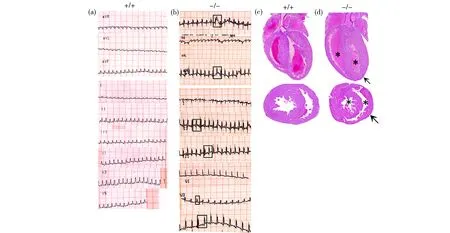
图3 正常小鼠(a,c)和突变体小鼠(b,d)的心电图及心脏切片Fig. 3 (a) Electrocardiogram of Wild-type mice, (b) Electrocardiogram of mutant mice, indicative abnormal waves (box), (c) Heart sections of Wild-type mice, (d) Heart sections of mutant mice ,ventricular hypertrophy (arrow) and ventricular cavity narrowing (asterisk)
3 讨论
先天性心脏病的最常见临床类型包括房室间隔缺损(AVSD)、大动脉易位(dTGA)、圆锥动脉干畸形(CTD)、法洛四联症(TOF)、动脉导管未闭(PDA)等,而这些常见的临床类型大多有相应的易感基因[15-24]。AP-2基因家族是人类发现的第一个与动脉导管未闭相关的遗传基因。之前的研究表明,神经嵴细胞对心脑血管疾病的发生起了重要的作用,动脉导管未闭(PDA)可能是神经嵴细胞发育异常的结果,而该基因家族在神经外胚层衍生细胞的分化中也扮演着重要的角色,尤其是AP-2β在胚胎发育的过程中与神经嵴细胞表达的位置一致,且该基因的突变以显性负调控机制的方式改变神经嵴细胞的迁移和分化[25],进而可能在导管中产生异常,来诱发动脉导管未闭[26]。AP-2β基因缺失也可能会导致内皮素-1及Hif2a在动脉导管平滑肌水平表达缺失,影响平滑肌层组织的特异性发育,从而导致动脉导管未闭合。同时,AP-2β可以刺激某些影响神经嵴细胞发育的基因信号通路中断,从而在胚胎期导致最终会发育为动脉导管的第6主动脉弓发育异常[27]。因此,AP-2β的突变或表达量降低可能影响了动脉导管未闭。
本研究构建的FX18转基因小鼠,是通过基因打靶构建的AP-2α报告基因小鼠,在繁殖过程中出现了突变体,可能由于基因打靶的非特异性引起某功能基因突变从而出现了异常小鼠表型。笔者研究发现突变体小鼠的心脏有明显的左心室肥厚。左心室肥厚是动脉导管未闭的症状之一,也是引发左心室流出道阻塞的危险因素之一[28]。有研究表明,AP-2α在胚胎发育和心脏发育中起重要作用,AP-2α可能通过参与咽下区神经嵴与周围组织的相互作用,促进正常心脏流出道形态发生。AP-2α缺陷的小鼠胚胎中出现明显的心脏流出道发育畸形[29],故突变体小鼠可能是AP-2α基因出现了错义突变。由于AP-2β在胚胎发育的过程中与神经嵴细胞表达的位置一致,对神经嵴细胞的迁移分化产生了影响[25],并且突变小鼠的表型符合动脉导管未闭的特征,暗示该突变也可能影响了AP-2α与AP-2β之间的异源二聚体相互作用。该突变体小鼠的详细作用机理、可能的突变基因或者其它先天性心脏病易感基因之间的相互影响等尚有待进一步研究。
总之,笔者发现了一类突变体小鼠,该小鼠从胚胎阶段即出现了明显的发育滞后和心脏异常,其与先天性心脏病之间可能存在重要关联,其详细的调控机制还有待后续进行深入研究。本研究也说明FX18转基因小鼠的突变体具有先天性心脏病研究小鼠模型的潜力。

