夹竹桃麻素对兔心房肌细胞氧化应激损伤L型钙电流及动作电位时程的影响
刘 岩,李 泱,叶加虎,刘 昕,王延坤,单兆亮
1 解放军医学院,北京 100853;2 解放军总医院 京北医疗区,北京 100091;3 解放军总医院第一医学中心 心内科,北京 100853
近年来,心房颤动(房颤)的全球患病率及其相关死亡率显著上升,社会负担逐年增加,影响着公共健康[1-3]。房颤的发生、发展机制复杂,大量研究表明氧化应激与房颤关系密切[4-6]。夹竹桃麻素(apocynin,APO)是氧化应激损伤过程中重要的氧化酶抑制剂,其能够对抗氧化应激的损伤作用[7-8]。本课题组以往研究表明,APO对兔心房肌细胞瞬时外向钾电流及超速激活延迟整流钾电流氧化应激损伤具有保护作用[9]。但APO对L型钙电流(L-type calcium current,ICa,L) 和动作电位时程(action potential duration,APD)的氧化应激损伤是否有保护作用未见报道。因此,我们运用了膜片钳技术,研究APO对ICa,L和APD氧化应激损伤的保护作用。
材料和方法
1 实验动物 从解放军总医院实验动物中心购买新西兰白兔15只,体质量1.0~1.5 kg,雌雄不限。本实验经解放军总医院动物实验伦理委员会批 准(编号:20110010703)。
2 试剂 夹竹桃麻素、CaCl2、胰蛋白酶、CdCl2、胶原酶Ⅱ购自Sigma公司。其他为国产试剂。台式液:葡萄糖10 mmol/L,MgCl21.0 mmol/L,CaCl21.8 mmol/L,NaCl 135 mmol/L,NaH2PO40.33 mmol/L,HEPES 10 mmol/L,KCl 5.4 mmol/L,NaOH调整pH值至7.4[9]。酶液:胰蛋白酶12 mg,Ⅱ型胶原酶70 mg,无钙台式液50 mL[9]。反转录及qPCR试剂(北京TransGen公司),抗CACNA1C小鼠单克隆抗体(ab84814) (Abcam公司,英国),抗GAPDH小鼠单克隆抗体(TA-08),其 他试剂均为分析纯。
3 兔单个左心房肌细胞的分离 按文献[10-12]方法并加以改进制备兔单个左心房肌细胞。术前配制麻药水合氯醛(200 g/L)。经腹腔注射(2 mL/kg)麻药,彻底麻醉后从胸部剪开快速取心脏,随后在Langendorff装置上灌流。首先用无钙台式液灌流3~5 min,随后再用酶液灌流20~25 min。灌流过程中维持37℃并通100%纯氧。灌流完毕后将左心房组织剪碎入KB液中,同时边剪边吹打。最后将分离细胞保存于4℃ KB液中,静止1 h后实 验。
4 分组及处理 将兔左心房肌细胞共分为5组:1)对照组:不做处理,直接实验;2)10 µmol/L H2O2组:10 µmol/L的H2O2培养30 min后实验;3)50 µmol/L H2O2组:50 µmol/L的H2O2培 养30 min后实验;4)50 µmol/L H2O2+ 100 µmol/L APO组:100 µmol/L APO培养60 min,再50 µmol/L H2O2培养30 min后实验;5)APO组:100 µmol/L A PO培养90 min后实验。
5 膜片钳全细胞L型钙电流及动作电位记录 挑选无收缩、状态良好、横纹清晰的细胞进行实验。高阻(>1 GΩ)封接破膜后,行全细胞记录。离子电流信号经AXON-700B膜片钳放大器、软件(pCLAMP)控制采集、贮存及分析。电压钳模式 行电流记录。电流钳模式行动作电位记录。
6 RT-qPCR法 检 测 肌 细 胞L型 钙 离 子 通道CACNA1C mRNA的表达水平 每组细胞分别处理后,应用Trizol试剂一步法行心房肌总RNA提取。应用两步法行RT-qPCR反应。CACNA1C上游引物5′-GATGCAAGACGCTATGGGCTATGAG-3′,下游引物5′-GCATGCTCATGTTTCGGGGTTT GTC-3′均由上海捷瑞公司设计与合成。NanoDrop 2000评估各样本的质量,A260/A280在1.8~2.1,A260/A230>1.8为合格。各样本上样1 µg,随机反转录为cDNA。以对照组第一个样本为参照样本,采用 2−ΔΔCt法评估各组相对表达数值。实验重复3次。
7 Western blot检测肌细胞CaV1.2蛋白的表达水平 将以上5组细胞经预冷的PBS两次漂洗后,用细胞裂解液(含蛋白酶抑制剂)于准备好的冰块上裂解30 min;12 000 g离心15 min,行上清液收集;用BCA法测定浓度后,高温使蛋白变性,加样,用5%浓缩胶和8%分离胶跑胶,行湿转法转膜。抗鼠抗兔CaV1.2单克隆抗体以1∶1 000稀释,CaVβ2以1∶1 000稀释,4℃孵育后过夜,TBST洗膜5 min×3次,Ⅱ抗孵育1.5 h后行3次洗膜,ECL法显色。行半定量分析(应用Image J图像分析软件)。用目的蛋白和GAPDH条带光密度 值的比值表示蛋白质的相对含量。
8 统计学处理 使用SPSS23.0进行研究资料分析。观测资料均为计量数据,均通过正态性检验,以±s 表示。两组间的比较为成组t检验或校正t检验。多组间的比较为单因素方差分析+两两比 较LSD-t检验。检验水准α=0.05。
结 果
1 APO对兔单个左心房肌细胞ICa,L的作用 10 µmol/L H2O2组:ICa,L峰值从(−18.5±0.1) pA/pF减至(−10.7±0.7) pA/pF (P<0.01,n=13);50 µmol/L H2O2组:ICa,L峰 值 从(−18.5±0.1) pA/pF减 至(−9.4±0.8) pA/pF (P<0.01,n=13);50 µmol/L H2O2+100 µmol/L APO组:ICa,L峰值为(−16.7±1.6) pA/pF,与50 µmol/L H2O2组比较差异有统计学意义(P<0.01,n=13);100 µmol/L APO组:ICa,L峰值为(−17.2±1.3) pA/pF,与对照组比较无统计学差异 。见图1。
2 APO对ICa,L电流-电压曲线的作用 在0 mV时电流达峰值,电流-电压呈现出“倒钟”型曲线。在H2O2作用下,电流明显被抑制,电流-电压接近“三角”型曲线。预先给予100 µmol/L APO后,电 流抑制得到恢复。见图2。
3 APO对ICa,L稳态激活和稳态失活曲线的作用 在H2O2作用下,激活曲线正移。H2O2(10 µmol/L)组:半激活电压(V1/2,act)由(−37.5±0.6) mV正移至(−29.3±0.4) mV (P<0.05);H2O2(50 µmol/L)组:半激活电压(V1/2,act)由(−37.5±0.6) mV正移至(−20.3±0.5) mV (P<0.01);H2O2(50 µmol/L)+APO (100 µmol/L)组:V1/2,act恢复至(−29.8±0.3) mV(与50 µmol/L H2O2组比较差异有统计学意义,P<0.05)。提示APO可能通过增加通道稳态激活来减少H2O2对ICa,L电流的影响,各组曲线斜率(k)改变较小(图3A)。在H2O2作用下,失活曲线负移。H2O2(10 µmol/L)组:半失活电压(V1/2,act)由(−19.2±0.7) mV负移至(−25.5±0.8) mV (P<0.05);H2O2(50 µmol/L)组:半激活电压(V1/2,act)由(−19.2±0.7) mV负 移 至(−29.3±0.4) mV (P<0.01);H2O2(50 µmol/L)+APO (100 µmol/L)组:V1/2,act恢复至(−25.9±0.7) mV (与50 µmol/L H2O2组比较差异有统计学意义,P<0.05)。提示APO可能通过减缓通道稳态失活过程来减少H2O2对ICa,L电流的影响,各 组曲线斜率(k)改变较小(图3B)。
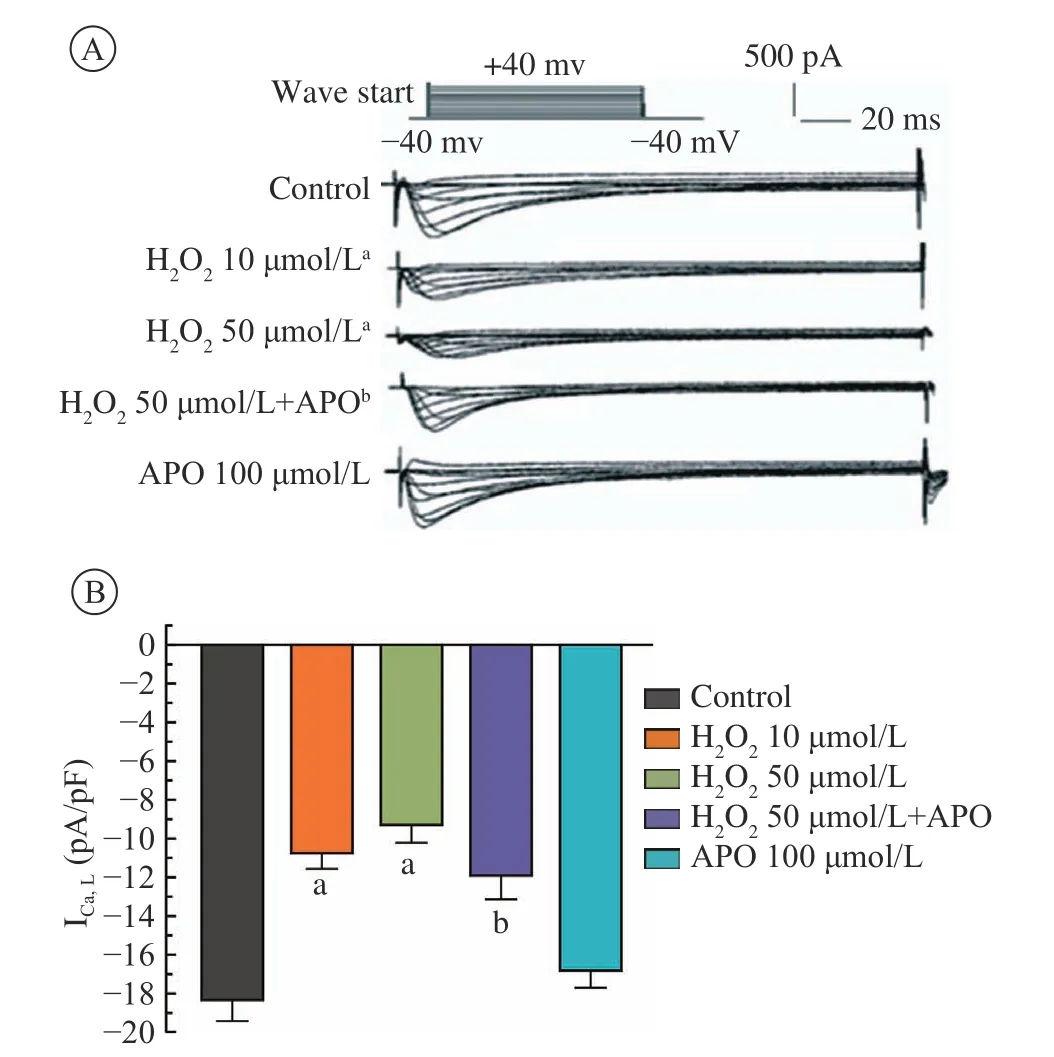
图 1 APO对心房肌细胞ICa,L的作用(n=13)A:ICa,L电流图;B:ICa,L最大峰值电流的对比;aP<0.01,vs对照组;bP<0.01,vs 50 µmol/L H2O2处理组Fig.1 Effect of APO on ICa,Lof atrial myocyte (n=13)A: current of ICa,L; B: contrast of the peak current of ICa,L; aP<0.01, vs control group; bP<0.01, vs 50 µmol/L H2O2

图 2 APO对ICa,L的电流-电压曲线的作用(n=13)F ig.2 Effect of APO on the I-V curve of ICa,L (n=13)
4 APO对ICa,L失活后恢复动力学的作用 各组通道电流失活后,通道恢复曲线基本保持一致。见 图4。
5 APO对动作电位的作用 在H2O2作用下,动作电位形状发生变化,RMP绝对值降低,APD缩短,APD50及APD90均降低(与对照组差异有统计学意义,P<0.05)。应用100 µmol/L APO后上述降低得到显著恢复,APD50与H2O2处理组比较差异 有统计学意义(P<0.05,n=13)。见图5,表1。

图 3 APO对ICa,L稳态激活和稳态失活曲线的作用(n=13)Fig.3 Effect of APO on steady-state activation and steady-state inactivation curve of ICa,L (n=13)
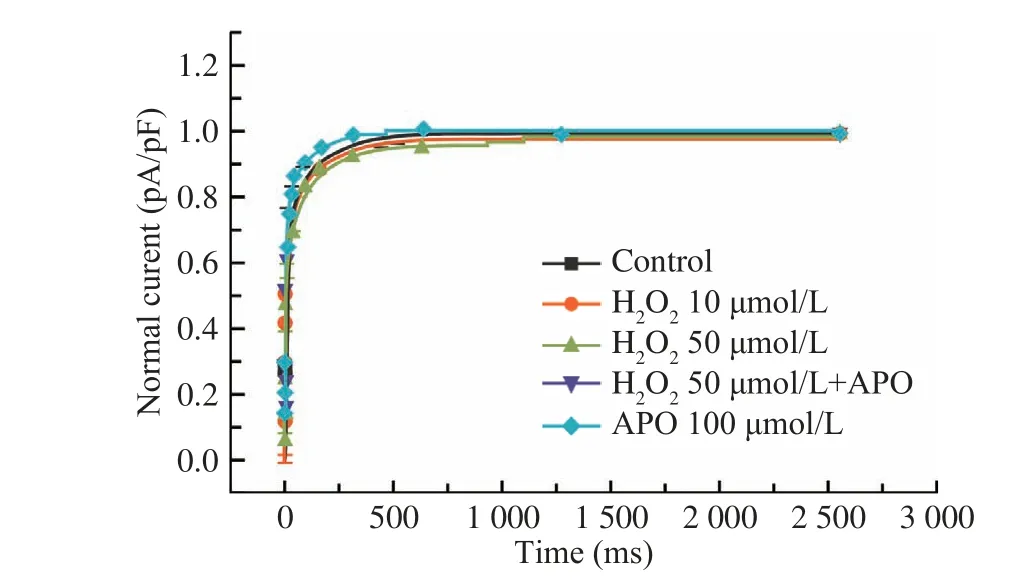
图 4 APO对ICa,L失活后恢复动力学的作用(n=13)F ig.4 Effect of APO on the recovery from inactivation of ICa,L (n=13)

图 5 APO对APD的的作用F ig.5 Effect of APO on APD
6 qPCR法检测H2O2对肌细胞CACNA1C mRNA表达的影响及APO的作用 图6显示,CACNA1C mRNA表达:对照组为1.102±0.050,H2O2组(10 µmol/L)为0.810±0.042,H2O2组(50 µmol/L)为0.790±0.035,APO(100 µmol/L)+ 50 µmol/L H2O2组为1.024±0.080,单纯APO组为1.083±0.060。提示APO对H2O2处理后CACNA1C mRNA表达下 调有明显的抑制效应(P<0.05,n=13)。
7 Western blot 检测兔左心房肌细胞CaV1. 2蛋白的表达 图7显示,H2O2处理后,可以使CaV1.2蛋白表达下调,而应用APO (100 µmol/L)后,此下 调得到恢复(P<0.05,n=3)。
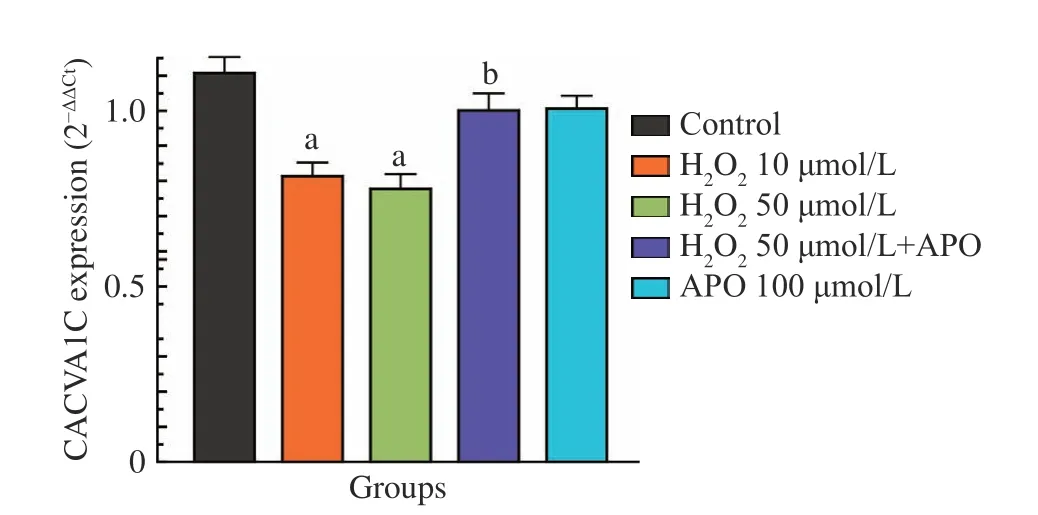
图 6 APO对肌细胞CACNA1C mRNA表达的作用(aP<0.05,vs对照组 ;bP<0.05,vs 50 µmol/L H2O2组)Fig.6 Effect of APO on the expression of CACNA1C mRNA (aP<0.05, vs control group;bP<0.05, vs 50 µmol/L H2O2)
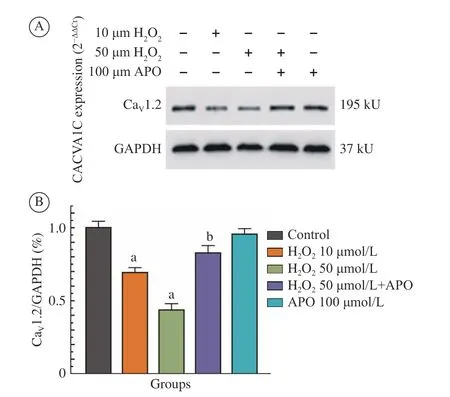
图 7 Western blot 检测兔左心房肌细胞CaV1.2蛋白的表达(aP<0.05,vs 对照组;bP<0.05,vs 50 µmol/L H2O2)Fig.7 Expression of CaV1.2 tested by Western blot (aP<0.05, vs control group; bP<0.05, vs 50 µmol/L H2O2)
讨 论
房颤是临床上最常见的心律失常之一,其机制复杂,大量研究表明,氧化应激是诱发和维持房颤的重要机制之一[3,13]。本文用低浓度H2O2(10 µmol/L、50 µmol/L)创建氧化应激模型[14],探讨APO对左心房肌细胞是否具有保护作用。
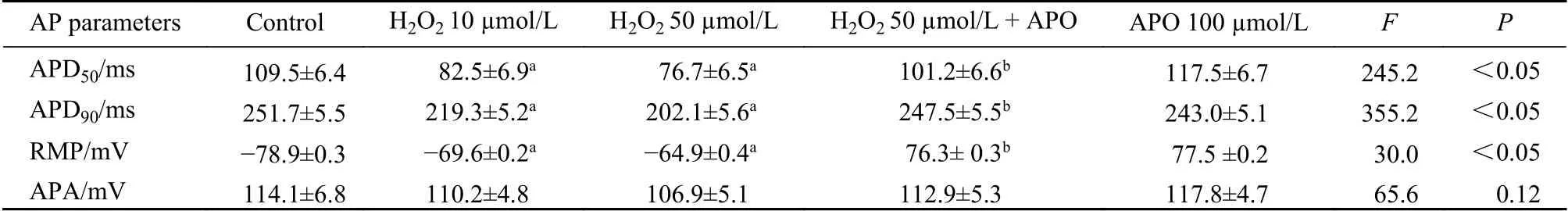
表 1 H2O2与APO对体外兔左心房肌细胞AP各参数影响指标的比较 ( n =13,x¯±s )Tab. 1 Comparison of the effect of H2O2 and APO on AP parameters ( n =13,x¯±s )
APO抑制H2O2处理所致的兔左心房肌细胞ICa,L电流密度降低,分析其门控动力学机制:APO可能通过改变左心房肌细胞L型钙通道的稳态激活曲线负向移动,增加通道的激活,与此同时使其稳态失活曲线正向移动,钙通道的失活过程减缓,二者联合,使同等电压条件下,增加了钙离子通道的开放数量,导致电流增加。前期研究表明,H2O2可使左心房肌细胞中谷胱甘肽的数量和超氧化物歧化酶的活性下降,并且可增加丙二醛的生成,APO使细胞内抗氧化酶含量增加,并且可以减弱对多不饱和脂肪酸的攻击,从而降低氧化应激对左心房肌细胞的损伤[5]。
进一步研究显示,APO可通过影响CACNA1C mRNA和CaV1.2通道蛋白的表达,来调节左房细胞钙通道有效数量,从而影响ICa,L电流密度。提示我们APO不仅可以直接影响钙通道门控动力学机制改变ICa,L,还可通过调节钙通道基因及蛋白表达来改变ICa,L电流密度。众所周知,L-钙通道是构成心房肌动作电位复极的主要电流,尤其是对APD50的改变尤为重要[15-17]。本研究发现,APO通过增加ICa,L电流密度,可以延长APD,特别是APD50。这对于阻滞房颤的发生非常有利,也是减少房颤发生和维持的细胞电生理学基础。
本研究仅局限于细胞水平,我们应进一步在整体动物水平进行探究,尤其需要观察APO对氧化应激诱发房颤的体表心电图及房颤发生率的影响。尽管如此,本研究对于揭示药物心房肌细胞电生理和分子机制仍有一定意义。

