艾曲泊帕治疗异基因造血干细胞移植后持续性血小板减少的多中心临床研究
王怡然,张素平,李 丽,曹伟杰,张 然,许慧敏,郭 荣,谢新生,刘忠文,周 健,
万鼎铭1)
1)郑州大学第一附属医院血液科 郑州 450052 2)河南省人民医院血液科 郑州 450003 3)河南省肿瘤医院血液科 郑州 450008
异基因造血干细胞移植(allogeneic hematopoietic stem cell transplantation,allo-HSCT)是治愈多种血液系统疾病的重要甚至唯一手段[1],移植后良好的造血和免疫重建是决定移植成败的重要因素之一。Allo-HSCT后持续性血小板减少是移植后常见并发症之一,包括原发性血小板减少(primary thrombocytopenia,PT)和继发性血小板减少(secondary failure of platelet recovery,SFPR)。Allo-HSCT后持续性血小板减少常引起致命性出血,导致移植相关死亡率增高,严重影响患者生存质量[2]。目前allo-HSCT后持续性血小板减少的治疗尚无标准方案,常用的治疗方法有糖皮质激素、重组人血小板生成素(recombinant human thrombopoietin,rhTPO)、重组人白细胞介素-11(recombinant human interleukin-11,rhIL-11)、静脉注射用人免疫球蛋白,但以上治疗措施反应率在不同患者间异质性大,且一旦治疗无效,患者预后极差[3]。为预防出血,多数患者需要输注血小板,但输注血小板也可能导致诸多不良反应,如急性肺损伤、心力衰竭、病毒感染等[4],部分患者还可能出现无效输注,因此输注血小板并不能作为长期预防出血的手段。对于allo-HSCT后持续性血小板减少患者,急需寻得新的治疗方法以改善疗效。
艾曲泊帕是一种新型口服非肽类血小板生成素受体激动剂,已被美国食品药品监督管理局批准用于治疗免疫性血小板减少症和重型再生障碍性贫血(severe aplastic anemia,SAA)。此外,研究[5-6]显示艾曲泊帕在治疗骨髓增生异常综合征(myelodysplastic syndrome,MDS)与急性髓系白血病(acute myeloid leukemia,AML)相关的血小板减少中也显示出良好的治疗效果。近年来,一些研究[7-9]将艾曲泊帕尝试用于治疗allo-HSCT后持续性血小板减少,但由于缺乏大样本的临床研究,其临床安全性及疗效尚需更多临床证据。本研究旨在通过分析确诊为allo-HSCT后持续性血小板减少并接受艾曲泊帕治疗的多中心的40例患者的临床资料,探讨该药物的有效性及安全性。
1 对象与方法
1.1研究对象选取2018年1月1日至2020年5月31日于郑州大学第一附属医院、河南省人民医院、河南省肿瘤医院血液科诊断为allo-HSCT后持续性血小板减少并应用艾曲泊帕治疗的40例患者作为研究对象。其中郑州大学第一附属医院24例,河南省人民医院10例,河南省肿瘤医院6例。纳入标准:①符合allo-HSCT后持续性血小板减少诊断标准。②完全供者嵌合。③无原发病复发。排除标准:合并Ⅲ~Ⅳ度的急性移植物抗宿主病(graft versus-host disease,GVHD)、严重感染或移植相关血栓性微血管病。通过查阅门诊或住院病历进行电话随访,随访截止时间为2020年8月31日。
1.2定义[10]血小板植入定义为移植后脱离血小板输注情况下,血小板计数连续7 d≥20×109个/L;PT定义为移植后粒系及红系植入,血小板超过30 d未植入;继发性血小板减少(SFPR)定义为移植后血小板植入后再次出现血小板计数<20×109个/L或需要输注血小板,持续7 d以上,7 d中的第1天定义为SFPR的发生时间。接受艾曲泊帕治疗前,患者均行骨髓细胞学检查了解巨核细胞系统增生情况。巨核细胞计数采用骨髓涂片,面积约1.5 cm×3.5 cm,巨核细胞数在7~35个/片为正常。
1.3治疗方案
1.3.1 预处理方案和GVHD预防方案 参考文献[11-13]。
1.3.2 艾曲泊帕用药方案 初始给药剂量25 mg/d,根据血小板计数及不良反应调整用药剂量。体重<50 kg患者最大剂量50 mg/d,体重≥50 kg患者最大剂量75 mg/d。本组13例诊断为PT/SFPR后立即应用艾曲泊帕作为一线治疗(一线治疗组);27例应用rhTPO[300 IU/(kg·d)]和(或) rhIL-11[25~50 μg/(kg·d) ]2周以上无效,序贯应用艾曲泊帕作为二线治疗(二线治疗组)。
1.3.3 血小板输注 血小板计数<20×109个/L、有出血倾向时,输注血小板。
1.4疗效及不良反应评价根据血小板计数及输注血小板情况评价疗效[10]。有效(overall response,OR)定义为血小板计数≥20×109个/L,连续7 d脱离血小板输注。其中完全有效(complete response,CR)定义为血小板计数≥50×109个/L,连续7 d脱离血小板输注;部分有效(partial response,PR)定义为血小板计数(20~50)×109个/L,连续7 d脱离血小板输注。无效(no response,NR)定义为最大耐受剂量下应用8周,血小板计数<20×109个/L或未脱离血小板输注。依据美国国立癌症研究所毒性分级标准(NCI-CTCAE)5.0版评价不良反应。
1.5统计学处理采用SPSS 25.0进行数据分析。正态分布的定量资料应用均数±标准差描述,组间比较应用t检验或校正的t检验。偏态分布的定量资料应用中位数及四分位数[M(T25,T75)]描述,组间比较应用非参数检验。定性资料应用例(%)表示,组间比较应用χ2检验、校正的χ2检验或Fisher精确概率法。检验水准α=0.05。
2 结果
2.1患者一般资料见表1。治疗前所有患者均进行骨髓穿刺术。23例患者巨核细胞减少,其中11例骨髓涂片中未见巨核细胞。9例曾诊断为急性GVHD,开始治疗前均已治愈。一线治疗组与二线治疗组患者的年龄、性别、原发病、供者类型、供受者血型、移植物单个核细胞(mononuclear cell,MNC)及CD34+细胞计数、血小板减少类型、治疗前巨核细胞数比较差异均无统计学意义。
2.2艾曲泊帕的应用情况见表2。开始艾曲泊帕治疗的中位时间为移植后73(53,111) d,起始剂量均为25 mg/d,最大用药剂量(25~75) mg/d。开始治疗时,2例患者合并皮肤慢性GVHD,1例合并肝脏慢性GVHD,12例合并巨细胞病毒(cytomegalovirus,CMV)血症。2例合并EB病毒(Epstein-Barrvirus,EBV)血症;治疗过程中2例新发皮肤慢性GVHD,4例新发肠道急性GVHD,9例新发CMV血症,2例新发EBV血症,均在应用抗GVHD及抗病毒治疗后好转或痊愈。截止到末次随访时,有效患者中位用药时间63(44,99) d,其中已停药患者中位用药时间59(44,80) d。一线治疗组与二线治疗组患者开始治疗时间、用药剂量、治疗期间合并症、用药时间比较差异均无统计学意义。
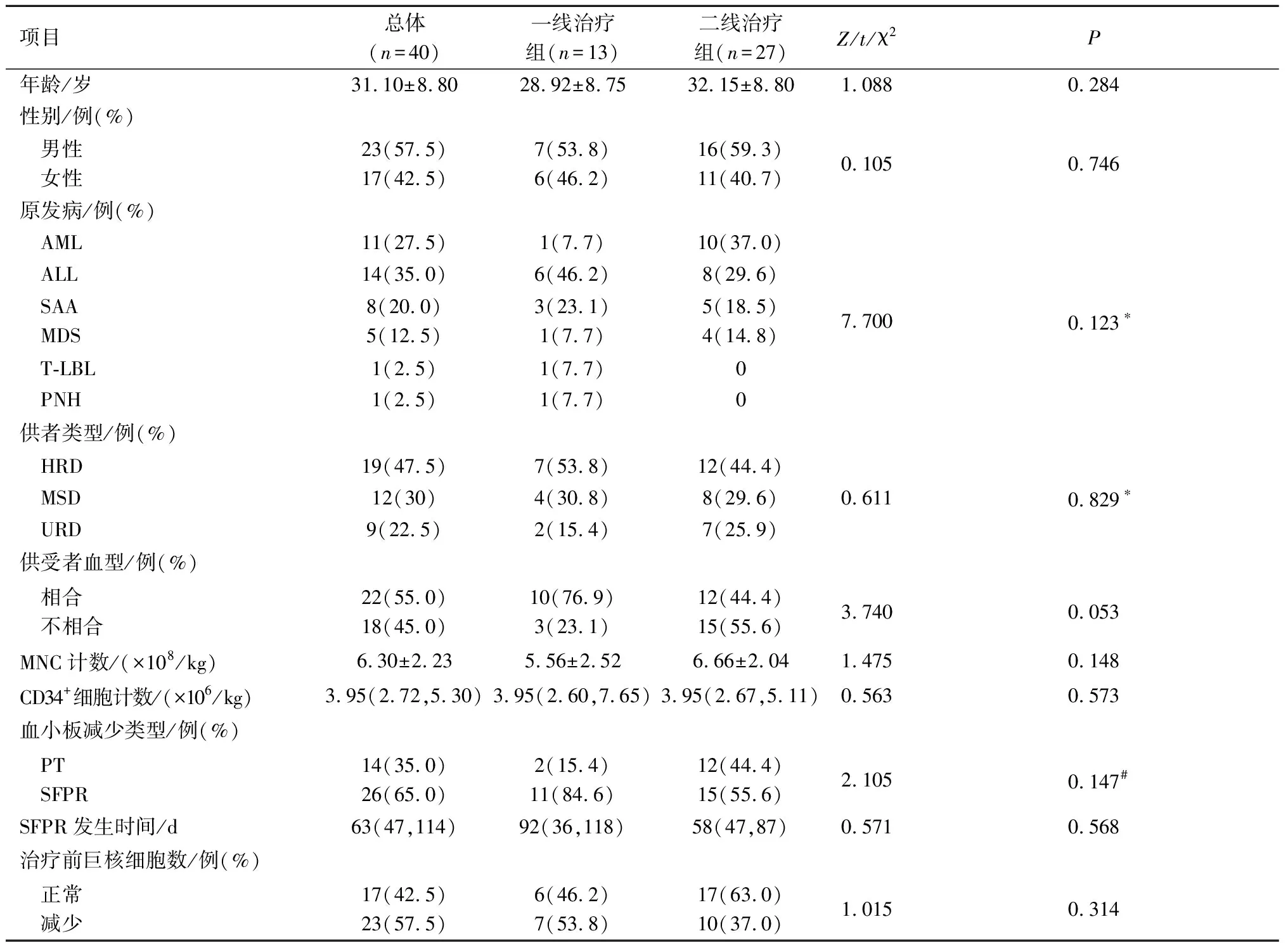
表1 40例患者一般资料

表2 2组患者用药情况
2.3艾曲泊帕的疗效40例患者中OR 28例(70.0%),其中CR 21例(52.5%),PR 7例(17.5%)。治疗后获得OR的中位时间为21(12,34) d,获得CR的中位时间为37(20,53) d。将OR患者接受艾曲泊帕治疗前与停药时或末次随访时的血细胞计数进行对比,一、二线治疗组中OR患者的血小板计数均获得显著提高,二线治疗组中OR患者的血红蛋白浓度也获得改善(表3)。末次随访时共有8例(20.0%)患者死亡。28例OR患者中2例(7.1%)患者因感染性疾病死亡;12例NR患者中6例(50.0%)患者死亡,其中1例(8.3%)因疾病复发死亡,2例(16.7%)因难治性肠道急性GVHD死亡,3例(25.0%)因感染性疾病死亡。。
一线治疗组患者与二线治疗组患者OR率及CR率差异无统计学意义,但一线治疗组获得OR所需时间更短。SFPR患者的CR率较PT患者更高。治疗前骨髓中巨核细胞数正常患者的OR率及CR率均高于减少患者,且获得OR及CR所需时间更短,见表4、5。
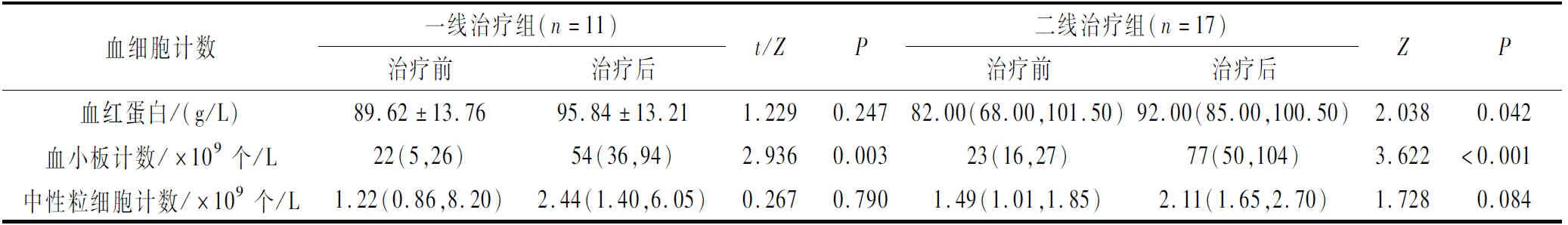
表3 OR患者治疗前后血细胞计数比较
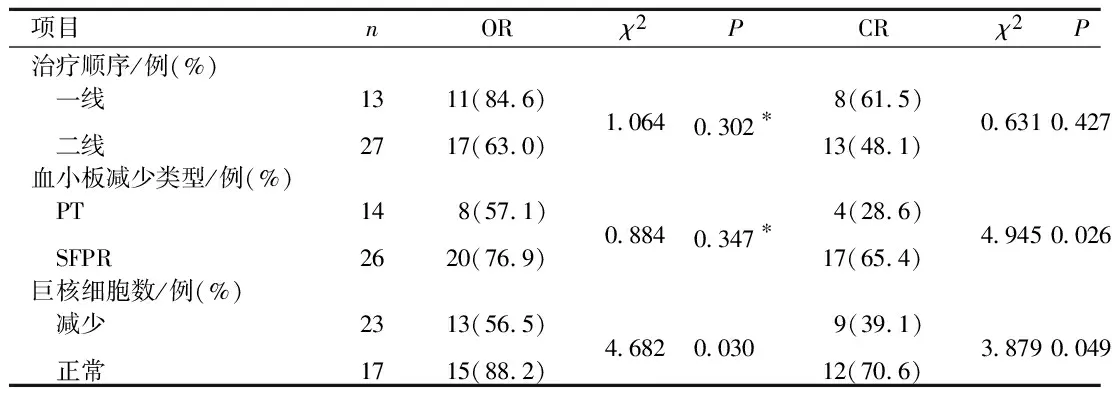
表4 不同治疗顺序、血小板减少类型、巨核细胞数目患者疗效比较

表5 不同治疗顺序、血小板减少类型、巨核细胞数患者起效时间比较
2.5不良反应9例(22.5%)患者在治疗过程中出现1~2级肝损伤,经调整艾曲泊帕剂量和(或)应用保肝药物治疗后好转或痊愈。所有患者均未发生明显的骨髓纤维化、血栓形成或其他3~4级毒性反应。
3 讨论
目前allo-HSCT后持续性血小板减少的发病机制尚不明确,可能与血小板生成减少及破坏增多有关[14]。艾曲泊帕通过与骨髓巨核细胞表面的血小板生成素受体(TPO-R)的跨膜结构域结合,激活JAK2/STAT5通路,诱导巨核细胞增殖与分化,促进血小板生成[15]。此外,艾曲泊帕还可以通过阻止血小板凋亡而延长血小板寿命[16]。一项关于艾曲泊帕治疗移植后持续性血小板减少的随机、双盲、安慰剂对照的Ⅱ期临床试验[17]报道,与对照组相比,试验组患者血小板计数恢复到50×109个/L的比例更高,表明艾曲泊帕可以有效改善移植后持续性血小板减少患者的血小板计数。
Fu等[18]应用艾曲泊帕治疗38例单倍体移植后糖皮质激素治疗无效的难治性血小板减少患者,总有效率为63.2%,有效患者停药后仍能维持稳定的血细胞计数,表明艾曲泊帕作为二线治疗方案疗效肯定。本研究中,应用艾曲泊帕一线治疗与二线应用的患者具有相似的OR率及CR率,且获得OR所需时间更短,提示艾曲泊帕作为治疗allo-HSCT后持续性血小板减少的一线用药也可以获得可靠的疗效。此外,上述研究发现治疗前骨髓中巨核细胞数是影响艾曲泊帕疗效的独立危险因素。本组病例中,应用艾曲泊帕治疗前骨髓中巨核细胞数正常患者OR率及CR率更高,起效更快。该研究结果可指导我们对接受艾曲泊帕治疗的患者进行预后分层,为下一步的精准诊疗提供可能。
艾曲泊帕在治疗难治性再生障碍性贫血时,可使多系血细胞计数获得改善,本研究中观察到同样的现象,这或许得益于艾曲泊帕可以通过TPO-R途径直接刺激造血干细胞[19]。此外,艾曲泊帕可以促进造血干细胞和祖细胞的DNA修复,增加其基因组的稳定性、自我更新及增殖能力[20]。
本组病例中,9例患者在治疗过程中出现肝功能损伤,但程度轻微,经调整艾曲泊帕剂量、应用保肝药物后好转或治愈,对治疗的可持续性未造成影响。3例患者在治疗开始时合并GVHD,6例患者在治疗过程中新发GVHD,在应用抗GHVD治疗后均好转或治愈,表明艾曲泊帕可以安全的作用于GVHD患者。既往的研究[15]发现艾曲泊帕持续刺激巨核细胞生成,可能导致骨髓网硬蛋白增多,引起骨髓纤维化;一项关于艾曲泊帕治疗免疫性血小板减少症的研究[21]报道部分患者观察到血栓形成或血栓栓塞发生,但上述不良反应在本组病例中均未观察到。
综上所述,本研究结果显示,应用艾曲泊帕治疗allo-HSCT后持续性血小板减少可使多数患者的血小板计数显著提高,且药物不良反应轻微,患者耐受性良好,是一种安全、有效的治疗方案,未来有成为一线治疗方案的潜力。同时,本研究结果也为未来进行多中心、前瞻性、随机对照研究提供了基础和前期数据。

